淹水胁迫对木芙蓉幼苗形态及部分生理指标的影响
童丽丽,王哲宇,许晓岗
(1.金陵科技学院园艺园林学院,江苏 南京 210038;2.苏州基业生态园林股份有限公司,江苏 苏州 215024;3.南京林业大学生物与环境学院,江苏 南京 210037)
木芙蓉(Hibiscusmutabilis)为锦葵科落叶小乔木或灌木,夏末秋初开花,花色或粉或白,娇艳可爱,是我国著名的园林秋季观花树种.木芙蓉原产地为四川、云南等地,现全国各地广泛栽培,“晓妆如玉暮如霞”,花色一日三变,给人奇特和美妙之感[1],经常配置在水滨、庭院中[1],也可与山石配合[2].木芙蓉生态效益好,发达的根系可以起到护坡的作用[2].其花、叶和根均可入药,具有抑菌、抗病毒、免疫调节、抗肿瘤等广泛的药理作用[3].目前,木芙蓉的研究主要集中在园林观赏价值、繁殖方法、药用价值、抗性方面[1-6],很少有淹水胁迫对其形态、光合作用、生理特性变化的研究报道.本文以木芙蓉1 a生幼苗为试验材料,研究在初秋淹水胁迫下形态、光合作用、生理指标的变化情况,以期为木芙蓉在湿地景观中的应用提供一定的理论基础.
1 试验材料与方法
1.1 试验材料及试验设计
2018年5月,于本地苗圃购得木芙蓉1 a生实生苗30盆,放在金陵科技学院园艺站大棚中正常养护管理.2018年9月4日,挑选生长一致的苗木(苗高(31.25±0.35)cm,地径(2.45±0.10)mm)各5盆,分为2组:1组土壤含水量完全饱和,模拟淹水危害;另1组保持土壤含水量在75%左右,为CK组.每组设3个重复.试验期间,温室内平均温度为25 ℃左右,平均湿度为70%左右.设每7 d为1个试验周期,共5个周期,每个周期最后一天测量苗高、地径以及净光合速率、气孔导度、胞间CO2浓度、SOD活性、POD相对活性、MDA含量.
1.2 测定方法
1)苗高、地径.用皮尺(0.1 cm)测量苗高,用游标卡尺(0.01 cm)测量地径,测定部位为高于土面的2 cm处.
2)光合特性.用Li-6400XT便携式全自动光合仪测定净光合速率、气孔导度和胞间CO2浓度.
3)生理生化指标.采用NBT显色法测定SOD活性,采用愈创木酚法测定POD相对活性,采用硫代巴比妥酸法测定丙二醛(MDA)含量.
1.3 数据处理
运用SPSS 19数据处理软件进行数据分析处理.
2 结果与分析
2.1 淹水胁迫对木芙蓉幼苗形态指标的影响
2.1.1 淹水胁迫对木芙蓉幼苗叶片和根系的影响
试验结果表明:木芙蓉幼苗对淹水胁迫适应性良好,其叶片形态和长势与CK组没有差别,但根系发生了很大变化,表现为主根的生长方向发生改变,向下生长的根变成了侧向生长,甚至向上生长,根系上的须根大量出现.分析原因认为:大量新生不定根的产生便于氧气在木芙蓉根系中传输及扩散,以缓解淹水状态下无氧呼吸对根系的伤害[7].
2.1.2 淹水胁迫对木芙蓉幼苗苗高和地径的影响
木芙蓉在淹水胁迫不同时期的苗高和地径见表1.由表1可见:淹水胁迫下,木芙蓉幼苗苗高相对生长速率与CK组差别不大,说明淹水胁迫对木芙蓉幼苗苗高生长的影响不大,但不同时期淹水对苗高增长有一定的促进作用(P<0.05);淹水胁迫对木芙蓉幼苗地径生长也起到了一定的促进作用,第1周期增长最快,达到了0.78 mm.随着淹水时间的延长,淹水组地径增长率比CK组要大(P>0.05),其相对生长率要比CK组高23.78%,这可能是因为木芙蓉根部变粗大有利于氧气从植株地上部分向地下扩散,从而保证根系正常的呼吸代谢.
注:相同字母表示差异不显著,不同字母表示差异显著.
2.2 淹水胁迫对木芙蓉幼苗光合作用的影响
木芙蓉在淹水胁迫不同时期的光合作用变化见表2.由表2可见:淹水胁迫开始后的前3个周期,木芙蓉幼苗的净光合速率明显低于CK,但从第4周期末开始,淹水组木芙蓉幼苗净光合速率明显超过CK,达到最高值,然后逐渐下降,一直到第5个周期结束.淹水处理结束时,淹水组幼苗的净光合速率为CK的1.12倍(P>0.05).
木芙蓉叶片气孔导度变化在淹水处理的前3个周期呈上升趋势,在第3个周期末达到最高,为刚开始时的1.34倍.CK组木芙蓉幼苗的气孔导度在前3个周期稍微低于CK组,在第4周期末达到最高,明显高出淹水处理组,为淹水组的1.13倍,随后下降.试验处理结束时,CK组为淹水组的1.42倍(P>0.05).
木芙蓉幼苗在淹水处理过程的前3个周期中,叶片细胞间CO2浓度显著高于CK(P>0.05).CK组在第4个周期达到最高值,然后逐渐下降,但第4,5个周期胞间CO2浓度明显高于淹水组,分别为淹水组的1.17倍和1.24倍,总体呈现出先上升后下降的趋势.
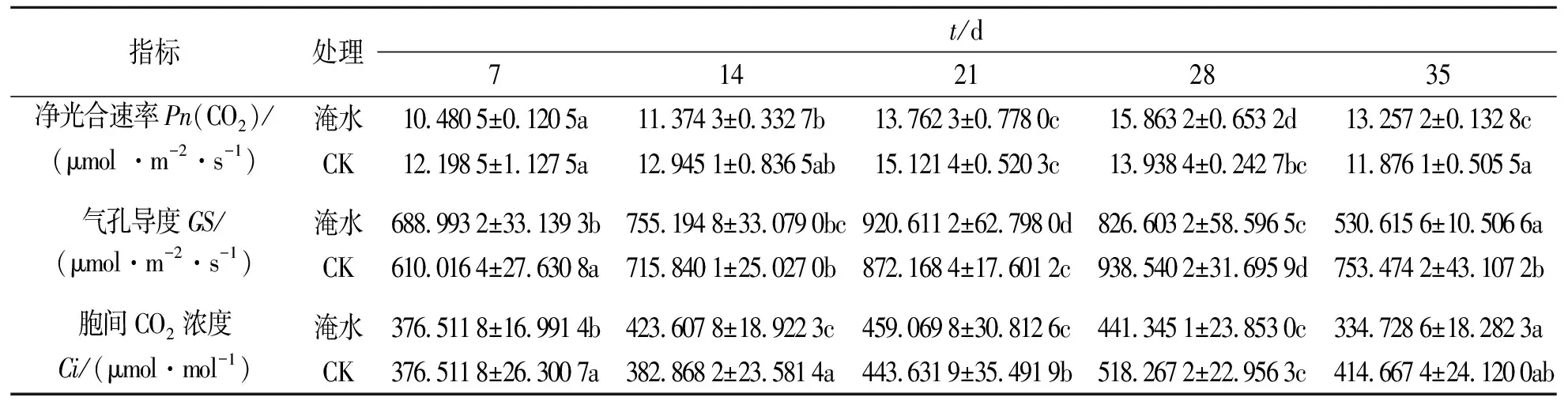
表2 木芙蓉在淹水胁迫不同时期的光合作用Tab.2 Photosynthesis of Hibiscus mutabilis during different periods of flooding stress
注:不同小写字母表示不同日期之间差异显著(P<0.05).
2.3 淹水胁迫对木芙蓉幼苗部分生理指标的影响
木芙蓉在淹水胁迫不同时期的部分生理指标见表3.由表3可见:木芙蓉幼苗叶片SOD 活性总体呈现出先上升后下降再上升的趋势,在淹水处理第2周期末达到最大值.淹水处理结束时,淹水胁迫下的木芙蓉幼苗叶片SOD值为CK的1.42倍(P<0.01).木芙蓉幼苗叶片能较长时间维持较高的活性,可有效减轻叶片来自O2-的伤害.
淹水胁迫和CK组木芙蓉叶片POD活性呈现先上升后下降再上升再下降的趋势,均在第2周期末达到高峰.淹水组木芙蓉叶片POD活性比对照组要高一些,为对照组的1.03~1.31倍(P>0.05).
淹水胁迫和对照组木芙蓉叶片MDA含量呈现先上升后下降再上升再下降的趋势,淹水组在第2周期末达到高峰,对照组在第5周期末达到高峰.淹水组木芙蓉幼苗叶片MDA含量约为对照组的1.1~1.4倍(P<0.01).

表3 木芙蓉在淹水胁迫不同时期的部分生理指标Tab.3 Physiological indicators of H.mutabilis in different periods of flooding stress
注:不同小写字母表示不同日期之间差异显著(P<0.05).
3 结论与讨论
3.1 结 论
淹水胁迫对木芙蓉幼苗苗高没有太大影响,叶片形态和长势与CK组相比没有差别,但地径比对照组有较大增长,根部产生了大量新生的不定根,且根部中上部也形成了根,这是为了提高吸收O2组织的总面积,并促进其在植物体内的扩散[7],缓解淹水状态下无氧呼吸对根系的伤害.
在淹水胁迫初期,木芙蓉叶片净光合速率、气孔导度与CK相比均有不同程度的降低,随后有所回升,甚至超过CK.为了适应淹渍环境,木芙蓉幼苗的叶片气孔迅速关闭,气孔导度下降,从而导致叶片吸收CO2的能力下降,使得胞间CO2浓度也随之下降,从而降低了叶片的净光合效率.
淹水胁迫导致木芙蓉体内产生了大量的活性氧,SOD和POD活性迅速增加.由于长期处于低氧胁迫条件,细胞内产生大量自由基,没有及时去除的自由基打破了细胞膜结构,导致膜脂过氧化产物MDA的积累.
由本次试验结果可以推断出木芙蓉幼苗具有一定的抗淹水能力,为较耐水湿树种,可种植于湿地景观中.
3.2 讨 论
中国很多园林文献都有“水边配置木芙蓉”的说法,说明中国自古以来就发现了该植物对淹水的良好适应性,但一直没有试验数据证明.本次试验的结论和文献[7]一致,说明木芙蓉具有良好的耐水湿特性,证明了木芙蓉和枫杨、构树、桑树等[7-10]耐水湿木本植物一样,均具有相应的先天形态适应机制来适应淹水胁迫,主要体现在这些植物根部都有大量不定根出现,可以有效缓解无氧呼吸对根系的伤害.
为了适应淹渍环境,木芙蓉幼苗叶片气孔关闭,气孔导度下降,叶片吸收CO2的能力下降,胞间CO2浓度也随之下降,从而导致叶片的净光合效率降低.为了适应淹水胁迫下无氧的环境,木芙蓉体内的氧化酶平衡被打破,SOD和POD迅速增高,而大量自由基的产生又使MDA大量积累,这些光合和生理指标的改变均是为了适应淹水这种逆境产生的应激反应.

