壳聚糖改性的聚乳酸-羟基乙酸共聚物神经导管的制备、表征及其生物学性能
张仲宁,薛东鹤 ,张婉衡,张明生,郑国强
1)郑州大学第二附属医院骨科 郑州 450014 2)郑州大学材料科学与工程学院 郑州 450001
周围神经的损伤及缺损会导致患者肢体感觉及运动功能障碍,造成生活及劳动能力的下降[1]。目前,自体神经移植是临床判断神经修复效果的金标准[2],但是自体神经来源有限,且存在增加创伤、遗留供区感觉障碍、神经束支对合及匹配不佳等诸多缺点[3]。异体神经移植虽避免了供体的限制,但其引起的免疫排斥反应往往导致移植失败、效果不确切等问题[4]。因此,对周围神经损伤的治疗仍是临床工作的一大挑战。随着组织工程技术和新型材料的发展,用生物材料构建的神经导管被逐渐应用于修复周围神经损伤,在神经修复领域有着广阔的前景[5-6]。神经导管是模仿神经通路自然结构的一个纵向组织,作为轴突延伸的一个通道,引导再生神经与靶神经重新相连,而导管本身并不影响神经修复。将天然材料和合成材料相结合,制备兼具良好生物相容性、机械性能以及优异的生物降解性能的神经导管用于周围神经损伤的修复已成为目前国内外研究的热点。聚乳酸-羟基乙酸共聚物(PLGA)是聚乳酸(PLA)和聚羟基乙酸(PGA)的共聚物,已被FDA认证用于创伤缝合[7]。PLGA在力学性能和降解时间上都具有很大的优势,可通过调整PLA和PGA的比例调控聚合物的强度和降解速度[7],使得PLGA成为神经修复领域中最具吸引力的材料。有研究[8-9]表明,细胞在材料表面的黏附、增殖、分化等一系列过程会受到材料表面的理化性质的影响,如材料表面的亲/疏水性、拓扑结构和表面粗糙度等。因此组织工程材料和细胞应有良好的接触界面,以维持细胞表型、生长、增殖和分化,并促进细胞特异性基因表达。在高聚物材料表面固定生物活性分子是改善材料亲水性能的有效方式之一。壳聚糖是一种天然大分子,它具有优良的生物相容性和可降解性,并常常被用作表面改性的材料。本研究通过表面截留法利用壳聚糖改善PLGA材料亲水性等性能,使其更好地用作神经修复支架。
1 材料与方法
1.1壳聚糖改性PLGA神经导管的制备将PLA∶PGA(体积比)不同比例的PLGA[分别为50∶50,65∶35,70∶30,75∶25和85∶15]加入二甲基甲酰胺(DMF)和四氢呋喃(THF)(体积比为1∶1)中溶解,配制成220 g/L的静电纺丝溶液。把注入纺丝溶液的注射器固定在KH-2型静电纺丝机(济南良睿科技有限公司)注射泵上,流速设为2.4 mL/h,纺丝电压调整为20 kV。接收装置为带有铝箔的旋转滚筒,针头与接收装置间距18 cm,滚筒转速1 800~2 000 r/min。将得到的PLGA纤维膜裁剪成3.5 mm×2 mm大小,在直径1.6 mm钢针上按 PLA组分比例增长的顺序层层卷绕,再置于PBS中静置1 min,抽去钢针得到PLGA神经导管。
将PLGA神经导管放置在20 g/L的2,2,2-三氟乙醇(TFE)中溶胀20 min,取出后分别在含有15 mg(CS-15)、20 mg(CS-20)、25 mg(CS-25)、30 mg(CS-30)壳聚糖的冰醋酸溶液(冰醋酸质量浓度为10 g/L)中浸泡24 h,去离子水清洗并干燥。未改性的PLGA神经导管为CS-0。
1.2神经导管的性能测试与表征
1.2.1 形貌表征 将PLGA神经导管观察面进行喷金处理,利用扫描电子显微镜(Zeiss MERLIN Compact,德国)观察其微观形貌。用图像分析软件Image J分析纤维直径。
1.2.2 傅里叶变换红外光谱测试 为观察壳聚糖对PLGA神经导管改性的效果,采用傅里叶变换红外光谱仪通过衰减全反射法(ATR)对几种神经导管进行测试,扫描范围为4 000~500 cm-1。
1.2.3 接触角的测定 采用表面水接触角实验对改性前后的导管支架进行亲水性表征的检测。将PLGA神经导管沿纵向裁开平铺,滴加5 μL水,利用接触角测量仪(上海中晨数字技术设备有限公司)在室温条件下测定神经导管内表面和外表面接触角。每个样品测5个点取平均值。
1.2.4 孔隙率的测试 将PLGA神经导管沿纵向裁开平铺,测量其长、宽、厚以及干重,计算密度。根据表观密度和PLGA的标准密度(ρ0=1.22 g/cm3)计算样本的孔隙率(ε):ε(%)=(1-ρ/ρ0)×100/%。
1.2.5 力学性能的测定 利用夹持装置夹持PLGA神经导管样品,在万能拉伸试验机(EZ-LX单柱精密拉伸实验机,岛津(中国)有限公司)上进行拉伸试验。夹持长度为15 mm,加载速度为5 mm/min。实验均在标准大气压条件下进行,采用千分尺测定样品的厚度。每个样品测5个点,取厚度平均值。每个样品平行测3组数据。
1.3细胞相容性检测
1.3.1 大鼠神经施万细胞(RSC细胞)的培养 用含有体积分数10%胎牛血清的DMEM培养基复苏液氮冻存的RSC96细胞,置于37 ℃、体积分数5% CO2的恒温培养箱内培养,每隔2 d换1次培养基。观察细胞的生长状态,当贴壁细胞融合度达到80%时用胰蛋白酶消化传代。
1.3.2 DMEM培养基预处理 将CS-0和CS-15 PLGA神经导管分别放入含有体积分数10%胎牛血清的DMEM培养基中,置于37 ℃、体积分数5% CO2的培养箱中培养48 h,弃去导管,得到预处理的DMEM培养基。
1.3.3 CCK-8实验 将经1.3.2中预处理的DMEM培养基分别培养RSC96细胞12、24 和48 h后加入CCK-8,再孵育4 h后450 nm波长下测定光密度值。以未处理的DMEM培养基为对照组。
1.3.4 病毒感染RSC96细胞 将RSC-96细胞接种于6孔板中(5×105个/孔)。培养24 h后加入感染指数(MOI)=30的pCDH-CMV-EF1-copGFP慢病毒(由郑州大学基础医学院微生物与免疫学教研室惠赠),并加入4 mg/L Polybrene轻轻混匀。24 h后更换培养基继续培养72 h。荧光显微镜下观察病毒感染情况。
1.3.5 细胞种植 将CS-0和CS-15 PLGA纤维膜分别缠绕载破片,放于体积分数3%的新洁尔灭溶液中浸泡24 h消毒灭菌,PBS清洗。将感染慢病毒的RSC96细胞以1×105个/mL加入铺有PLGA纤维膜缠绕的载玻片的24孔板中,置于37 ℃、体积分数5% CO2的培养箱中培养5 d。对照组用无PLGA纤维膜的载玻片种植细胞。
1.4统计学处理采用Graph Pad Prism 7进行数据整理和分析。应用单因素方差分析比较各项观察指标组间的差异,检验水准α=0.05。
2 结果
2.1壳聚糖改性后PLGA神经导管的形貌图见图1、表1。壳聚糖改性后的PLGA导管外表面(图1左)均有不同程度壳聚糖涂覆,且随着壳聚糖含量增大,涂覆范围随之增大,纤维直径随之增粗。导管内表面(图1右)壳聚糖涂覆较少,纤维排列更加紧密,改性后纤维直径增粗。

a~d:分别为15、20、25和30 mg壳聚糖改性;1~3:不同放大倍数镜下观;左:外表面形貌图;右:内表面形貌图
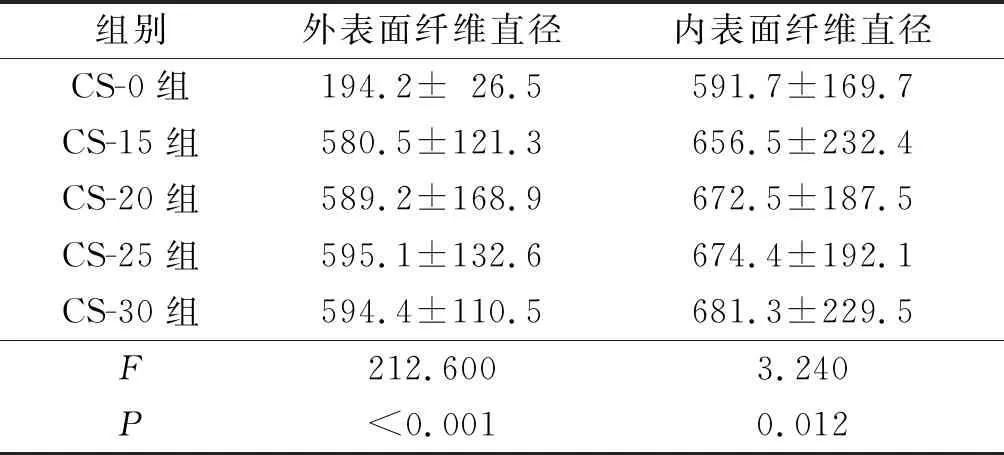
表1 壳聚糖改性对PLGA神经导管纤维直径的影响(n=3) nm
2.2壳聚糖改性对PLGA神经导管红外光谱的影响红外光谱分析结果显示,与CS-0相比,改性后的PLGA神经导管在1 647 cm-1和1 559 cm-1波长处均出现了壳聚糖酰胺Ⅰ与酰胺Ⅱ的特征吸收峰,表明经改性后壳聚糖被截留在导管表面(图2)。
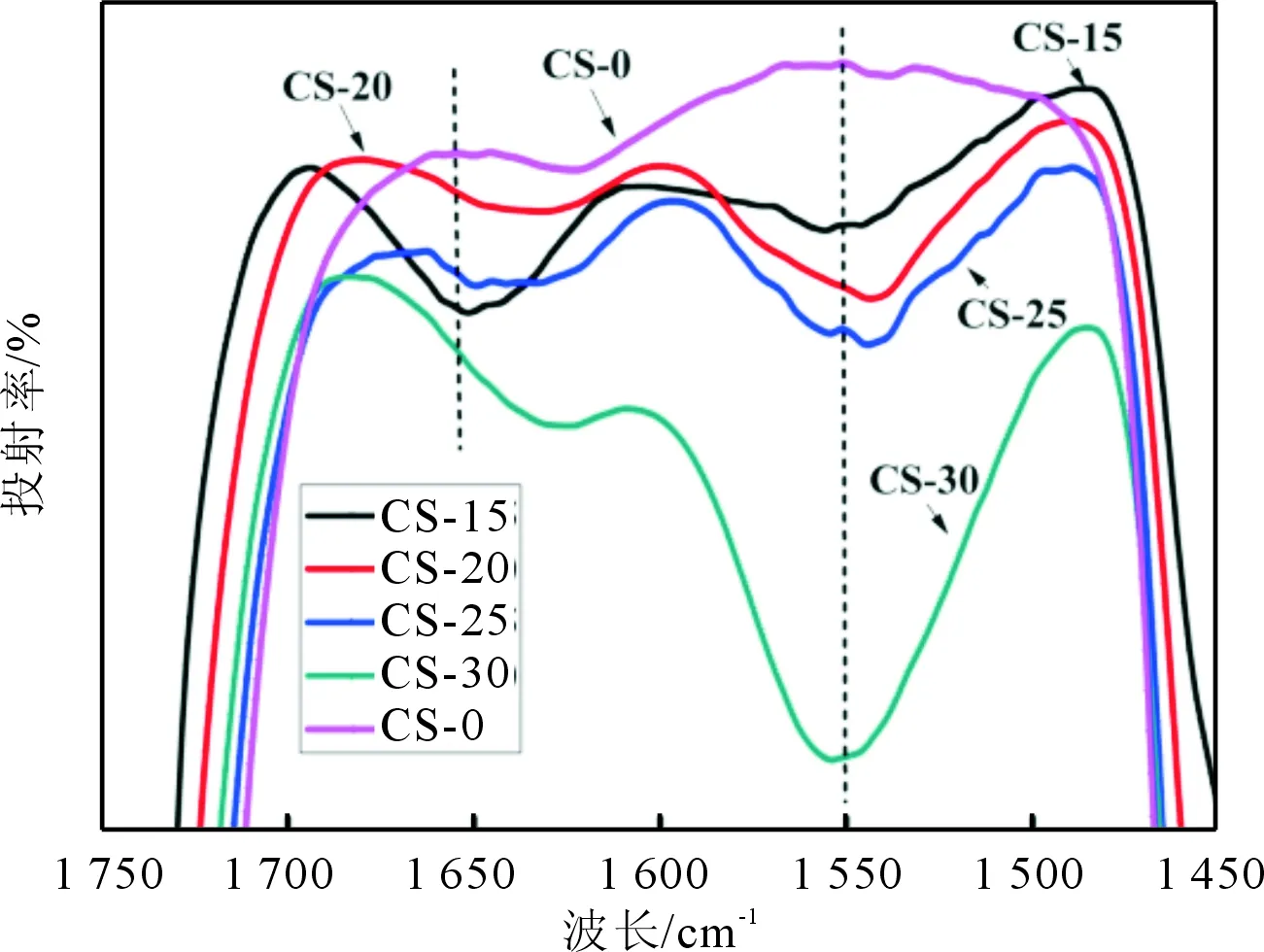
图2 壳聚糖改性对PLGA神经导管红外光谱图的影响
2.3壳聚糖改性对PLGA神经导管亲水性的影响见图3、表2。与CS-0 PLGA神经导管的外表面、内表面接触角相比,经不同浓度壳聚糖改性后PLGA神经导管接触角均有一定程度的减小。
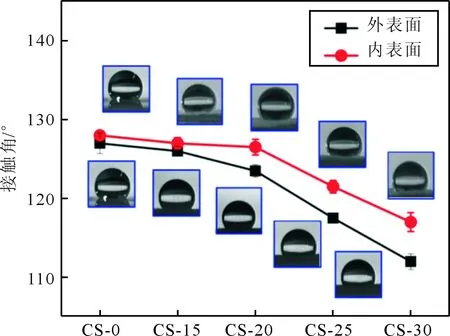
图3 壳聚糖改性对PLGA神经导管接触角的影响
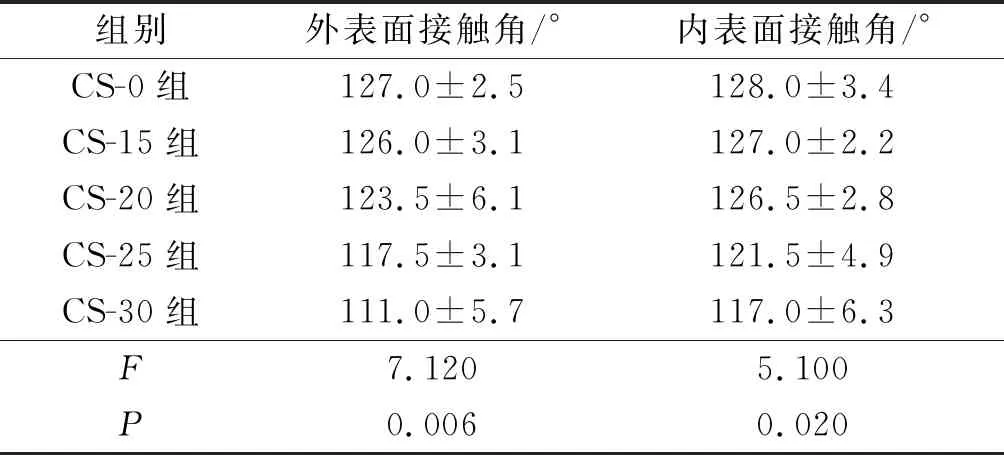
表2 壳聚糖改性对PLGA神经导管接触角的影响(n=3)
2.4壳聚糖改性对PLGA神经导管孔隙率和支架力学性能的影响见表3。从形貌分析中可以看到大量的壳聚糖黏附在纤维膜表面,覆盖了纤维膜的孔隙。与CS-0 PLGA神经导管的孔隙率相比,经不同浓度壳聚糖改性后PLGA神经导管孔隙率降低,且壳聚糖浓度越高,孔隙率的下降幅度越大。与CS-0 PLGA神经导管相比,经壳聚糖改性后PLGA神经导管的力学强度均有所提高,拉伸强度分别提高了约39.4%、70.4%、74.6%和90.1%(P<0.001)。
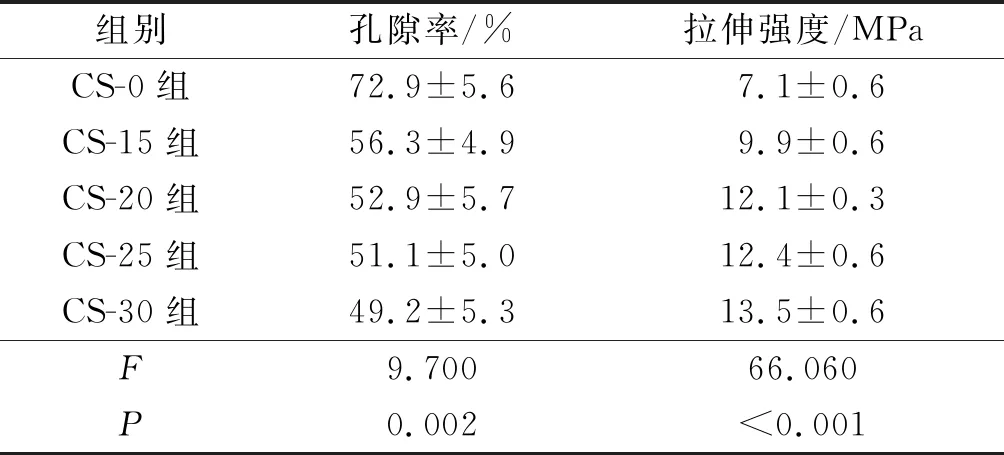
表3 壳聚糖改性对PLGA神经导管孔隙率和伸强度的影响(n=3)
2.6壳聚糖改性的PLGA神经导管对RSC96细胞增殖的影响见表4。与未处理的DMEM培养基培养的RSC96细胞(对照组)相比,PLGA预处理组(CS-0组)和15 mg壳聚糖改性PLGA预处理组(CS-15组)细胞增殖差异无统计学意义,表明RSC96细胞在壳聚糖改性PLGA导管中可以正常增殖。
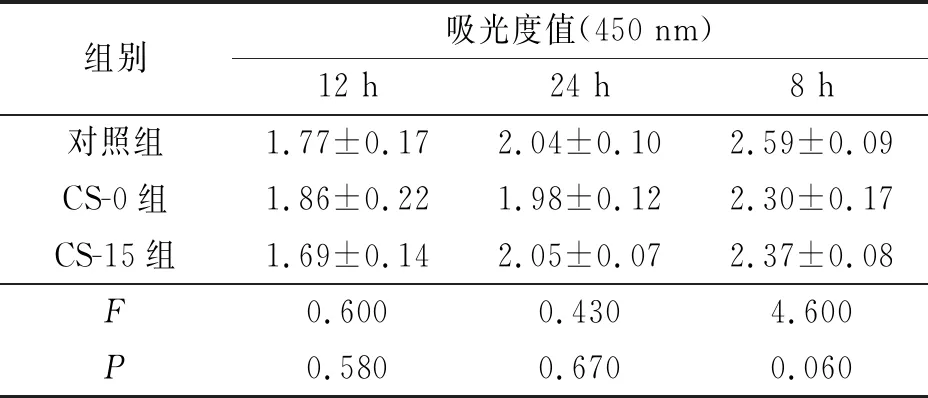
表4 壳聚糖改性的PLGA神经导管对RSC96细胞增殖的影响(n=3)
2.7RSC96细胞在壳聚糖改性的PLGA纤维膜上的生长见图4。将慢病毒感染的RSC96细胞种植在纤维膜上培养5 d后,在荧光显微镜下可观察到RSC96细胞在CS-0和CS-15纤维膜上均沿纤维取向方向生长,生长为牵伸状;而直接在玻片上生长的细胞均匀分布,且成散乱无序的状态。
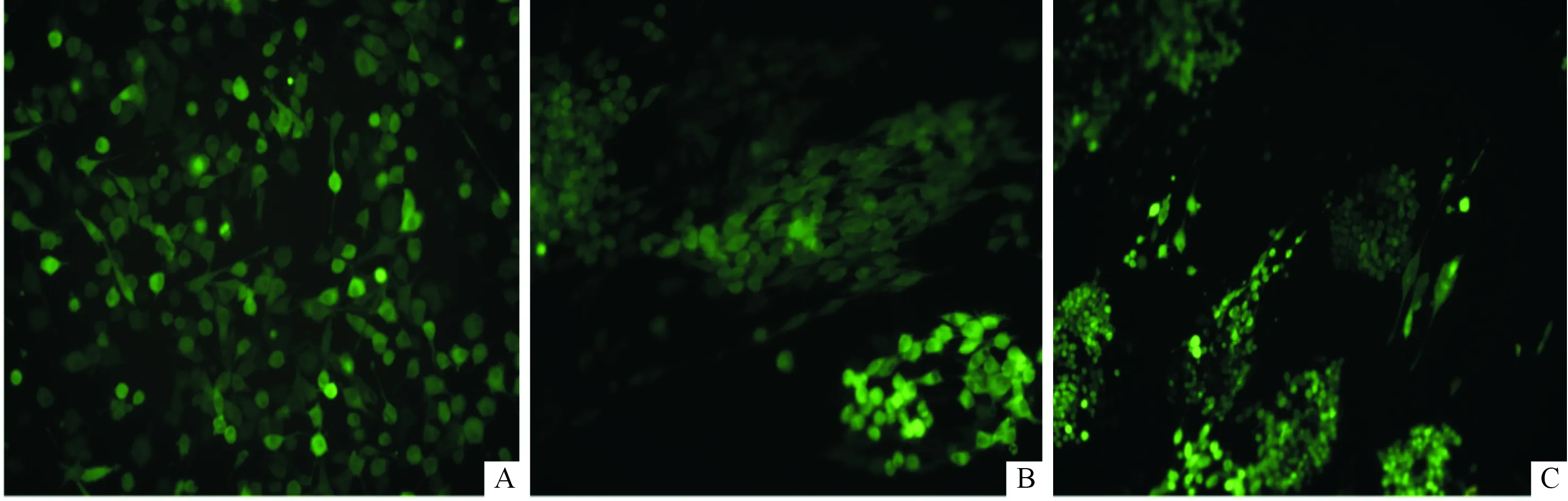
A:对照组;B:CS-0组;C:CS-15组
3 讨论
本文通过静电纺丝的方法制备出具有表面取向结构的PLGA纤维膜,经过高速旋转滚筒收集到的静电纺丝PLGA纤维呈现出良好的取向,并且直径均匀,未出现串珠等现象。为了防止导管材料降解过快或过慢,影响再生神经的生长,采用由内向外增长的顺序将5种PLA比例的PLGA纤维膜层层卷绕,制备梯度降解的神经导管支架(课题组之前的实验数据显示,导管降解发生时,PLGA从PLA∶PGA比例为50∶50到85∶15逐渐由内层开始降解;降解持续过程中,pH值相对稳定,在7.00~7.23浮动)。
在组织工程中,生物材料表面的亲水性对种子细胞的黏附有着重要的作用[10],适度的亲水性更有利于细胞的黏附、生长和增殖[11-12]。在高分子材料表面固定生物活性分子是改善材料亲水性能的有效方式之一,故本文利用壳聚糖改性PLGA纤维膜。结果显示,壳聚糖改性的PLGA外表面纤维直径变粗,这可能是纤维溶胀截留壳聚糖导致的;导管内表面壳聚糖涂覆较少,纤维经过溶胀-截留-消溶,纤维排列更加紧密,直径较改性前有增粗,但无外表面纤维直径改变明显,说明导管内表面截留的壳聚糖并不多;推测这可能是因为壳聚糖溶液比较黏稠、黏附在纤维膜表面,进入内表面较少。同时发现,随着壳聚糖浓度增大,接触角下降的幅度越大;推测由于壳聚糖是亲水性天然高分子材料,壳聚糖的浓度越大,截留在导管表面的壳聚糖越多,从而引起了导管表面亲水性的变化。
神经的修复和再生的环境需要具有适当的孔隙率,不仅为细胞的黏附、迁移、增殖提供空间,并且有利于营养物质的进入以及代谢产物的排出[13-14]。本文壳聚糖改性后导管支架的孔隙率均有所下降,这可能是因为壳聚糖不仅被截留在纤维内部,同时也会黏附在纤维表面和纤维多孔结构的空隙间,壳聚糖浓度越高,孔隙率的下降幅度越大。虽然孔隙率有所下降,但依然维持在正常的范围以内。
神经导管支架不仅需要具有合适的孔隙率,同时还要具备合适的力学性能,为神经细胞生长和分化提供良好的力学支撑[15]。本文通过检测神经导管的拉伸强度体现其力学性能。相对于改性前,随着壳聚糖改性浓度的增加,PLGA导管的拉伸强度增加。这一现象可能是因为经2,2,2-三氟乙醇的溶胀之后的PLGA导管放入壳聚糖溶液后,壳聚糖可进入导管支架的层之间间隙以及纤维之间的孔隙,之后的消溶过程不仅使导管表面截留部分壳聚糖,在导管管壁间、纤维之间也截留了部分壳聚糖,使导管的整体结构更加紧密,从而力学性能显著提高。
本文中将大鼠神经胶质细胞RSC96在CS-15 PLGA预处理的培养基中培养,细胞能够正常增殖且细胞活性没有明显变化,表明壳聚糖改性的PLGA导管具有良好的组织相容性。将RSC96细胞接种至壳聚糖改性的PLGA纤维膜上培养,细胞的排列以及细胞突触伸长的方向与纤维膜的取向一致,呈现出一定的方向性,表明细胞能够在此导管上沿纤维轴向迁移生长。这一特性对于神经引导性再生具有积极意义。神经细胞的引导性再生可加快功能性神经组织的延伸,促进受损区域神经组织与两端正常神经组织的桥接。
尽管如此,神经的再生以及功能的恢复可能需还要细胞外基质蛋白、神经生长因子等因素构成的微环境,本文中所制备的神经导管并未涉及,因此,构建具有神经再生微环境的PLGA神经导管并进行动物体内实验的验证将是下一步的工作重点。

