A群脑膜炎球菌发酵工艺的优化
安建科,郑 喆,王 倩,董继刚,冯君平,喻大鑫,马国荣,杜送田
(兰州生物制品研究所有限责任公司 甘肃省疫苗工程技术研究中心,甘肃 兰州 730046)
在大多数国家,脑膜炎奈瑟菌(Neisseria meningitidis,脑膜炎双球菌)都已被确认为导致脑膜炎和爆发性败血症的首要原因,并且已构成严重的公共卫生问题[1].绝大多数侵袭性脑膜炎球菌感染由表达 A、 B、 C、 X、 W135 或 Y 群荚膜多糖的血清群引发[2].接种脑膜炎球菌多糖疫苗或者结合疫苗是预防脑膜炎球菌性脑膜炎的有效手段.为方便研究和制备A、C、Y、W135群四价多糖疫苗和结合疫苗,本文详细考察了A群脑膜炎球菌发酵过程中的溶氧(DO)、pH值、培养温度、接种浓度、葡萄糖补料等条件的影响,使A群脑膜炎球菌荚膜多糖产量有了较大的提高.
1 材料与方法
1.1 菌种
A群脑膜炎球菌CMCC29201(A4) 株来自中国食品药品检定研究院.
1.2 培养基
10%羊血普通琼脂培养基购自广州市迪景微生物科技有限公司、脑膜炎球菌液体培养基为本公司培养基室配制,其主要成分为酪蛋白酸水解物(AN1.2 mg/mL)、酵母透析液(0.5%)、磷酸二氢钾(0.02%)、磷酸氢二钠(0.1%)、氯化铵(0.125%)、甘氨酸(0.01%)、L-谷氨酸钠(0.1%)、硫酸镁(0.06%)、葡萄糖(0.5%或1.0%)、酵母浸出粉(0.1%).
1.3 仪器
30 L 发酵罐购自成都英德,722G可见分光光度计购自上海精密仪器仪表有限公司,血糖仪购自罗氏,冷冻高速离心机购自Hettich公司,细菌浊度标准品购自中检院.
1.4 菌种传代及培养
菌种开启后,接种于10%羊血普通琼脂培养基上,于35~37 ℃烛缸培养12~20 h后,接种于摇瓶(培养基量2 000 mL,葡萄糖含量0.5%),发酵8~12 h后,转种于30 L 发酵罐(培养基装量15 L,葡萄糖含量1.0%).维持pH 6.8~7.2,通气5~30 L/min,培养6~10 h,待pH回升超过设定值0.05,即加入终浓度2.5%甲醛溶液杀菌.取1.5 mL发酵液于6 000 g、8 ℃离心 10 min去沉淀,1 mL上清液中加入10 μL的10% CTAB,混匀放置10 min后于8 000 g、8 ℃离心5 min弃去上清,沉淀加入1 mol/L氯化钙溶液0.25 mL使其溶解,然后加入0.75 mL注射用水混匀,再用注射用水稀释至磷含量4~20 μg/mL[3]后按中国药典2015版通则3103测定磷含量,A群多糖含量=磷含量×稀释倍数÷0.75.
1.4.1 溶氧(DO)对菌体生长及多糖产量的影响
设定pH为7.0、温度为36 ℃、接种后终浓度为5 亿/mL、培养过程不补加葡萄糖,通过通气搅拌联动控制溶氧在5%、10%和20%.不同溶氧值培养重复三批,通过测定A600值考察溶氧对A群脑膜炎球菌菌体生长情况的影响,通过测定杀菌发酵液的磷含量考察溶氧对A群脑膜炎球菌荚膜多糖产量的影响.
1.4.2 pH 值对菌体生长及多糖产量的影响
设定溶氧为10%、温度为36 ℃、接种后终浓度为5 亿/mL、培养过程不补加葡萄糖,通过自动补加10%氢氧化钠溶液控制pH在6.6、7.0和7.4,不同pH值培养重复三批.通过测定A600值考察pH对A群脑膜炎球菌菌体生长情况的影响,测定杀菌发酵液的磷含量来考察pH对A群脑膜炎球菌荚膜多糖产量的影响.
1.4.3 温度对菌体生长及多糖产量的影响
设定溶氧为10%、pH为7.0、接种后终浓度为5 亿/mL,培养过程不补加葡萄糖,控制培养温度为34±0.5 ℃、36±0.5 ℃和38±0.5 ℃,不同温度培养重复三批,通过测定A600值考察温度对A群脑膜炎球菌菌体生长情况的影响,通过测定杀菌发酵液的磷含量考察温度对A群脑膜炎球菌荚膜多糖产量的影响.
1.4.4 接种终浓度对菌体生长及多糖产量的影响
设定溶氧为10%、pH为7.0、温度为36 ℃,培养过程不补加葡萄糖,控制接种后终浓度为2.5 亿/mL、5 亿/mL、7.5 亿/mL,不同接种终浓度培养重复三批.通过测定A600值考察接种终浓度对A群脑膜炎球菌菌体生长情况的影响,通过测定杀菌发酵液的磷含量考察接种终浓度对A群脑膜炎球菌荚膜多糖产量的影响.
1.4.5 葡萄糖补料对菌体生长及多糖产量的影响
设定溶氧为10%、pH为7.0、温度为36 ℃,接种终浓度为5 亿/mL,分别采用4小时一次性补入终浓度10 mmol/L葡萄糖、4 h开始每半小时分别补入终浓度2 mmol/L葡萄糖,4 h开始采用固定速率持续补糖三种葡萄糖补料方式,不同葡萄糖补料方式培养重复三批.通过测定杀菌发酵液的磷含量考察葡萄糖补料方式对A群脑膜炎球菌荚膜多糖产量的影响.
2 结果

图1 DO对A群脑膜炎球菌(A)细菌生长和(B)荚膜多糖产量的影响
2.1 DO对菌体生长及多糖产量的影响
在DO为5%的条件下,A群脑膜炎球菌生长较慢,发酵时间较长,7小时后最终OD值也仅为6.65,DO为10%和20%时生长较快.6小时OD均超过11,两者生长趋势差异不大,见图1.从多糖产量来看,DO为5%时,多糖产量约为120 mg/L发酵液;DO为10%和20%时,多糖产量分别约为260和280 mg/L 发酵液.表明DO超过10%后,对多糖产量无明显影响.
2.2 pH值对菌体生长及多糖产量的影响
当pH值控制在6.6~7.4范围内时,pH较高则A 群脑膜炎球菌生长较快,见图2.但A 群脑膜炎球菌荚膜多糖产量随着pH升高而下降,多糖产量依次为278 、260和233 mg/L发酵液,综合考虑选择pH7.0较为适宜.
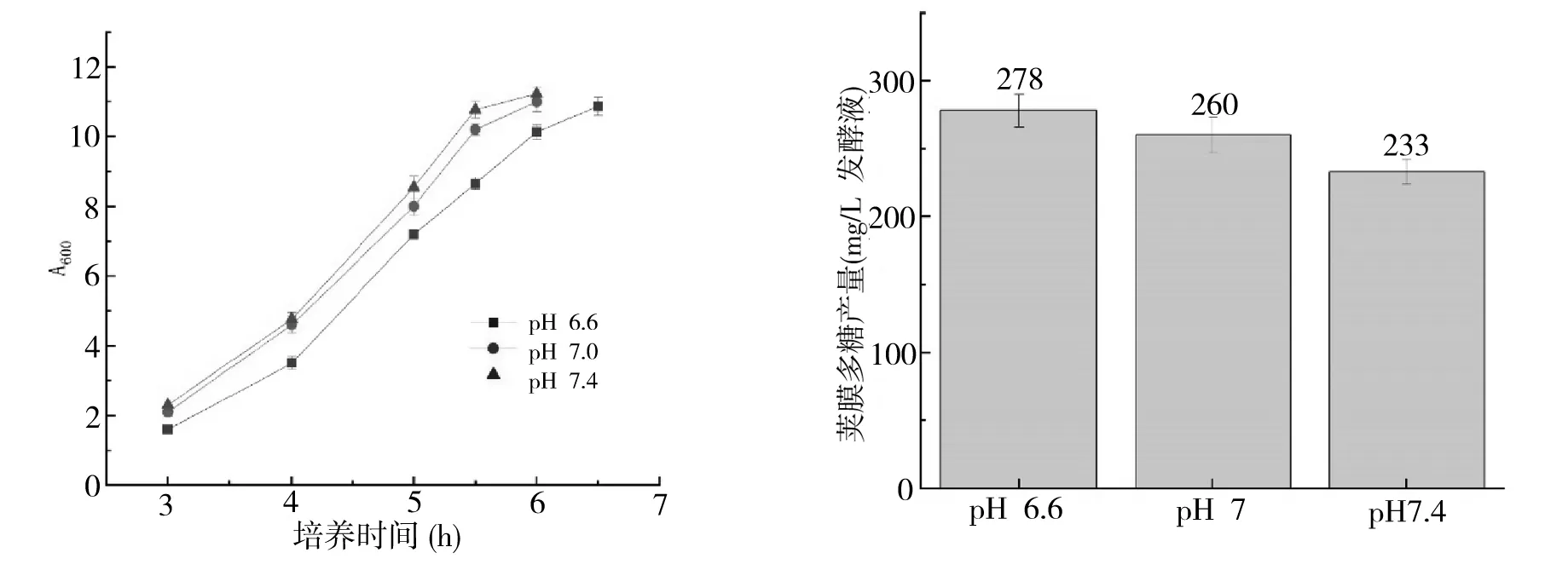
图2 pH对A群脑膜炎球菌(A)细菌生长和(B)荚膜多糖产量的影响
2.3 温度对菌体生长及多糖产量的影响
温度在36 ℃和38 ℃时,A群脑膜炎球菌的生长趋势比较接近,38 ℃时略快,而34 ℃时生长相对较慢一些,但最终OD值接近,见图3.在34 ℃时,A 群脑膜炎球菌多糖产量为276 mg/L 发酵液,而36 ℃和38 ℃时多糖产量分别为260 mg/L和249 mg/L发酵液.表明在36 ℃到38 ℃温度范围内温度越高菌体的生长速度更快,而多糖产量略微下降,综合考虑选择36 ℃为最佳培养温度.
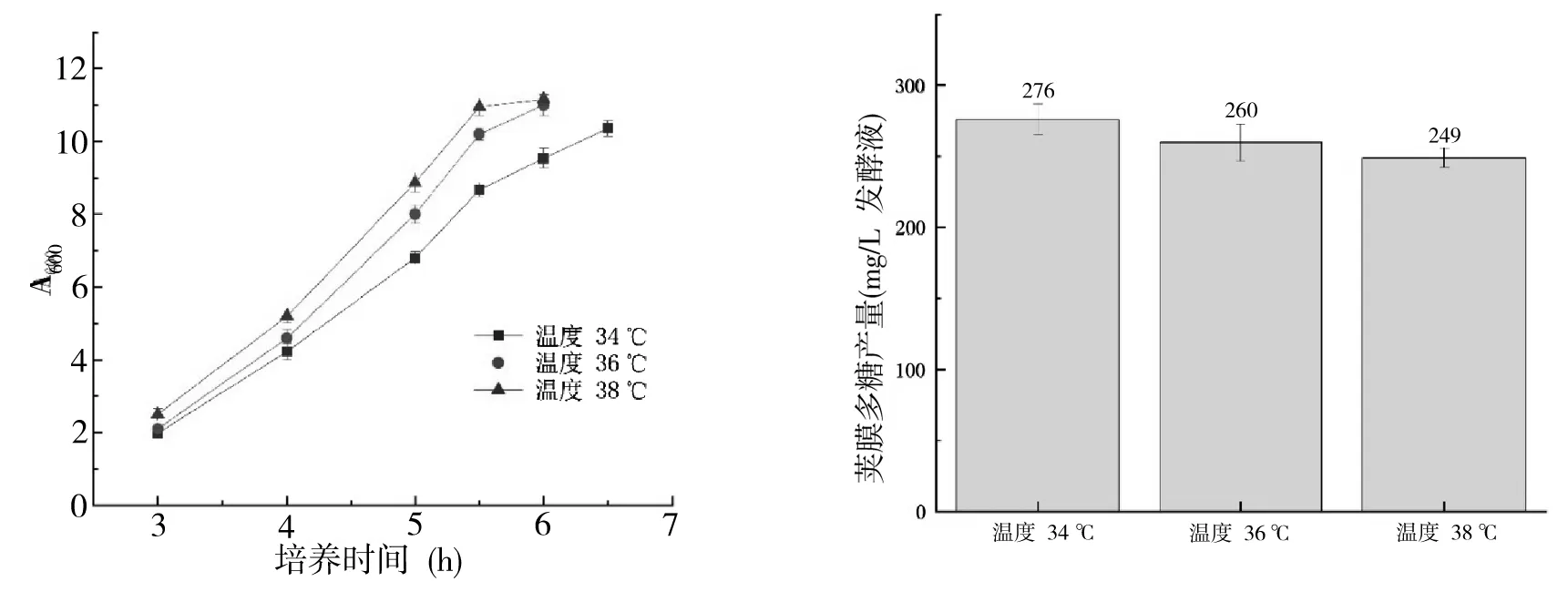
图3 温度对A群脑膜炎球菌(a)细菌生长和(b)荚膜多糖产量的影响
2.4 接种终浓度对菌体生长及多糖产量的影响
在发酵过程中,接种终浓度对A 群脑膜炎球菌生长和多糖的产量均有较大的影响,见图4.接种终浓度为2.5 亿/mL,生长时间为7 h,多糖的产量仅约为133 mg/L发酵液,而接种终浓度为5 亿,生长时间为6 h,多糖产量提高了近1 倍,约为260 mg /L 发酵液.接种终浓度为7.5 亿/mL,生长时间为5 h,但多糖含量降为217 mg/L 发酵液左右,表明接种终浓度越大,生长速度越快,但多糖产量的提高需要选择合适的接种终浓度.
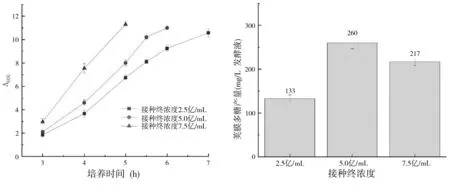
图4 接种终浓度对A群脑膜炎球菌(A)细菌生长和(B)荚膜多糖产量的影响
2.5 葡萄糖补料对菌体生长及多糖产量的影响
A群脑膜炎球菌发酵过程中不补加葡萄糖时,发酵液中葡萄糖下降趋势见图5.葡萄糖的补料对多糖的产量有较大影响,不补加葡萄糖,多糖的产量仅约为260 mg/L发酵液,而补加葡萄糖,多糖产量提高到346 mg/L 发酵液.补料方式的不同,多糖产量也不同.4小时一次性补入终浓度10 mmol/L葡萄糖,多糖的产量提高为283 mg/L发酵液,4 h开始每半小时分别补入终浓度2 mmol/L葡萄糖,则多糖产量提高到327 mg/L发酵液,而4 h开始采用固定速率持续补糖,则多糖产量达到346 mg/L 发酵液,表明采用固定速率持续补糖有利于多糖的合成,见图6.

图5不同培养时间时发酵液中葡萄糖的含量变化 图6葡萄糖补料方式对A群脑膜炎球菌荚膜多糖产量的影响
3 讨论
脑膜炎球菌在发酵罐中采用深层通气培养,选择适当的培养环境和条件,如pH、温度、溶氧、接种量以及培养过程中葡萄糖的补给方式等有利于菌体的生长发育,也有利于荚膜多糖的分泌与形成[4].
5%的溶氧设定明显过低,抑制了A群脑膜炎球菌细菌的生长.由于多糖伴随着菌体生长而合成,菌体生长过慢会影响多糖的合成,因此多糖产量也显著降低.当溶氧条件在10%和20%时,细菌生长和多糖产量非常接近.在实际发酵过程中,我们将溶氧控制在10%.菌体生长和产物合成都是酶反应的结果,pH值和培养温度会影响各种酶反应的速率,改变菌体代谢产物的合成方向,影响细菌的代谢调控机制及发酵液的理化性质,进而影响菌体的生长和产物的生物合成[5].高的pH值和温度有利于A群脑膜炎球菌的生长,而低的pH值和温度更有利于多糖合成.综合考虑,我们选择pH7.0和培养温度36 ℃的中间值.菌种接种终浓度太高,细菌过早进入对数生长期,细菌生长浓度高,但产糖量却并没有提高,菌种接种终浓度太低,则细菌生长缓慢,也不利于多糖产量[6].因此A群脑膜炎球菌接种终浓度以5亿/mL为佳.细菌荚膜多糖合成在对数生长期与细菌浓度正相关,而之后细菌浓度不再增加,而多糖合成则仍在继续[7].A群脑膜炎球菌生长过程中最主要的碳源为葡萄糖,补加葡萄糖可以延长发酵时间,营养物质可以被综合利用,使细菌产生荚膜多糖的时间增加,提高多糖的产量[8].而葡萄糖的补加方式对多糖产量影响也非常明显,采用固定速率补糖,速率既可以维持发酵液液中的葡萄糖含量,又可以避免葡萄糖阻遏效应[9],可以大幅提高多糖的产量.
通过优化发酵工艺参数,A群多糖产量可以达到346 mg/L 发酵液以上.

