牛病毒性腹泻病原的分子生物学与>检测技术研究进展
耿金静,魏锁成
(西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
牛腹泻性疾病是造成30日龄以下的犊牛生长发育不良和死亡的主要原因,给畜牧养殖业带来了重大的经济损失[1-2].研究表明,引起犊牛腹泻的原因很多,主要包括饲养管理、营养、天气变化及生物制剂使用等非传染性致病因素和细菌、真菌、病毒及寄生虫等传染性致病因素.近年来,随着病原诊断技术的发展,证明犊牛的传染性腹泻主要由病毒引起[1-3].本文对引起牛病毒性腹泻的主要病毒和诊断技术领域取得的研究进展进行概述,以期为牛腹泻病的诊断、疫苗研发和有效治疗提供参考.
1 牛病病毒性腹泻的主要致病病毒
1.1 牛轮状病毒(Bovine rotavirus,BRV)
轮状病毒(Rotavirus,RV)由Bishop等于1973年发现,属呼肠孤病毒科轮状病毒属,其大小为60~80 nm,无包膜和多层核衣壳的RNA病毒[4],有3种重要的抗原特异性:组、亚组和血清型[2].RV根据内层衣壳蛋白(VP-6)的组特异性抗原表位可分为A~G 7个组.A组RV根据VP6的亚组特异性抗原表位又可分为2个亚组或血清群.A组RV根据外层衣壳蛋白VP4和VP7可分为不同的血清型.根据VP7可至少分为27个G血清型,根据VP4则可分为35个以上的P血清型.A组轮状病毒是犊牛的主要病原体,B组次之.A组轮状病毒为dsRNA,由11个片段组成,位于病毒粒子的衣壳内.RV基因序列中富含A和T,A+T比值达58%~67%,每个基因片段5′-末端有一个鸟嘌呤核苷酸,其后为5′-末端保守序列,之后紧接阅读框,编码一种蛋白产物.终止密码之后为3′-末端保守序列.5′-末端和3′-末端序列高度保守[2,4].
RV的11个基因分别编码11种蛋白质,其中包括6种结构蛋白(VP1~3、VP4、VP6和VP7)和5种非结构蛋白(NSP1~5).VP4是病毒结合宿主细胞受体的病毒蛋白,直接决定了病毒的毒力,同时也限制了一些RV在组织细胞中的生长.RV的VP6位于病毒三层核衣壳的中层,是维持病毒颗粒稳定的主要结构蛋白.VP6与NSP4相互作用介导VP4和VP7进入病毒颗粒,VP6含有的一个CTL细胞表位可能使VP6在保护性免疫应答中发挥作用.VP7是一种糖基化蛋白,构成病毒三层衣壳的最外光滑层,含量高、抗原性强,是RV的主要保护性抗原.NSP4是最受重视的非结构蛋白,是非常保守的蛋白质.不同株RV的NSP4的同源性为87.3%~96.6%.RV的NSP4具有肠毒素样功能,感染细胞破裂释放病毒时,NSP4被释放并作用于邻近的肠黏膜细胞,使细胞内的Ca2+浓度升高,促使Cl-分泌,从而引起腹泻[4].
BRV是一种广泛存在的病毒,其中A 群轮状病毒是引起犊牛腹泻的主要病原.BRV在犊牛小肠绒毛的上皮细胞质中复制,破坏绒毛中成熟的肠细胞,受损细胞的血管活性成分使肠神经系统活化,进而促进病毒肠毒素(例如NSP4)的分泌,引起1~2周龄犊牛消化不良或吸收不良的腹泻[5].Komoto S等通过研究A群RV的G8P[1]发现,RV在人和动物之间是通过直接传播的方式传播的[6].牛轮状病毒腹泻是一种急性疾病,死亡率高,潜伏期很短,为12~24小时,有时为18~96小时.感染后的犊牛表现为腹泻、脱水、食欲不振、不愿饮水和移动,粪便呈淡黄色,无血,且伴有大量粘液,腹泻通常持续4~8天,BRV主要存在于新生犊牛中,3月龄以上的牛不易感染[2].
1.2 牛冠状病毒(Bovine coronavirus,BCoV)
牛冠状病毒(Bovine coronavirus,BCoV)属于冠状病毒科乙型冠状病毒属2a亚群,是一种有包膜、不分节段的单股正链RNA病毒,由美国Mebus等人首次发现报道,主要参与牛的肠道感染和呼吸道疾病.根据BCoV的病原分离来源不同可分为BRCoV(呼吸道来源)和BECoV(肠道来源).BECoV又可细分为BCoV-CD(犊牛腹泻)和BCoV-WD(成年牛冬痢)[7].
BCoV的基因组包括13个开放读码框(ORFs),两侧有5′-UTR和3′-UTR区域.BCoV基因组由5种结构蛋白和16种非结构蛋白(nsp1~16)组成.基因组RNA内编码的主要结构蛋白有ORF3内的血凝素酯酶蛋白(HE)、ORF4内的纤突蛋白(S)、ORF4内的小膜蛋白(E)、ORF9内的跨膜蛋白(M)、ORF10内的核衣壳蛋白(N).S蛋白是病毒表面的1型病毒融合蛋白,长度为4 038 bp,在诱导中和抗体产生方面起重要作用.S蛋白在氨基酸的768-769处可裂解成两个亚基:S1亚基和S2亚基.S1亚基的下游高变区(HVR)在每个毒株中不同,可使病毒结合在宿主细胞受体上;S2亚基在毒株中是保守的,可使病毒囊膜与宿主细胞膜结合[8-9].N蛋白是BCoV的主要结构蛋白基因,与基因组 RNA 组装成核糖核蛋白复合物,在病毒致病性、转录、翻译、增强免疫力及辅助增强病毒RNA复制方面起重要作用,其基因高度保守,可作为诊断BCoV的候选基因[9].HE蛋白在病毒进入和感染宿主细胞后释放过程起重要作用[6].
BCoV是引起犊牛腹泻的重要病原.BCoV的S蛋白和HE蛋白结合并附着在肠上皮细胞,病毒在肠细胞中复制,损伤肠绒毛上皮细胞.BCoV也可感染隐窝肠细胞,使小肠和结肠隐窝的绒毛萎缩,固有层坏死,可引起1周至3个月龄的新生牛犊出现水样腹泻,成年牛冬痢,呈出血性肠炎,并伴有厌食症、脱水、消瘦等症状.此外,BCoV感染是造成全球乳品行业经济损失的重要原因.BCoV轻度流行,产奶量降幅10%左右,持续时间1~2周,严重流行时,产奶量下降到30%,并持续1个月[9].
1.3 牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)属于黄病毒科瘟病毒属的成员,是一种有囊膜的单股正链RNA病毒.该病毒可分为物种、基因型和生物型.根据病毒RNA序列,可分为11种,其中BVDV1,属于瘟病毒属A,BVDV2,属于瘟病毒属B.在遗传学上BVDV可分为三类:1型(BVDV-1),2型(BVDV-2),HoBi样病毒 (BVDV-3);其基因型主要由5′-UTR区,Npro和E2蛋白编码区的变化决定,BVDV-1中至少有20种基因型是最常见的,而较少见的BVDV-2有4种基因型.根据BVDV在感染细胞培养物中能否引起细胞病变,可分为致细胞病变型(cytopathogenic,CP)和非致细胞病变型(noncytopathogenic,NCP)两种生物型[10-11].
BVDV的基因组由长约12.3 kb的正链RNA分子组成,它的单个开放读码框(ORF)的两侧是非翻译区(UTR).ORF可编码一个大的多聚蛋白,经细胞和病毒蛋白酶切割为四种结构蛋白和八种非结构蛋白.这些成熟蛋白质包括Npro、C、Erns、E1、E2、p7、NS2 、NS3、NS4A、NS4B、NS5A和NS5B.多聚蛋白中的第一种蛋白质Npro是非结构病毒自身蛋白酶,产生其自身的C-末端.核衣壳蛋白C和三种包膜糖蛋白Erns,E1和E2代表BVDV的结构蛋白.E2是瘟病毒中高度可变的免疫显性糖蛋白,是中和抗体的主要靶标.剩余的成熟蛋白质是非结构蛋白.5′-UTR是病毒基因组的高度保守部分,包含涉及病毒多蛋白翻译的内部核糖体进入位点[12].
BVDV是引起牛呼吸系统疾病和包括流产在内的生殖疾病的主要原因之一.该病毒主要通过持续感染导致肠细胞原发性损伤、易感动物共感染和在隐窝肠细胞中复制、病变两种方式引起犊牛腹泻[1].这种病毒的感染会在动物身上引起不同的症状,也会以不同的方式发展疾病.通常,病毒感染可能是无症状或有一些临床症状,比如轻微的发烧、食欲缺乏、嗜睡,但在一些动物中也可以产生口腔溃疡和消化道感染,引起呼吸系统和生殖的影响以及免疫抑制,在一些情况下可能呈现经典或出血性腹泻.该病毒还可通过胎盘传播,引发胚胎死亡、流产、免疫耐受、出生缺陷、新生犊牛羸弱[12].
1.4 牛肠道病毒(Bovine enterovirus,BEnV)
牛肠道病毒(Bovine enterovirus,BEnV)属于小核糖核酸病毒科内的肠道病毒属,是一种无包膜的单股正链RNA病毒.肠道病毒属由12种组成:9种肠道病毒(EV-A、B、C、D、E、F、G、H和J)和3种鼻病毒(RV-A、B和C)[2,13].EV-E和EV-F属于BEnV,其中EV-E包括EV-E1~EV-E4,EV-F种包括EV-F1~EV-F6.BEnV的病毒粒子外观呈球形、正二十面体、无包膜,大小为25~30 nm,病毒的基因组含有单个ORF,5′和3′末端为UTR,全长7.5 kb,是不分节段的单股正链RNA[13-14].BEnV的血清型分类随着科学研究的发展经历了几次变化,最初它们被分为七种,后来减少为四种,然后减少为两种血清型.最近,基于基因序列数据和系统发育分析,BEnV被分为两个血清群:BEV-A和BEV-B.BEV-A包含三种类型(BEV-A1、BEV-A2和BEV-A3),BEV-B包含六种类型(BEV-B1、BEV-B2、BEV-B3、BEV-B4、BEV-B5和BEV-B6)[15].
BEnV基因组的ORF编码单个长多聚蛋白,包括结构蛋白(在P1区中编码的VP1~4)和非结构蛋白(在P2区中编码的2A~C和在P3区编码的3A~D),P2区 、P3区和1A(VP4)的蛋白质序列高度保守.2C蛋白被认为是膜相关的ATP酶,具有保守的核苷酸结合基序,衣壳蛋白1B(VP2),1C(VP3)和1D(VP1)可作为BEnV的基因或血清型分类的依据.有研究表明,大多数肠病毒属病毒由VP1、VP2、VP3蛋白组成的外衣壳形成的“沟槽”作为表面受体,其中VP1编码区的序列可能决定病毒的表型,可用于研究BEnV[13,15].
BEnV的临床症状广泛,包括肠道感染(高发病率、腹泻和中度死亡率),呼吸道疾病(咳嗽、发热和呼吸困难),生殖障碍(流产、死产、新生儿死亡)和不孕,BEnV还可引起牛的隐性感染,并随感染犊牛粪便排出体外,但感染犊牛的病毒分离物无法通过实验再现呼吸道和胃肠道疾病,BEnV在牛中的发病机制和毒力尚不明确[2,16].
1.5 牛凸隆病毒(Bovine torovirus,BToV)
牛凸隆病毒(Bovine torovirus,BToV)最初由G.N.Woode 等人,于1979年是在美国 Lowa 州 Breda市的腹泻犊牛中分离出来的[17].BToV属于套式病毒目冠状病毒科凸隆病毒属,以前被称为布雷达病毒,是一种有囊膜、不分节段的单股正链RNA病毒.病毒粒子形态多样,根据血清学检测,布雷达病毒(Breda virus,BRV)可分为两种血清型,BRV-1和BRV-2[2,18-20].
BToV的基因组全长28.475 kb,包含两个大的重叠开放阅读框(ORFs):ORF1a和ORF1b,以及四种结构蛋白:纤突蛋白(S)、跨膜蛋白(M)、血凝素酯酶蛋白(HE)、核衣壳蛋白(N)[19,20-22].
ORF1a和ORF1b编码的蛋白被认为与核糖体移码有关;HE蛋白和唾液酸-O-乙酰酯酶结构域形成二聚体,这种酯酶区域对于糖苷结合O-乙酰化的唾液酸在催化区域的结合和定位作用非常关键;S蛋白与宿主细胞受体结合,介导病毒内吞[19,22].
BToV通常感染2至5日龄的犊牛,1月龄犊牛的病毒脱落物是BToV的主要来源,4月龄犊牛易感,被认为是犊牛的肠道病原体.有研究表明,BToV在细胞质中复制,经S蛋白介导进入宿主肠细胞,感染空肠,回肠和结肠的远端半部的上皮,显微病变为隐窝和绒毛状肠细胞坏死和绒毛萎缩,感染奶牛会出现水样腹泻,厌食和产奶量减少,有的会出现轻微呼吸道症状[2,22].
1.6 牛诺如病毒(Bovine norovirus,BNoV)
诺如病毒(norovirus,NoVs)属于杯状病毒科,是一种无包膜的RNA病毒.根据VP1基因序列推断的系统发育关系,可将诺如病毒分为6个基因组(GI至GVI).牛诺如病毒(Bovine norovirus,BNoV)是杯状病毒科诺如病毒属成员,是一种无包膜的单股正链 RNA病毒.到目前为止,发现的牛诺如病毒序列聚集在GIII内,该基因组可进一步细分为GIII.1和GIII.2两种基因型[2,23-24].
BNoV是一种小的、无包膜的二十面体病毒,其病毒粒子的直径约27~40 nm,基因组全长约7.5 kb,由三个开放阅读框(ORF)组成.ORF1编码一个大的多聚蛋白.该多聚蛋白可被病毒3C样蛋白酶进一步切割成六个成熟的非结构蛋白.这些非结构蛋白从5′端到3′端的顺序依次为:N端非结构蛋白NS1-2(P48)、NS3核苷酸三磷酸酶(NTPase)/RNA 解旋酶,NS4 蛋白(P22)、NS5蛋白(VPg)、NS6蛋白酶(3CLPro)和NS7 RNA依赖的RNA 聚合酶(RdRp,P)在内的至少六种非结构蛋白[25].ORF2和ORF3分别编码主要衣壳蛋白(VP1)和次要衣壳蛋白(VP2).VP1衣壳蛋白组成两个结构域:壳体(S结构域,N末端部分)和突出结构域(P结构域,C末端部分).P结构域包括两个子结构域:P1和P2,其中P2是一个高变区,具有细胞受体配体和免疫抗原决定簇,使病毒具有外部定位功能[24-27].
BNoV可引起犊牛腹泻,且对各个年龄阶段的犊牛均易感,实验性感染 GIII BNoV株,犊牛空肠中段和远端的病变显著,回肠中的病变轻微,空肠中Peyer’s斑的卵泡相关上皮(FAE)损伤.空肠和回肠中检测到病毒的衣壳抗原,发生肠上皮坏死、绒毛萎缩和腺窝增生现象,出现轻度腹泻,短暂性厌食和木糖吸收不良等临床症状,且基因型1比基因型2严重[26],生殖小牛出现症状.目前,对于BNoV的发病机制知之甚少,从其他物种,特别是人类推断,BNoV可能是经粪口途径,通过受污染的食物或水传播[2,23-24,28].
1.7 牛纽布病毒(Bovine nebovirus,BNebV)
牛纽布病毒(Bovine nebovirus,BNebV)与BNoV相似,都是杯状病毒家族的无包膜成员,是一种无包膜的二十面体病毒[2,28].BNebV属于杯状病毒科纽布病毒属,是一种单股正链RNA病毒.根据BNebV推断的系统发育关系,BNebV包括三种已知的菌株基因型:NB、NA1和DijonA216[29,31].BNebV的基因组全长约为7.4 kb,由两个开放的阅读框(ORFs)组成.ORF1依次编码2C解旋酶/NTP酶、3C蛋白酶、RNA依赖的RNA 聚合酶(RdRp)和主要衣壳蛋白(VP1),ORF2编码次要衣壳蛋白(VP2,功能未知的蛋白)[30-31].
BNebV是牛急性胃肠炎的重要致病因子,但它的附着因子和可能的其他细胞受体仍然未知[25].新生犊牛实验性感染BNebV后2至5天肠道绒毛上皮细胞损伤和绒毛萎缩,肠道吸收不良,可引起肠道病变和腹泻.感染BNebV的生殖犊牛的临床症状包括抑郁,厌食和腹泻.尽管BNebV对畜牧业具有显著的经济影响并且具有人畜共患潜力的病原体,但BNeV生命周期仍然未知[2,27-28,30].
1.8 牛星状病毒(Bovine astrovirus,BoAstV)
星状病毒(astroviruses,AstVs)属于星状病毒科,是一种小的、无包膜的、非节段单股正链RNA病毒.AstVs在分类学上分为两个属:Mamastrovirus(MAstV)和Avastrovirus(AAstV),分别感染哺乳动物和禽类宿主[32-33].牛星状病毒(Bovine astrovirus,BAstV)最初于1978年,从英格兰腹泻犊牛中分离得到的,是星状病毒科MAstVs属的成员[2,32-33].1985年,一项基于血清学的研究将BAstV分为两种血清型:BoAstV-1和BoAstV-2,之后有研究表明BAstV可能有多种血清型[34].
AstVs的基因组长度约6.8~7.9 kb,序列具有高度可变性,由5′-UTR,3个部分重叠的开放阅读框(ORF1a、ORF1b和ORF2),3′-UTR和poly(A)尾6部分组成.ORF1a和ORF1b位于5′-UTR的末端,ORF1a可编码非结构性多蛋白(nsp)1a;ORF1b编码多蛋白1ab,包括RNA依赖性RNA聚合酶(RdRP),病毒蛋白酶(v-Pro)和许多功能未知的蛋白质.ORF2编码的多聚蛋白可被半胱天冬氨酸酶和胰蛋白酶加工形成蛋白衣壳成熟蛋白[32,35-36].
AstVs主要通过粪口传播途径传播,是引起幼儿和老年人急性胃肠炎的主要原因,是胃肠道的病原体,也是脑炎的潜在病因,已在哺乳动物的腹泻粪便样本中发现,也可导致鸟类疾病[34-35,37].BAstV在犊牛中常见,在成年牛中不常见,牛感染BAstV后,会出现腹泻、嗜睡、食欲不振、共济失调、反应迟钝等临床症状[2,33,38].早期研究表明,BAstV攻击犊牛无致病性,BAstV株被认为是非致病性的,但当BAstV-USA菌株与BRV或BToV混合感染犊牛时,犊牛出现严重腹泻和更广泛的BAstV感染[2,37].BAstV-USA菌株实验性感染犊牛后,犊牛回肠的M细胞和Peyer’s斑的吸收型肠上皮细胞发生病理性病变[34].
1.9 牛嵴病毒(Bovine kobuvirus/aichivirus B,BKoV)
牛嵴病毒(Bovine kobuvirus/aichivirus B,BKoV)于 2003 年首次在健康牛的血清和粪便中被发现,属于小 RNA 病毒科嵴病毒属的成员,是一种无包膜的单股正链RNA病毒[21,39].目前国际公认的嵴病毒有两种:爱知病毒(Aichivirus,AiV)和BKoV,猪嵴病毒(porcine kobuvirus,PKoV)属于候选病毒[40].
嵴病毒的基因组长度为8.2~8.4 kb,由一个开放阅读框(ORF)组成,编码一个大的多聚蛋白.基因组顺序为:VPg、5′-UTR、前导蛋白(L)、三种结构蛋白(VP0、VP3和VP1)、七种非结构蛋白(2A~2C和3A~3D)、3′-UTR和poly(A)尾.非结构蛋白的3D基因可编码RNA依赖性RNA聚合酶(RdRp).根据编码蛋白质的功能不同,其基因组可分为三个区域:P1区,P2区和P3区,其中P1区编码病毒的结构衣壳蛋白,P2区和P3区编码非结构蛋白[39].
BKoV先后在健康牛的血清、粪便和腹泻牛的粪便样品中被发现和检测到,可通过粪口途径,以直接传播的方式,从一种动物传播到另一种动物;还可通过食用受污染的食物或水,以间接传播的方式进行传播[41-42].有研究表明,BKoV在肠道混合感染中起到一定作用,可引起7~60日龄犊牛腹泻、发烧、虚弱和脱水,同时在有神经系统疾病的牛血清CSF样本中可初步鉴定出BKoV.然而,它们在临床腹泻和神经系统疾病的发病机制中的作用仍不清楚,BKoV可能是牛肠道和神经系统疾病的潜在病原体[42].
2 诊断技术
病毒的检测和鉴定主要分为病原学检测、血清学检测和分子生物学检测三个方面.病原学检测技术包括:病毒分离鉴定、电镜技术.血清学检测方法包括:血清中和实验(SN)、免疫琼脂扩散实验、免疫过氧化物酶技术、免疫荧光技术、酶联免疫吸附试验(ELISA)、乳胶凝集试验(LAT).分子生物学检测技术包括:聚合酶链式反应(PCR)、反转录-聚合酶链式反应(RT-PCR)、实时荧光定量PCR、聚丙烯酰胺凝胶电泳(PAGE)技术、核酸杂交技术、基因芯片技术[14,43-45].本文以电镜技术、酶联免疫吸附试验(ELISA)、聚合酶链式反应(PCR)及聚丙烯酰胺凝胶电泳(PAGE)技术为基础,展开对牛病毒性腹泻病毒诊断技术研究进展的阐述.
2.1 电镜技术
电镜技术是病毒学研究和病毒诊断的一项基本技术,可通过观察病毒的形态特征来鉴定病毒.Mebus等通过电镜观察并首次成功分离出BRV[46].Zhou等人,用非致细胞病变(NCP)和细胞病变(CP)BVDV株感染MDBK细胞,并使用电子显微镜进行超微结构分析,结合其他实验方法,研究发现BVDV诱导自噬,可损害先天免疫应答,引起的持续感染[47].在病毒研究领域最常用的电镜技术是免疫电镜(IEM)技术,是检测BToV的“金标准”[45].此外,常国权等还分别用固相免疫电镜技术、SPA 蛋白胶体金免疫电镜负染色技术及蛋白A 胶体金免疫电镜(PAG-IEM)技术检测了包括牛腹泻相关病毒在内的一些病毒[44].IEM方法对病毒数量、仪器精密度等要求比较高,检测时间较长,仅适用于实验室少量样品高精度检测.免疫金标记法、PAG-IEM 技术具有简便、快速、灵敏等优点,适用于快速检测腹泻牛粪便、肠内容物等样品中的病毒,但不适用于大量临床样本[19,44].
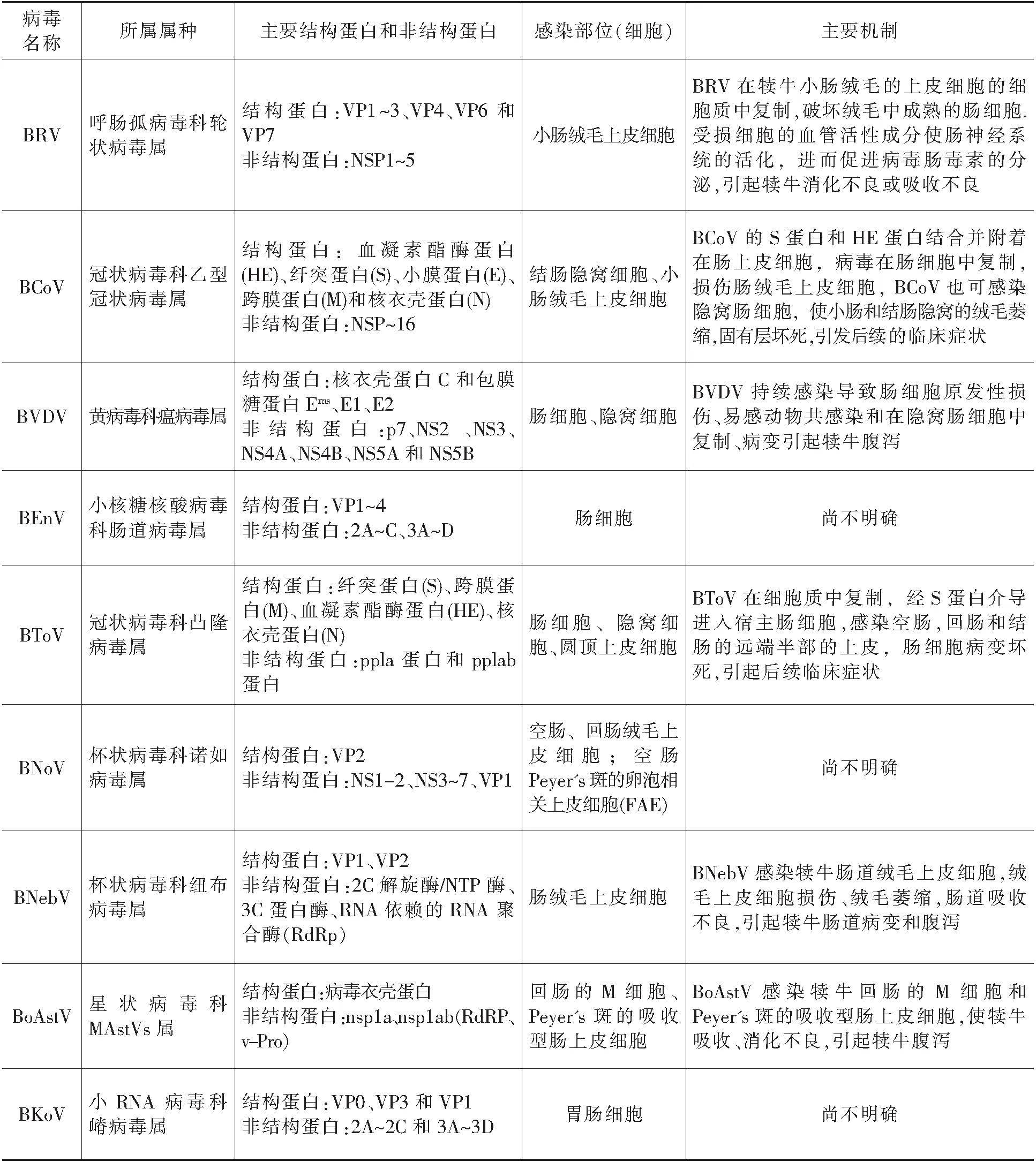
表1 各种牛腹泻病毒的主要分子生物学特性
2.2 酶联免疫吸附试验(ELISA)
酶联免疫吸附试验(ELISA)是一种依赖抗原抗体特异性反应的血清学检测技术.这项试验技术的出现基于一些重要的科学进步(抗原特异性抗体、单克隆抗体、多克隆抗体的产生)而产生的,具有成本低、快速、敏感性强、特异性高等特点,易于在牧场等基层推广使用.目前在牛病毒性腹泻病毒上应用的ELISA法包括直接ELISA法、捕获(间接)ELISA法、阻断ELISA法、双抗体(原)夹心 ELISA 法、Ag-ELISA法、间接Dot-ELISA法、斑点ELISA法[14,43-45,48].Armando等利用抗原捕获ELISA法在犊牛粪便中鉴定出了BToV的抗原和核酸[45].郭金玉等利用野生BEnV-2型的VP1蛋白作为包被抗原,成功建立了检测BEnV抗体的间接ELISA方法.该方法具有操作简单、快速、实用性强等优点[49].肖盛中等利用BVDV的重组 Erns 蛋白包被抗原,建立了BVDV抗体的间接ELISA方法.该法敏感性强、特异性高,可用于BVDV的血清流行病学调查[50].胡俊英等应用制备的BVDV的CC13B毒株的E2蛋白的单克隆抗体与多克隆抗体,建立了基于单抗捕获BVD-MDV抗原的双抗体夹心ELISA方法.检测结果显示,该方法具有特异性强、敏感性高、快速、重复性好等优点[51].随着生物科学技术的发展,包被抗体、捕获抗体的进一步纯化,使得Ag-ELISA,一种新的ELISA法产生,并用于A群BRV、BCoV等一些病毒的检测,这种方法具有快速、高通量、便携、即插即用等优点,但其敏感性相对较差[52].Zhao等利用BVDV的重组E2蛋白作为包被抗原,建立了用于检测抗BVDV抗体的间接Dot-ELISA,与IDEXX HerdChek BVDV抗体ELISA试剂盒同时测试来自田间奶牛的100份血清样品的抗BVDV抗体,结果显示间接Dot-ELISA的特异性强,灵敏度和准确度高[53].
2.3 聚合酶链式反应(Polymerase chain reaction,PCR)
PCR是体外生物体的特殊DNA复制方法,可大量扩增特定片段,是一种基于核酸对病毒病原体进行检测和鉴定的方法.其具有操作简单、反应灵敏、快速等特点,但是样品污染可造成假阳性、高突变率病毒(BRV)易出现假阴性的状况[44].随后反转录PCR,即将RNA反转录为较为稳定的cDNA的一种检测方法产生.A.E.Hoet等在比较ELISA和RT-PCR对BToV检测时发现,RT-PCR对BToV的检出率更高、更敏感[45].Lung等用建立RT-PCR结合微阵列检测方法,检测包括BVDV-1和BVDV-2在内的八种与牛各类疾病的病毒.研究发现,该方法可同时检测大量病原且敏感性强[54].为了更加直观、精准、实时观测PCR,1992年,Higuchi 提出实时观测PCR整个过程的构想,1995年,美国应用生物系统公司研制了首台荧光定量 PCR 仪,使得实时荧光PCR在研究中开始应用.实时荧光PCR是在双链核酸中加入荧光染料或荧光基团,随反应进行PCR产物增多荧光信号增强,结合相应计算方法,实现定量的一种PCR方法[55].实时荧光定量PCR常分为染料法(SYBR GreenⅠ)和探针法(TaqMan 荧光探针)两种.Tsuchiaka等使用TaqMan RT-PCR建立了一种新型同时检测系统Dembo-PCR,Dembo-PCR可同时检测到共19种引起腹泻的病原体.采集腹泻牛粪便,研究发现BCoV主要引起成年牛腹泻,BToV主要引起犊牛腹泻,Dembo-PCR可能是诊断牛腹泻中感染因子的有力工具[56].Barry等建立了一种基于探针的RT-PCR检测方法,可准确地检测出包括BVDV-1和BVDV-2在内的可引起牛流产的病原体[57].张永强等人研究了一种新型的TaqMan-MGB 探针,并在奶牛场中对BVDV感染进行检测.TaqMan-MGB法是在3′端使用无荧光淬灭基团,加小分子物质MGB,使得本底信号强度降低、探针TM值提高10摄氏度的一种实时荧光定量PCR法,能够快速、准确地定量测定出目标基因,且具有特异性强、灵敏度高的特点[58].Qing Fan等人建立了一种GeXP多重PCR检测方法,可以同时检测和鉴别BVDV、BRV、IBRV等六种牛场常见感染性病毒[59].近年来出现了一种新的核酸扩增方法—逆转录环介导等温扩增技术(RT-LAMP).该方法以PCR原理为基础通过识别靶序列特异区域的引物和特殊功能的DNA聚合酶,等温条件下完成扩增,加入荧光染料检测,结果可视,具有高效性、特异性、快速性等特征[44,56].
2.4 聚丙烯酰胺凝胶电泳(PAGE)
聚丙烯酰胺凝胶电泳(PAGE)是一种常用的分离和检测DNA分子的方法,可用于BRV的检测,还能对BRV的种群类型进行鉴别[44],是一种常用的分离和检测DNA分子的方法,也可用于BRV的检测及其种群类型进行鉴别[44].Dhama等对 BRV的RNA利用 PAGE 技术检测,可将 BRV 分为 A~G 7 个种群,并可检测不同病毒基因组的差异和变异[60].Fritzen JTT等利用PAGE技术,结合RT-PCR测定和确认了0~30日龄接种A群BRV奶牛粪便样品中RVA的存在,以此监测RVA疫苗的作用[61].PAGE 技术是犊牛腹泻临床样本中BRV样品检测和鉴别的重要方法,具有操作简单、成本低,可用于大量样本检测等优势.随后发展了SDS-PAGE技术,可根据蛋白质分子的一些性质将其呈梯度分开.Li等成功构建了抗BVDV纳米抗体基因文库,高质量的噬菌体展示纳米抗体库,并在大肠杆菌中表达BVDV-E2蛋白,用SDS-PAGE分析观察其与预期的纳米抗体大小一致.结果表明,使用噬菌体展示技术可分离出一种对BVDV表现出高亲和力和特异性的纳米抗体[62].

表2 不同检测方法的优缺点比较
3 小结
腹泻是牛群体高发的疾病,也是引起犊牛发育不良甚至死亡的重要原因.目前研究发现,病毒是引起牛传染性疾病的主要原因.引起牛病毒性腹泻的病毒主要有BRV、BCoV、BVDV、BEnV.此外,BToV、BNoV、BNebV、BoAstV、BKoV与牛腹泻也存在潜在联系.由于某些病毒如BCoV、BVDV、BEnV引起牛腹泻的临床症状相似,给临床诊断带来了一些困难.因此,出现了很多检测、诊断病毒的方法,如IEM、RT-PCR、ELISA、PAGE,这些检测方法各有其优缺点,在临床和实验室应用时,要结合自身实际选用一种或几种方法进行检测和诊断.随着生物技术和医学研究的发展,相信不久的将来,对某病毒是否直接引起牛腹泻、通过怎样的方式引起牛腹泻会有更深入和明确的研究,同时,检测与诊断方法也会不断改进和完善.

