七鳃鳗Lja-SHP2分子鉴定、重组表达及免疫学研究
李歆,渠成名,韩英伦,2,刘欣,2,李庆伟,2
研究报告
七鳃鳗分子鉴定、重组表达及免疫学研究
李歆1,渠成名1,韩英伦1,2,刘欣1,2,李庆伟1,2
1. 辽宁师范大学生命科学学院,七鳃鳗研究中心,大连 116029 2. 大连工业大学,海洋食品精深加工关键技术省部共建协同创新中心,大连 116034
高等脊椎动物的蛋白酪氨酸磷酸酶SHP2(SH2 domain-containing protein-tyrosine phosphatase-2)由基因编码,催化酪氨酸残基去磷酸化,与其他能催化酪氨酸磷酸化的蛋白酪氨酸激酶共同调节机体内多种信号通路的信号传导。以往研究表明,SHP2在高等脊椎动物T细胞和B细胞的激活与信号转导过程中起着重要作用。为了研究无颌类脊椎动物日本七鳃鳗()中与SHP2同源的分子——在免疫应答反应中的作用,本研究通过PCR 扩增获取其开放阅读框序列,并构建到原核表达载体 pET-32a中,成功在大肠杆菌中实现重组蛋白表达并制备了其兔源多克隆抗体。用混合菌免疫刺激日本七鳃鳗后,通过实时荧光定量PCR和免疫印迹方法检测了在日本七鳃鳗免疫相关组织中mRNA和蛋白水平表达谱。结果显示,混合菌免疫刺激后,mRNA和蛋白表达在外周血白细胞和髓样小体中无显著变化,而在鳃组织中显著性上调(<0.05),说明Lja-SHP2在混合菌刺激后主要参与了鳃组织的免疫应答反应。为了进一步探究Lja-SHP2与淋巴细胞亚群免疫应答反应的相关性,本研究分别使用B细胞有丝分裂原脂多糖(lipopolysaccharide, LPS)和T细胞的有丝分裂原植物凝集素(phytohemagglutinin, PHA)免疫刺激日本七鳃鳗。经LPS免疫刺激后,与对照组相比,白细胞中Lja-SHP2蛋白表达显著上调,鳃组织和髓样小体没有显著性差异表达;但经PHA免疫刺激后,与对照组相比,白细胞、鳃组织和髓样小体3种组织中Lja-SHP2均有上调,尤其在白细胞中上调最为显著,大约是对照组的2.5倍,说明Lja-SHP2参与了日本七鳃鳗由PHA介导的免疫应答反应。由于PHA能刺激日本七鳃鳗鳃组织中VLRA+淋巴细胞的活化,这表明Lja-SHP2可能参与了PHA介导的VLRA+淋巴细胞亚群的免疫应答反应。上述研究结果为进一步探索Lja-SHP2在七鳃鳗免疫应答过程中的功能奠定了基础,也为揭示SHP2分子家族的系统发生及探索高等脊椎动物适应性免疫系统的早期发生及其进化历程提供一定的线索。
日本七鳃鳗;Lja-SHP2;抗体制备;免疫应答
蛋白酪氨酸磷酸酶(protein tyrosine phosphatases, PTPs)具有催化蛋白酪氨酸残基去磷酸化的功能,与能够催化蛋白酪氨酸磷酸化的蛋白酪氨酸激酶(protein tyrosine kinases, PTKs)作用相反。在两者的共同作用下,蛋白酪氨酸残基发生可逆磷酸化,从而可以调节细胞膜酶联受体的信号转导,对生物的生长发育具有重要意义[1,2]。研究表明PTKs主要与致癌和促肿瘤活性相关,而PTPs通常在各种人类肿瘤细胞中发生突变或异常活化,表明其正常功能的维持会对肿瘤的发展起一定的抑制作用[3,4]。蛋白酪氨酸磷酸酶SHP2 (SH2 domain-containing protein- tyrosine phosphatase-2, SHP2)是PTP家族中的一员,也是第一个被证实的原癌基因,广泛表达于各种组织中,参与多种生物学信号的转导,是脊椎动物发育中不可缺少的胞内非受体型PTP。人类SHP2蛋白由基因编码,其氨基酸序列具有一个N端Src同源2 (N-terminal Src homology 2, N-SH2)结构域、一个与N-SH2结构域相邻的C-SH2结构域和一个跨度比较大的PTP结构域。在SHP2分子的C端有两个磷酸化位点(Y542与Y580)和一个富含脯氨酸基序的尾部[5~7]。N-SH2结构域是一种构象开关,在正常生理条件下,SHP2的N-SH2结构域与其自身的PTP结构域相结合,抑制其磷酸酶活性。然而,SHP2如果通过其SH2结构域与酪氨酸磷酸化生长因子受体或接头蛋白结合则会导致这种分子内相互作用被破坏,使其PTP结构域上的催化活性中心暴露,从而激活其磷酸酶活性[8]。通过串联的SH2结构域识别双磷酸化的配体是该开关的组成部分;而C端SH2结构域虽然有助于提高结合能和特异性,但它被激活后并不能直接起作用[9]。
SHP2是一种分布广泛的酪氨酸磷酸酶,作为转导因子参与细胞内由各种生长因子、激素或细胞因子介导的重要的信号通路[9,10]。如SHP2可以促进小GTP结合蛋白(Rat sarcoma, Ras)/丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)途径激活[11],而Ras/MAPK通路对细胞的增殖、分化和凋亡起着重要作用[12]。当细胞受到生长因子的刺激后,SHP2作为正调控因子促进受体酪氨酸激酶激活的下游细胞外调节蛋白激酶(extracellular regulated protein kinases, Erk)/MAPK信号通路[13,14],也可以增强由细胞因子IL-21激活的细胞增殖过程中ERK1/2信号传导活性[15]。体外实验证明,SHP2也能够通过正向调控丝/苏氨酸蛋白激酶Akt (serine/threonine protein kinases Akt, Akt)和Erk1/2信号传导促进少突胶质细胞的成熟[16]。SHP2在导致Erk激活的各种促有丝分裂信号传导途径中起着正调控作用[17],但也有研究发现SHP2在介导细胞外信号调节和下游c-Jun氨基端激酶(c-Jun NH2-terminal kinases, JNK)信号通路的激活方面具有负调控作用。这也是酪氨酸磷酸酶SHP2在介导Erk和JNK、MAPK活化中具有负调控作用的第一个证据[18]。另外,SHP2在高等动物适应性免疫系统的免疫应答反应中也发挥着重要作用。Hoff等[19]发现SHP-2在T细胞受体(T cell receptor, TCR)介导的免疫反应中起重要作用,促进炎症细胞因子的分泌、趋化因子诱导的迁移以及活化细胞的凋亡。
七鳃鳗(Petromyzoniformes)作为目前世界上仅存的最原始无颌类脊椎动物之一,承接了从无脊椎动物到脊椎动物的进化历程,被称为“活化石”[20]。由于其在进化上的特殊地位,七鳃鳗成为研究脊椎动物起源与进化的关键物种[21,22]。研究证明,在七鳃鳗体内不仅存在着先天性免疫,同时存在着适应性免疫,而七鳃鳗的适应性免疫不同于高等脊椎动物。高等脊椎动物的适应性免疫依赖于免疫球蛋白(Ig)及TCR和B细胞受体(BCR)分子介导,七鳃鳗的适应性免疫系统则是由可变淋巴受体(variable lymphocyte receptors, VLR)介导[23~25]。在无颌类脊椎动物中,其适应性免疫系统中最显著的特征是使用富含亮氨酸的重复模块来组装可变淋巴细胞受体基因(和)[26]。为了更加清晰地了解无颌类脊椎动物是否存在作为适应性免疫应答信号传导的重要调控因子SHP2,本研究在日本七鳃鳗()中克隆并鉴定了与高等脊椎动物SHP2同源的分子,研究SHP2在日本七鳃鳗免疫应答过程中的作用,揭示SHP2家族的系统发生,为探索高等脊椎动物适应性免疫系统的早期发生及其进化历程提供一定的线索。
1 材料与方法
1.1 材料
选取捕捞于黑龙江省松花江流域的日本七鳃鳗,后饲养于辽宁师范大学七鳃鳗研究中心。雄性新西兰兔()由本实验室饲养。
RNAiso Plus、DEPC、pMD19-T载体、高保真酶PyrobestTMDNA Polymerase、DNA胶回收试剂盒、质粒提取试剂盒、DNA Marker、DH5α感受态细胞、BL21感受态细胞、蛋白Marker、限制性内切酶d III和R I、胶回收试剂盒、ELISA试剂盒等购于宝生物工程(大连)有限公司;IPTG、组织裂解液、辣根过氧化物酶羊抗兔二抗、辣根过氧化物酶羊抗鼠二抗和兔抗人P38多克隆抗体购于上海生工生物工程技术服务有限公司;ECL化学发光液购于上海碧云天公司;RNA保护剂、组织冻存液和淋巴细胞分离液购自北京索莱宝公司。
1.2 目的基因PCR扩增
通过对本实验室前期得到的日本七鳃鳗外周血转录组测序数据进行分析,发现一条与高等脊椎动物SHP2同源的cDNA序列(命名为),利用Primer Express软件设计扩增引物(表1)。七鳃鳗麻醉处死后,取出髓样小体装于离心管中备用,再从髓样小体中提取总RNA。以提取的RNA为模板,通过反转录试剂盒合成单链cDNA。用制备好的cDNA为模板及表1所列引物进行嵌套PCR反应,扩增的开放阅读框(open reading frame, ORF)。扩增条件:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸2 min,30个循环;最后再72℃延伸10 min,4℃保存。PCR产物经1.5%琼脂糖凝胶电泳检测,并切胶回收连接T载体,由宝生物工程(大连)有限公司进行测序验证。
1.3 同源序列对比和进化树分析
通过NCBI分别搜索并选取脊椎动物各纲代表性物种的SHP1和SHP2分子的氨基酸序列,再通过BioEdit7.0将Lja-SHP2的氨基酸序列和各代表性物种的SHP1和SHP2分子的氨基酸序列进行多重序列比对分析。利用MEGA 6.0软件的邻接法构建系统发育进化树。
1.4 原核表达质粒的构建
利用Primer 5.0软件设计带有R I和d III酶切位点的引物,如表1所示。以克隆有完整的ORF区序列的T载体为模板进行PCR,对扩增产物进行电泳检测,将带有酶切位点的ORF区目的条带进行切胶回收。回收产物进行R I和d III双酶切后进行琼脂糖凝胶电泳检测并切胶回收。然后与双酶切后带有R I和d III粘性末端的pET-32a载体进行连接(16℃,3 h),将连接后产物转化到DH5α感受态细胞中,并在含氨苄青霉素(ampicillin, AMP)的LB (Luria-Bertani)固体培养基上37℃培养过夜,挑取阳性菌落,接种到含6 µL AMP的6 mL LB培养基中,180 r/min震荡培养过夜,集菌,提取质粒由宝生物工程(大连)有限公司进行测序验证。
1.5 重组蛋白提取与纯化
取测序正确的重组质粒2 µL转化到大肠杆菌Rosetta菌株中,涂平板37℃培养过夜,挑取经检测为阳性的菌落,接入含6 µL AMP的6 mL LB培养基中,37℃、180 r/min 震荡培养至对数期。加入0.1 mmol/L异丙基硫代半乳糖苷(isopropyl β-D- thiogalactoside, IPTG)诱导剂,22℃诱导4 h,4℃离心收集菌体之后,用磷酸缓冲盐溶液(phosphate buffer saline, PBS)重悬细胞,进行超声破碎,分别获得上清和沉淀,并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis, SDS-PAGE)电泳检测重组蛋白质的可溶性。随后利用组氨酸标签(Histidine-tag, His-Tag)亲和凝胶层析方法进行大量纯化。

表1 本研究使用的引物序列
1.6 免疫方法
将捕获的日本七鳃鳗放置于10℃恒温水族箱中,适应1周后,分两种方式进行免疫:一种是将健康成体日本七鳃鳗分为对照组和免疫组,每组均为5条,免疫组第一次注射50 μL的混合菌,每毫升混合菌含有白色念珠菌()、大肠杆菌()和金黄葡萄球菌()各1×107个,在注射7 d后进行第二次加强免疫;另一种是将健康的成体日本七鳃鳗分为对照组和脂多糖(lipopolysaccharide, LPS)组、植物凝集素(phytohemagglutinin, PHA)组,每组5条,第一次分别注射200 μg LPS和PHA,在7 d后第二次加强免疫。这两种免疫处理的日本七鳃鳗在第二次加强免疫3 d后再进行第三次加强免疫,免疫后24 h通过麻醉处死,分别断尾取血分离外周血白细胞,解剖分离鳃组织,髓样小体等免疫相关组织置RNA保护剂或者组织冻存液中,超低温冰箱−80℃保存。
1.7 纯化后抗体的制备与效价检测
免疫前取兔血清作为阴性对照。首次免疫时,将400 μg纯化后的重组Lja-SHP2蛋白(命名为rLja-SHP2)与500 μL费氏完全佐剂通过超声破碎仪进行乳化,对新西兰兔进行多点皮下注射。两周后,将200 μg rLja-SHP2与500 μL不完全费氏佐剂进行乳化,同样皮下注射,以后每隔两周用同样剂量的试剂免疫兔子。每隔一周将免疫后的兔子通过耳缘静脉进行采血,通过酶联免疫吸附测定法(enzyme- linked immuno sorbent assay, ELISA)对抗体效价进行检测,达到标准后,耳动脉取血,37℃孵育1 h后8000 r/min离心15 min分离血清。用Protein G柱进行纯化。纯化的抗体经PBS过夜透析,测定抗体质量浓度,加入甘油混匀分装,–80℃低温保存。
1.8 实时荧光定量PCR (qRT-PCR)技术检测
用RNAiso方法提取外周血白细胞、鳃组织和髓样小体的总RNA,并用反转录试剂盒进行反转录合成cDNA。利用表1设计的-qRT-PCR引物进行实时定量PCR反应,以为内参,分析在mRNA水平上混合菌刺激前后各组织的表达情况。所需引物见表1。扩增条件:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸20 s,30个循环;最后再72℃延伸2 min,4℃保存。
1.9 免疫印迹检测
将日本七鳃鳗断尾取血之后,分离外周血白细胞、鳃组织和髓样小体等新鲜组织,在2 mL离心管中加入适量裂解液,用研磨器冰浴匀浆,冰上放置30 min,进行4℃ 12 000 r/min离心,保留上清蛋白,加入上样缓冲液,热水煮沸8 min,制备成蛋白样品。样品先经SDS-PAGE电泳,后转膜75 min至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)膜上,5%的脱脂奶粉封闭3 h,Lja-SHP2抗体按照1:1000的比例4℃孵育过夜,1×TBST缓冲液(Tris缓冲液加0.05% Tween-20)洗膜,每次10 min,共5次。按照1∶5000的比例加二抗(羊抗兔),37℃孵育1 h,1×TBST缓冲液洗膜,每次10 min,共4次。配制增强化学发光法(enhanced chemiluminescence, ECL)发光液,利用FluorChem Q多色荧光、化学发光成像系统检测。
1.10 统计学分析
所得数据采用Graphpad Prism 5.0进行统计学分析,数据用均数±标准差(M±SD)表示,两组数据间比较采用检验分析,<0.05表示差异显著,<0.01表示差异极显著。
2 结果与分析
2.1 Lja-SHP2开放阅读框的氨基酸序列比对及SHP家族系统进化分析
利用表1所设计的引物,通过PCR方法成功克隆并获得基因完整的ORF区序列,全长1761 bp (GenBank登录号:MN340315),编码587个氨基酸,分子式为C5114H8407N1823O2089S557,pI值为4.88,不稳定系数为52.03,在溶液中为不稳定蛋白。通过NCBI分别搜索并获取不同物种的SHP1和SHP2的氨基酸序列,再通过BioEdit软件将Lja-SHP2的氨基酸序列和其他具有代表性物种的氨基酸序列进行多重序列比对分析(附图1)。结果显示,日本七鳃鳗Lja-SHP2序列与人()、鸡()、蟒蛇()、爪蟾()和斑马鱼()的SHP2序列一致性均大于65%,而与它们的SHP1序列一致性最高不到60%。通过SMART数据库进行保守结构域分析,结果显示该蛋白与SHP2家族其他成员一样都有两个SH2结构域、一个PTP结构域和富含脯氨酸基序(SHP1分子没有)。虽然序列相似度不高,但Lja-SHP2具有SHP2家族成员典型的保守结构域,说明无颌类脊椎动物七鳃鳗中存在SHP2分子。
为了解SHP家族分子的系统发育关系,本研究在现有的公共数据库中查找各纲代表物种的SHP1和SHP2分子蛋白序列利用MEGA 4.0软件的最小邻接法构建了系统发育树(图1)。结果显示,无脊椎动物犬弓首蛔虫()的SHP1-like以及寄生蛔虫()的SHP2位于构建系统上树的外侧,而来自脊索动物的44个SHP则位于树的内侧,其中脊椎动物SHP1和SHP2分别聚成两簇(自展值分别为100和88),无颌类盲鳗()的SHP2位于脊椎动物SHP2的基部(自展值为92)。然而,该系统树未能确定头索动物文昌鱼SHP1/2分子、盲鳗SHP1分子以及七鳃鳗Lja-SHP2分子与其他SHP分子的进化关系(自展值均低于52)。但基于脊椎动物早期进化中其基因组曾发生过两轮倍增,以及文昌鱼只存在一个基因、而盲鳗中存在两个基因,本研究推测和基因出现的时间应该发生在无颌类出现之前。
2.2 Lja-SHP2蛋白的重组表达、纯化及兔源多克隆抗体制备
为了获得Lja-SHP2的重组蛋白质rLja-SHP2,将序列正确的Lja-SHP2-pET32a(+)重组子质粒转化导入Rosstta感受态细胞中经IPTG,22℃诱导表达后进行SDS-PAGE检测(图2A)。结果显示,在75 kDa附近有特异的蛋白条带,与预期的目的蛋白大小一致,并且特异性条带大部分在表达菌裂解液离心后的上清液中被检测出来,说明重组表达的目的蛋白主要为可溶蛋白质(图2A)。经His-Tag亲和凝胶层析的纯化后获得纯度较高的重组表达蛋白rLja-SHP2(图2B)。
利用纯化后的rLja-SHP2重组蛋白为抗原,按方法1.7中所描述的免疫方法免疫新西兰兔,经4次加强免疫后成功制备出兔抗Lja-SHP2多克隆抗体。利用亲和层析法纯化抗体后,使用酶联免疫吸附实验检测效价,在按照1∶256 000稀释后抗体效价依然能达到1.077 mg/mL (图3A)。利用免疫印迹方法检测抗体的特异性,结果显示,兔抗Lja-SHP2多克隆抗体能够特异性识别重组表达的rLja-SHP2蛋白(图3B)。
2.3 混合菌刺激后日本七鳃鳗Lja-SHP2mRNA及蛋白在免疫相关组织中的表达谱
为模拟水生环境,用混合菌免疫刺激日本七鳃鳗。解剖分离未免疫及混合菌刺激24 h日本七鳃鳗的白细胞、鳃组织和髓样小体并分别提取总RNA和制备总蛋白样本。采用qRT-PCR方法检测混合菌免疫前后mRNA在以上各组织中表达量的变化(图4A)。结果表明,mRNA在未免疫日本七鳃鳗的各个组织中均有表达;混合菌免疫刺激后,mRNA在白细胞(0.14)和髓样小体(0.37)中无显著变化,而在鳃组织中有显著性上调表达(0.041)。采用免疫印迹方法检测混合菌免疫前后Lja-SHP2蛋白在以上各组织中的差异表达情况(图4,B和C)。结果表明,与未免疫组相比经过混合菌免疫刺激后,髓样小体中Lja-SHP2蛋白无显著变化(0.50),白细胞中Lja-SHP2蛋白存在显著性上调表达(0.03),而鳃组织中Lja-SHP2蛋白存在极显著上调表达(0.0005)。综上所述,在混合菌免疫刺激后,日本七鳃鳗Lja-SHP2无论在mRNA水平还是在蛋白水平均在鳃组织中出现显著上调表达,说明基因可能参与了七鳃鳗鳃组织中由混合菌诱导的的免疫应答反应。
2.4 LPS和PHA刺激后日本七鳃鳗Lja-SHP2蛋白在免疫相关组织中的表达谱
为了进一步探究Lja-SHP2与类T淋巴细胞(VLRA)相关还是与类B淋巴细胞(VLRB)相关,参考文献[27]的方法,本研究使用B细胞有丝分裂原LPS 和T细胞的有丝分裂原PHA免疫刺激日本七鳃鳗。取未免疫组和LPS、PHA刺激24 h日本七鳃鳗白细胞、鳃组织和髓样小体,制备总蛋白样本。结果显示,经LPS免疫刺激后,与对照组相比,Lja-SHP2在白细胞中有显著的上调表达(0.036),而在鳃组织(0.17)和髓样小体(0.45)内均没有显著性差异表达;经PHA免疫刺激后,与对照组相比,Lja-SHP2在白细胞、鳃组织和髓样小体中出现显著性上调表达,分别为对照组表达量的2.5倍(=0.019)、1.4倍(=0.047)和1.5倍(=0.039) (图4,D和E)。从图4C和图4E中可以看到,日本七鳃鳗Lja-SHP2分子在鳃组织中表达量最多,由于鳃组织中存在VLRA分子发育的胸腺样组织,而PHA可以刺激类T (VLRA+)淋巴细胞亚群,以上结果表明Lja-SHP2分子可能参与了PHA介导的七鳃鳗VLRA+淋巴细胞亚群的免疫应答反应。
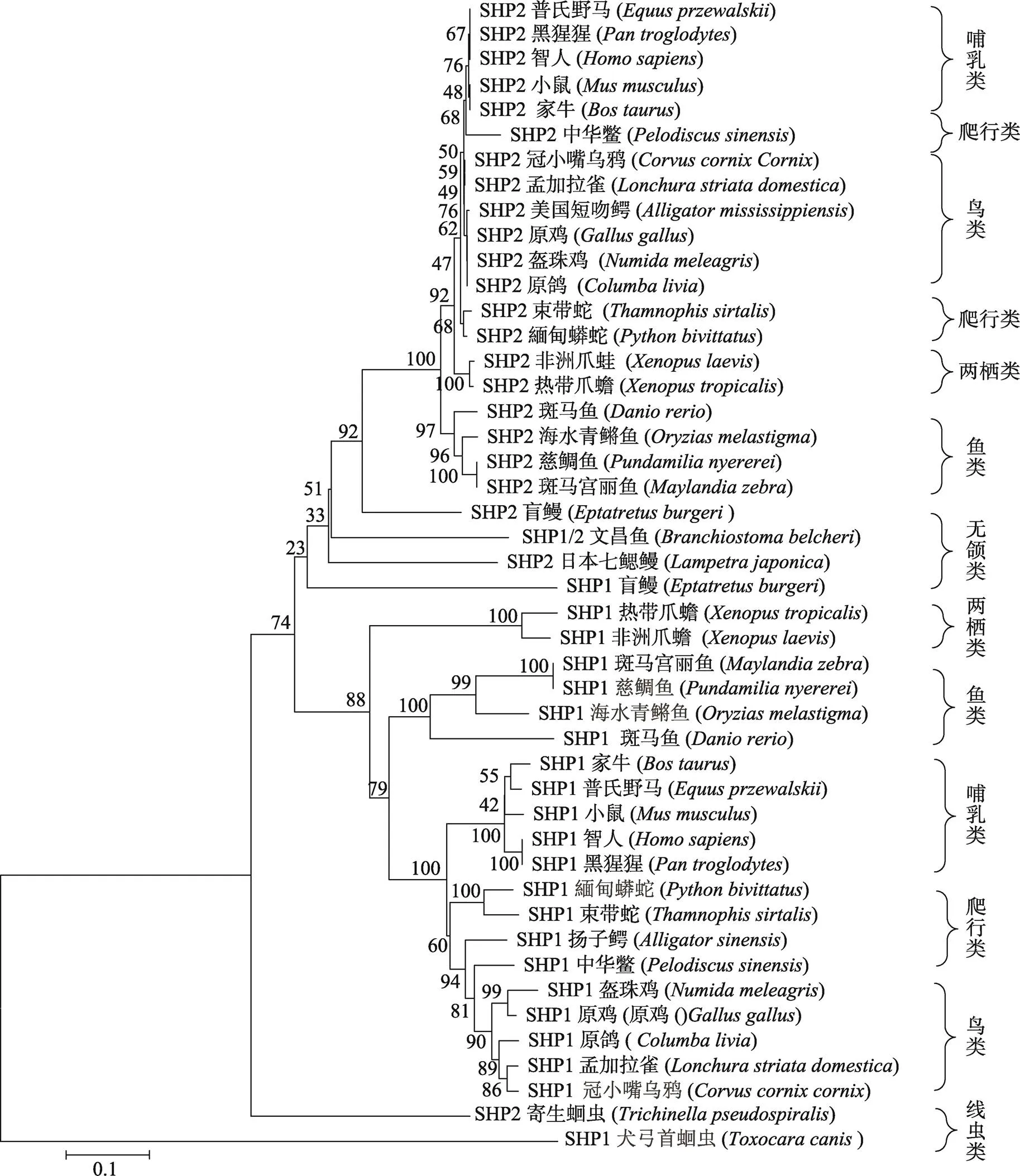
图1 SHP蛋白家族系统进化分析
各物种SHP1分子GenBank登录号如下:,NP 002825.3;,XP 015322644.1;,XP 008527717.1;,NP 035332.1;,JAA21815.1;,XP 021251544.1;,NP 990299.1;,XP 013222199.2;,XP 021400341.1;,XP 010396607.3;,XP 007433583.1;,XP 013909624.1;,XP 006037101.1;,XP 014428393.1;,NP 001116928.1;,NP 001167468.1;,XP 004566999.1;,XP 005720092.1;,XP 024154742.1;,NP 956140.1;,ENSEBUT00000027999.1和,KHN78771.1。各物种SHP2分子GenBank登录号如下:,NP 002822.2;,NP 001091486.1;,XP 008512219.1;,NP 038573.2;,XP 001163468.2;,XP 021251544.1;,NP 001026655.1;,PKK30453.1;,XP 021404788.1;,XP 010396607.3;,XP 007420474.1;,XP 013926432.1;,KY O39678.1;,XP 006124197.1;,NP 001116928.1;,NP 001167468.1;,XP 004550848.1;,XP 005731960.1;,XP 024123570.1;,NP 956254.1;,ENSEBUT00000028304.1;,MN340315;,Bb_155480R和,KRZ35185.1。
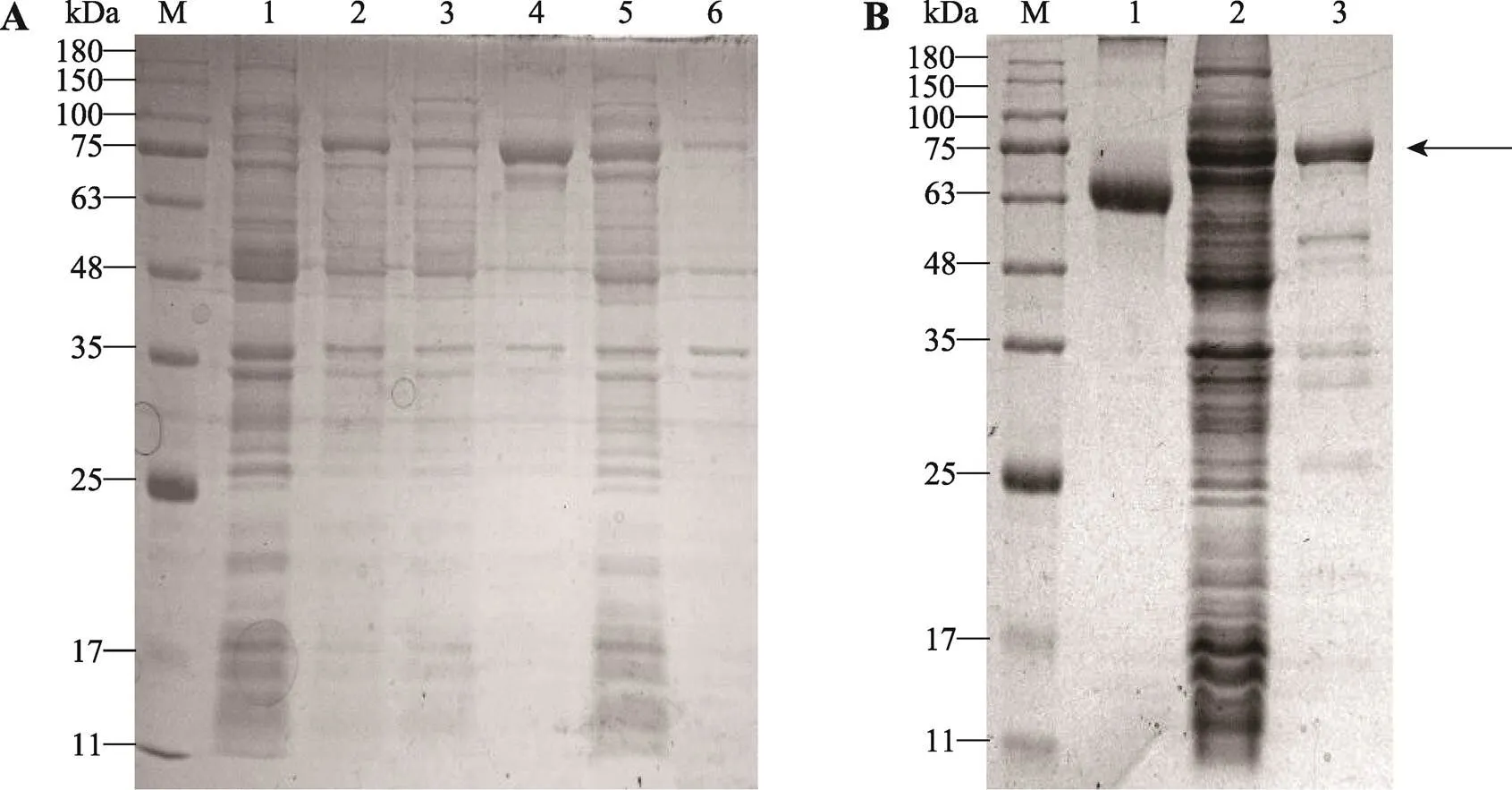
图2 SDS-PAGE检测Lja-SHP2的重组表达、可溶性及纯化结果
A:Lja-SHP2的重组表达及可溶性检测。M:蛋白Marker;1:转化有pET32a(+)质粒的表达菌裂解液(30℃培养4 h未添加IPTG诱导);2:转化有Lja-SHP2-pET32a(+)重组质粒的表达菌裂解液(30℃培养4 h未添加IPTG诱导);3:转化有Lja-SHP2-pET32a(+)重组质粒的表达菌裂解液(30℃培养4 h添加0.1 mmol/L IPTG诱导)离心后上清液;4:转化有Lja-SHP2-pET32a(+)重组质粒的表达菌裂解液(30℃培养4 h添加0.1 mmol/L IPTG诱导)离心后沉淀悬浮液;5:转化有Lja-SHP2-pET32a(+)重组质粒的表达菌裂解液(22℃培养4 h添加0.1 mmol/L IPTG诱导)离心后上清液;6:转化有Lja-SHP2-pET32a(+)重组质粒的表达菌裂解液(22℃培养4 h添加0.1 mmol/L IPTG诱导)离心后沉淀悬浮液。B:重组表达蛋白rLja-SHP2纯化结果。M:蛋白Marker;1:Bsa标准蛋白;2:纯化前表达菌裂解液;3:纯化后rLja-SHP2重组蛋白。箭头指示重组蛋白rLja-SHP2的位置。
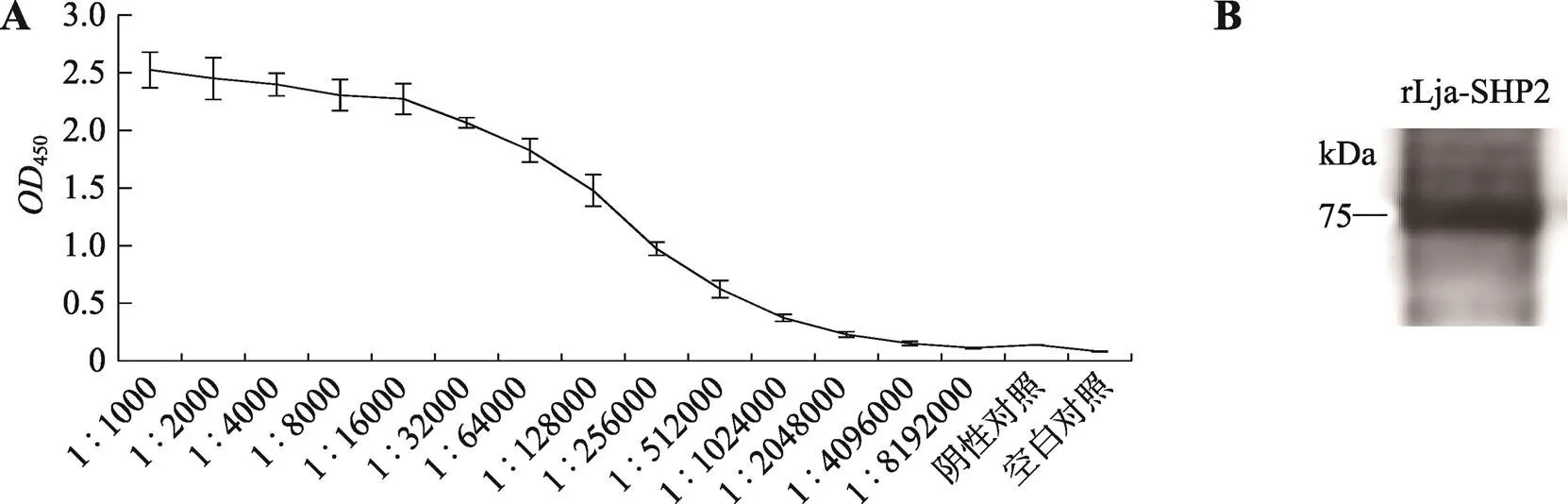
图3 Lja-SHP2多克隆抗体效价与特异性检测
A:Lja-SHP2多克隆抗体的效价检测;B:日本七鳃鳗Lja-SHP2多克隆抗体特异性检测。
3 讨论
SHP2作为蛋白酪氨酸磷酸酶家族成员之一,参与多条信号通路,如RAS/MAPK通路、PI3K/AKT通路及JAK/STAT通路等,不仅为脊椎动物胚胎发育所必需[28],而且也参与多种组织特异性细胞的增殖、分化和凋亡的调控[29]。SHP2也是一种特殊的蛋白酪氨酸磷酸酶,它既可以作为正调节因子调节下游信号转导通路,也可以在特定条件下发挥负调控作用。研究发现,与正常T细胞相比,在缺失的T细胞中Erk激酶活化受到阻碍;表明SHP2通过调节Erk途径促进TCR信号传导,是pre-TCR和TCR促进T细胞成熟和增殖的常用信号传感器[30]。另外,SHP2通过介导T细胞发育和功能参与多种信号传导途径,可以调节细胞因子依赖性粒细胞生成,也是嗜酸性粒细胞分化的关键调节因子[31]。
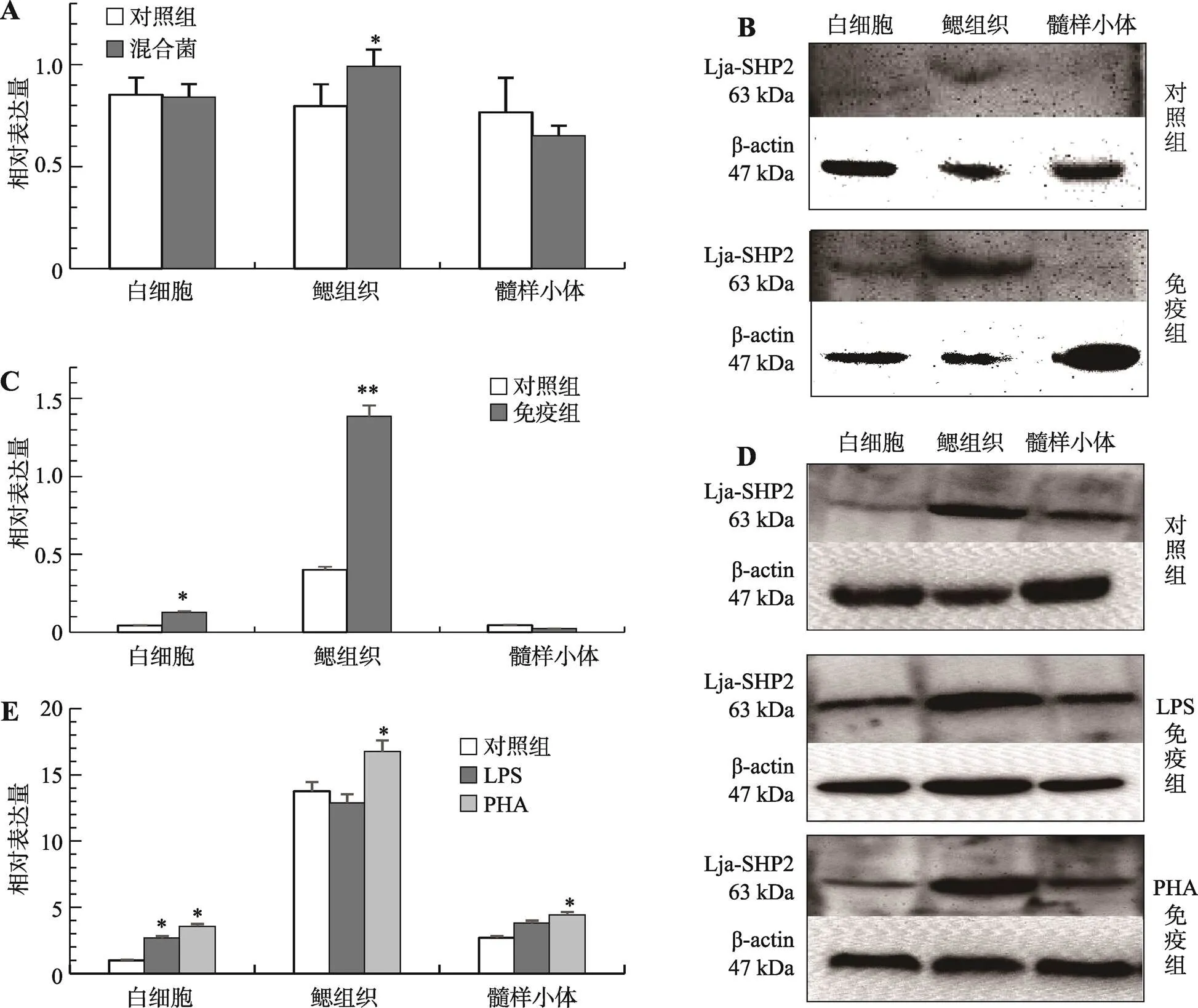
图4 Lja-SHP2 mRNA和蛋白质在各免疫相关组织中的相对表达量
A:混合菌免疫前后各免疫相关组织中mRNA的相对表达水平;B:免疫印迹检测混合菌免疫24 h Lja-SHP2蛋白的表达情况;C:混合菌免疫24 h的Lja-SHP2蛋白的表达情况统计图;D:免疫印迹检测LPS和PHA刺激24 h Lja-SHP2蛋白的表达;E:LPS和PHA刺激24 h各组织中Lja-SHP2蛋白的表达水平统计图。图中所示数据均进行3组平行实验。实验结果以“mean±SD”表示,所有数据均进行检验,*:<0.05,表示有统计学意义;**:<0.01,表示差异显著。
七鳃鳗虽然没有基于B细胞受体(B cell receptor, BCR)、TCR和主要组织相容性复合体(major histocompatibility complex, MHC)的适应性免疫系统,但七鳃鳗以VLRA+、VLRB+和VLRC+3种类淋巴细胞亚群作为其适应性免疫系统的基础以抵御外来病原菌的侵袭[32]。研究证明,类T (VLRA+和VLRC+)淋巴细胞亚群在鳃中的胸腺样组织内发育,类B (VLRB+)淋巴细胞亚群在髓样小体中发育[33]。本研究通过qRT-PCR扩增,结果显示,在混合菌免疫刺激24 h后,的mRNA在白细胞和髓样小体中的相对表达量无显著变化,但在鳃组织中有显著性上调(<0.05)。利用免疫印记方法检测了Lja-SHP2蛋白在混合菌刺激前后各免疫相关组织内的相对表达情况,结果显示在白细胞和鳃组织中表达量上升,在髓样小体中表达量无显著差异;其结果与qRT-PCR测定的转录水平的表达结果基本一致。以上结果从mRNA和蛋白水平证明在混合菌免疫刺激后主要参与了鳃组织的免疫应答反应。对硬骨鱼的研究表明,由于分布在鱼类鳃中的淋巴细胞以 T 细胞为主,PHA比LPS对鳃组织T淋巴细胞的激活作用更加显著[27]。另外,有研究发现七鳃鳗经PHA刺激之后,其鳃组织中的VLRA表达显著上调[33]。本研究中,日本七鳃鳗经PHA刺激之后,Lja-SHP2在白细胞、鳃组织和髓样小体中都有显著性的上调表达,其中在白细胞中上调表达最为显著(<0.01)。由于外周血中的白细胞有可能是由鳃中胸腺样组织发育的VLRA+淋巴细胞增殖补充来的,而成熟的VLRA+淋巴细胞不具备增殖能力,所以外周血中上调表达Lja-SHP2的白细胞可能是由鳃组织中被PHA激活的VLRA+淋巴细胞增殖后补充的结果。所以,本研究推测Lja-SHP2可能与VLRA+淋巴细胞亚群免疫应答反应相关,但具体调节机制仍需进一步研究。然而,经LPS免疫刺激后,Lja-SHP2只在白细胞中的表达量存在显著性的上调表达,在鳃组织和髓样小体中没有显著性的差异表达,说明Lja-SHP2和髓样小体中的VLRB+淋巴细胞亚群的活化关系不大。
由于SHP2是一种分布广泛的酪氨酸磷酸酶,作为细胞内信号传感器,其调控取决于与其结合的受体以及与下游信号通路的相互作用,后续仍需进行深入的研究来揭示Lja-SHP2在七鳃鳗免疫应答中所起的具体作用机制。
附录:
附图1详见文章电子版www.chinagene.cn。
[1] Gurzov EN, Stanley WJ, Brodnicki TC, Thomas HE. Protein tyrosine phosphatases: molecular switches in metabolism and diabetes., 2015, 26(1): 30–39.
[2] Rai PR, Madan DP, Somani RR. Protein tyrosine phosphatase SHP-2 as drug target., 2016, 13(5): 410–420.
[3] Li X, Tran KM, Aziz KE, Sorokin AV, Chen J, Wang W. Defining the protein-protein interaction network of the human protein tyrosine phosphatase family., 2016, 15(9): 3030–3044.
[4] Elson A. Stepping out of the shadows: Oncogenic and tumor-promoting protein tyrosine phosphatases., 2018, 96: 135–147.
[5] Bonetti M, Rodriguez-Martinez V, Paardekooper Overman J, Overvoorde J, van Eekelen M, Jopling C, Hertog Jd. Distinct and overlapping functions ofgenes in zebrafish development., 2014, 9(4): e94884.
[6] Chen C, Cao MM, Zhu SY, Wang CC, Liang F, Yan LL, Luo DQ. Discovery of a novel inhibitor of the protein tyrosine phosphatase SHP2., 2015, 5: 17626.
[7] Chan RJ, Feng GS.is the first identified proto- oncogene that encodes a tyrosine phosphatase., 2007, 109(3): 862–867.
[8] Hellmuth K, Grosskopf S, Lum CT, Würtele M,Röder N, von Kries JP, Rosario M, Rademann J, Birchmeier W. Specific inhibitors of the protein tyrosine phosphatase SHP2 identified by high-throughput docking., 2008, 105(20): 7275–7280.
[9] Hof P, Pluskey S, Dhe-Paganon S, Eck MJ, Shoelson SE. Crystal structure of the tyrosine phosphatase SHP-2., 1998, 92(4): 441–450.
[10] Griger J, Schneider R, Lahmann I, Schöwel V, Keller C, Spuler S, Nazare M, Birchmeier C. Loss of(SHP2) drives satellite cells into quiescence., 2017, 6: e21552.
[11] Matozaki T, Murata Y, Saito Y, Okazawa H, Ohnishi H. Protein tyrosine phosphatase SHP-2: a proto-oncogene product that promotes Ras activation., 2009, 100(10): 1786–1793.
[12] Dance M, Montagner A, Salles J, Yart A, Raynal P. The molecular functions of SHP2 in the Ras/Mitogen-activated protein kinase (ERK1/2) pathway., 2008, 20(3): 453–459.
[13] Shi ZQ, Yu DH, Park M, Marshall M, Feng GS. Molecular mechanism for the SHP-2 tyrosine phosphatase function in promoting growth factor stimulation of Erk activity., 2000, 20(5): 1526–1536.
[14] Miura K, Wakayama Y, Tanino M, Orba Y, Sawa H, Hatakeyama M, Tanaka S, Sabe H, Mochizuki N. Involvement of EphA2-mediated tyrosine phosphorylation of SHP2 in SHP2-regulated activation of extracellular signal-regulated kinase., 2013, 32(45): 5292– 5301.
[15] Fuchikawa T, Nakamura F, Fukuda N,Takei K, Goshima Y. Protein tyrosine phosphatase SHP2 is involved in semaphorin 4D-induced axon repulsion., 2009, 385(1): 6–10.
[16] Liu XJ, Li YY, Zhang Y,Lu Y, Guo W, Liu P, Zhou JZ, Xiang ZH, He C. SHP-2 Promotes the maturation of oligodendrocyte precursor cells through Akt and ERK1/2 signaling., 2011, 6(6): e21058.
[17] Chen L, Sung SS, Yip ML, Lawrence HR, Ren Y, Guida WC, Sebti SM, Lawrence NJ, Wu J. Discovery of a novel SHP2 protein tyrosine phosphatase inhibitor., 2006, 70(2): 562–570.
[18] Shi ZQ, Lu W, Feng GS. The SHP-2 tyrosine phosphatase has opposite effects in mediating the activation of extracellular signal-regulated and c-Jun NH2-terminal mitogen-activated protein kinases., 1998, 273(9): 4904–4908.
[19] Hoff H, Brunner-Weinzierl MC. The tyrosine phosphatase SHP-2 regulates differentiation and apoptosis of individual primary T lymphocytes., 2007, 37(4): 1072–1086.
[20] Janvier P. Palaeontology: modern look for ancient lamprey., 2006, 443(7114): 921–924.
[21] Elphick MR. The evolution and comparative neurobiology of endocannabinoid signalling.. 2012, 367(1607): 3201–3215.
[22] Collin SP. Evolution and ecology of retinal photoreception in early vertebrates.. 2010, 75(3): 174– 185.
[23] Liang J, Liu X, Wu FF, Li QW. Progress of adaptive immunity system of agnathan vertebrate., 2009, 31(10): 969–976.梁佼, 刘欣, 吴芬芳, 李庆伟. 无颌类脊椎动物适应性免疫系统的研究进展. 遗传, 2009, 31(10): 969–976.
[24] Pancer Z, Amemiya CT, Ehrhardt GR, Ceitlin J, Gartland GL, Cooper MD. Somatic diversification of variable lymphocyte receptors in the agnathan sea lamprey., 2004, 430(6996): 174–180.
[25] Liu CJ, Huang HF, Ma F, Liu X, Li QW. Evolution of adaptive immune system in guinea-free vertebrates., 2008, 30(1): 13–19.刘岑杰, 黄惠芳, 马飞, 刘欣, 李庆伟. 无颌类脊椎动物适应性免疫系统的进化. 遗传, 2008, 30(1): 13–19.
[26] Alder MN, Rogozin IB, Iyer LM, Glazko GV, Cooper MD, Pancer Z. Diversity and function of adaptive immune receptors in a jawless vertebrate., 2005, 310(5756): 1970–1973.
[27] Lin SH, Ellis AE, Davidson GA, Secombes CJ. Migratory, respiratory burst and mitogenic responses of leucocytes isolated from the gills of rainbow trout ()., 1999, 9(3): 211–226.
[28] Abbasi M, Gupta V, Chitranshi N, You YY, Dheer Y, Mirzaei M, Graham SL. Regulation of brain-derived neurotrophic factor and growth factor signaling pathways by tyrosine phosphatase Shp2 in the retina: A brief review., 2018, 12: 85.
[29] Qu CK, Yu WM, Azzarelli B,Cooper S, Broxmeyer HE, Feng GS. Biased suppression of hematopoiesis and multiple developmental defects in chimeric mice containing SHP-2 mutant cells., 1998, 18(10): 6075–6082.
[30] Nguyen TV, Ke Y, Zhang EE, Feng GS. Conditional deletion of SHP2 tyrosine phosphatase in thymocytes suppresses both pre-TCR and TCR signals., 2006, 177(9): 5990–5996.
[31] Xia LX, Hua W, Jin Y, Tian BP, Qiu ZW, Zhang C, Che LQ, Zhou HB, Wu YF, Huang HQ, Lan F, Ke YH, Lee JJ, Li W, Ying SM, Chen ZH, Shen HH. Eosinophil differentiation in the bone marrow is promoted by protein tyrosine phosphatase SHP2., 2019, 26(9): 1859–1860.
[32] Liu X, Song XY, Zhang XP, Han YL, Zhu T, Xiao R, Li QW. Genetic basis of immune response of lymphocyte- like cells in the mucosal immune system of., 2015, 37(11): 1149–1159.刘欣, 宋雪萤, 张晓萍, 韩英伦, 朱婷, 肖蓉, 李庆伟. 七鳃鳗鳃黏膜免疫系统类淋巴细胞免疫应答遗传基础. 遗传, 2015, 37(11): 1149–1159.
[33] Guo P, Hirano M, Herrin BR, Li J, Yu C, Sadlonova A, Cooper MD. Dual nature of the adaptive immune system in lampreys.,2009, 459(7248): 796–801.
Identification, recombinant expression and immunological study ofin
Xin Li1, Chengming Qu1, Yinglun Han1,2, Xin Liu1,2, Qingwei Li1,2
Theprotein tyrosine phosphatase SHP2 of higher vertebrates, encoded bygene, catalyzes the dephosphorylation of tyrosine phosphorylation site, and plays regulatory roles in various signaling pathways by cooperating with other protein tyrosine kinase. Previous studies have shown that SHP2 plays an important role in the activation and signal transduction of T and B cells in higher vertebrates. To study the role of a SHP2 homologous molecule of lampreys () in immune response, we cloned and expressed the open reading frame sequence ofgene in prokaryotic expression vector pET-32a. The recombinant protein was successfully expressed inand the rabbit-derived polyclonal antibody was prepared.were immunized with mixed bacteria, and the mRNA and protein ofin immune-related cells and tissues were detected by real-time quantitative PCR and Western blotting after immunization. ThemRNA and protein were not significantly affected in leukocytes and supraneural myeloid bodies, but up-regulated significantly in gill tissues (<0.05) after challenged by mixed bacteria, which indicated that Lja-SHP2 mainly participates in the immune response of gill tissues after mixed bacteria stimulation.To further investigate whetherlevel was affected in three lymphocyte subsets, the B-cell mitogen lipopolysaccharide (LPS) and T-cell mitogen phytohaemagglutinin (PHA) were employed to boost the immune response in. LPS immune stimulation increased Lja-SHP2 in leucocytes significantly compared with the control group, and but had a marginal effect on Lja-SHP2 expression in gills and supraneural myeloid bodies. PHA immune stimulation could up-regulate Lja-SHP2 level in leukocytes, gill tissues and supraneural myeloid bodies. The change of Lja-SHP2 was especially dramatical in leukocytes, which was about 2.5 times higher than that in the control group, suggesting that Lja-SHP2 is involved in the lamprey immune response mediated by PHA. Consistent with the previous finding that PHA could induce the activation of VLRA+lymphocytes, our results showed that Lja-SHP2 might be included in the immune response of VLRA+lymphocytes mediated by PHA in gills. This research will benefit exploring the functions of Lja-SHP2 in the immune response of lamprey and will provide clues for understanding the phylogenesis of SHP2 molecular family, and its roles in the early occurrence and evolution of adaptive immune system in higher vertebrates.
; Lja-SHP2; antibody preparation; immune response
2019-09-02;
2019-11-15
国家自然科学基金项目(编号:31801973)和辽宁省教育厅科研基金重点项目(编号:LZ201783601)资助[Supported by the National Natural Science Foundation of China (No. 31801973) and the Liaoning Provincial Department of Education Research Fund Key Project (No. LZ201783601)]
李歆,硕士,专业方向:细胞生物学。E-mail: 18342267920@163.com
刘欣,博士,教授,硕士生导师;研究方向:细胞生物学。E-mail: liuxin@lnnu.edu.cn
李庆伟,博士,教授,博士生导师;研究方向:细胞生物学。E-mail: liqw@263.net
10.16288/j.yczz.19-260
2020/1/9 10:35:51
URI: http://kns.cnki.net/kcms/detail/11.1913.r.20200108.1642.003.html
(责任编委: 胡炜)

