虎奶菇菌丝体细胞壁成分分析及多糖结构表征
葛梦蝶,代安然,杨崇婧,刘京京,CHEUNG Chi Keung Peter ,陈磊*
1(江南大学 生物工程学院,糖化学与生物技术重点实验室,江苏 无锡,214122)2(香港中文大学 生命科学学院,中国 香港,999077)
虎奶菇(Pleurotustuber-regium, PTR)是食药两用担子菌,富含蛋白、多糖等营养成分及多种活性物质,常被用来治疗头痛、胃痛、发烧以及哮喘、天花和高血压[1-2]等多种疾病。研究表明,从PTR菌核和菌丝体中提取的非淀粉多糖和多糖-蛋白复合物除了具有多种营养价值外,还具有免疫调节和癌细胞杀伤作用[3-4]。这些活性成分主要存在于PTR的细胞壁中,在前期研究中,通过对PTR 菌核细胞壁可溶性多糖的分离和鉴定,初步阐明了菌核细胞壁的骨架结构[5],即超支化β-葡聚糖,这类多糖因特殊的超支化结构和准球状空间形态而具有良好的可溶性、高分散性及大量可用于改性的末端基团,因而在高分子材料、生物医学以及缓释材料等领域具有巨大的应用潜力[6]。
虎奶菇的生长周期主要包括菌丝体、菌核和子实体3个阶段,菌核作为PTR的特殊生长阶段,生长条件较为苛刻,获取不易,因此这类超支化多糖的研究和应用也受到了极大限制。作为虎奶菇生长初始阶段的菌丝体,更易于通过发酵等手段获取,但其细胞壁(Pleurotustuber-regiummycelium cell wall, PTR-MCW)的结构信息尚不清楚,价值还亟待开发。因此,有必要对PTR-MCW的组成和结构进行研究,为进一步开发虎奶菇高附加值产品提供理论依据。本文通过不同提取方式对PTR-MCW成分进行分离及成分分析,并对主要可溶性细胞壁多糖进行结构表征,为进一步开发虎奶菇资源打下坚实的基础。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
PTR,购于美国Fungi Perfecti有限公司;马铃薯-葡萄糖琼脂培养基(PDA),北京陆桥技术股份有限公司。
1.1.2 实验试剂
酵母浸粉,安琪酵母股份有限公司;BCA法蛋白浓度测定试剂盒(增强版),碧云天生物技术有限公司;单糖标品(98%阿拉伯糖、99%岩藻糖、99%半乳糖、98%葡萄糖胺、色谱纯葡萄糖、99%甘露糖、98%鼠李糖、98%木糖)、99.7%二甲基亚砜、99%肌醇、99.9%二氯甲烷,百灵威科技有限公司;99.5%碘甲烷,梯希爱化成工业发展有限公司;色谱纯甲醇,瑞典欧森巴克化学公司;苯甲基磺酰氟(phenymethylsulfonyl fluuoried,PMSF),上海麦克林生化科技有限公司;其他试剂,国药集团化学试剂有限公司。
1.1.3 仪器与设备
HH·B11·360型电热恒温培养箱,连云港医疗器械设备厂;7GI-16M型台式离心机,湖南湘仪实验仪器开发有限公司;HYG-A型全温摇床柜,太仓市实验设备厂;FA-1004型电子天平,上海舜宇恒平科学仪器有限公司;SW-CJ-IF型超净工作台,苏州净化设备有限公司;RE 52-3型旋转蒸发器,上海沪西分析仪器厂;Enspire 2300型多标记检测系统(酶标仪),美国珀金埃尔默有限公司;CRX3HD型冷冻干燥机,日本日立公司;NDK200-2型氮吹仪,杭州米欧仪器有限公司;EASY-LOAD型Pall minimate切向流超滤系统,颇尔公司;TSQ 8000型三重四级杆气质联用,美国赛默飞世尔科技有限公司;DAWN HELEOS Ⅱ型多角度激光光散射凝胶色谱系统(SEC-MALLS),美国怀雅特技术公司;NEXUS型傅里叶变换红外光谱仪(FT-IR),美国尼高力仪器公司;SU8220型冷场发射扫描电子显微镜(SEM)、H-7650型透射电子显微镜(TEM),日本日立公司。
色谱柱填料及装柱参数为Sephacryl S-1000(90 cm×2.6 cm i.d.),Sephacryl S-400(90 cm×2.6 cm i.d.),Sephacryl S-200(70 cm×2.6 cm i.d.),Sephadex G10(70 cm×2.6 cm i.d.),英国安发玛西亚生物技术公司,填料为GE-HealthCare。
1.2 实验方法
1.2.1 PTR菌丝体的发酵与细胞壁制备
虎奶菇接种于PDA平板上,30 ℃培养7 d,4 ℃保藏,定期进行转接。
从长满虎奶菇菌丝的PDA平板上切下10片约1 cm2的小块,加入到装有200 mL种子培养基的500 mL三角瓶中,于30 ℃、180 r/min条件下摇床培养3 d,制备种子液。将发酵好的种子液以5%的接种量转接到装有190 mL发酵液的500 mL的三角瓶中,30 ℃、180 r/min条件下摇瓶培养6 d。种子培养基与发酵培养基配方均为(g/L):葡萄糖30、酵母浸粉4、KH2PO41、MgSO4·7H2O 0.6,pH自然。
发酵完成后,取发酵液用尼龙纱布过滤分离,并用去离子水洗涤菌丝体,至洗液为无色,抽滤去除多余的水分后,-80 ℃冷冻过夜并真空冷冻干燥。取适量冻干后的菌丝体,粉碎过35目筛(0.5 mm)。粉碎后的PTR菌丝体分别先后用A液(1 mmol/L PMSF)、B液(50 g/L NaCl,1 mmol/L PMSF)、C液(20 g/L NaCl,1 mmol/L PMSF)、D液(10 g/L NaCl,1 mmol/L PMSF)洗涤,接着再用A液洗涤以除去胞内杂质,结束后再用超纯水洗涤沉淀数次以除去残留物,离心收集沉淀,冷冻干燥即得PTR-MCW。
1.2.2 PTR菌丝体细胞壁组分的分离与纯化
PTR-MCW组分的分离纯化方案如图1所示,冻干的PTR-MCW粉末分别用热水(100 ℃)、常温碱溶液(0.5、1 mol/L NaOH)、热碱溶液(1 mol/L NaOH,80 ℃)浸提,每种提取液均离心(4 ℃,4 000×g,10 min)取上清,分别命名为MHW、MCA-1、MCA-2和MHA,最后剩下的沉淀为碱不溶物MAI。提取步骤均重复5次,合并相应提取液。
将热水提取液混合浓缩至1/5体积后按体积比1∶4搅拌加入无水乙醇静置过夜,离心收集沉淀得到MHW;3种碱提组分(MCA-1、MCA-2和MHA)经醋酸溶液中和后,分别按1∶3的体积比加入无水乙醇静置过夜,离心收集沉淀,再分别用75%(体积分数)酒精洗涤沉淀8次;MAI用双蒸水洗涤至中性以除去化学残留。
用截留量为10 kDa的超滤膜对碱溶性组分作初步纯化,得到分子质量分别大于10 kDa(MCA-1I、MCA-2I和MHA-I)和小于10 kDa(MCA-1Ⅱ、MCA-2Ⅱ、MHA-Ⅱ)的两类组分。对于MCA-1I、MCA-2I和MHA-I,采用在Sephacryl S-1000色谱柱与Sephacryl S-400色谱柱联用分离,以0.2 mol/L NaCl溶液为洗脱液在1.5 mL/min的速度洗脱纯化,收集合并相应组分。MCA-1Ⅱ、MCA-2Ⅱ和MHA-Ⅱ通过Sephacryl S-200色谱柱用同样的洗脱液和流速进行洗脱,进一步纯化为单一组分。所有纯化的组分分别合并后过Sephadex G10色谱柱用超纯水洗脱除盐,冷冻干燥。

图1 PTR菌丝体组分的分离纯化步骤
1.2.3 PTR-MCW组分分析
1.2.3.1 PTR-MCW组分化学成分分析
总糖、糖醛酸和蛋白含量的测定分别采用苯酚-硫酸法[7]、硫酸-间羟基联苯法[8]和 BCA法[9]。
精确称取10 mg纯化的多糖以硫酸水解,取水解后的样品及标准品分别用硼氢化钠还原,并用乙酸终止反应;再加入1-甲基咪唑和乙酸酐进行单糖的衍生化,之后用二氯甲烷进行萃取,GC-MS上机分析单糖组成[10]。GC-MS条件如下:色谱柱Thermo ScientificTMTrace GOLD TG-5MS GC Columns(30 m×0.25 mm i.d., 0.25 μm 滤膜);载气为氦气;升温程序为50 ℃、1 min、50~150 ℃(10 ℃/min)、150~200 ℃(1 ℃/min)、200~280 ℃(20 ℃/min)、280 ℃持续5 min;MS条件为离子源温度200 ℃,电子能量70 eV,检测器电压1.5 kV,质量扫描范围33~550。
1.2.3.2 糖苷键构成分析
多糖的糖苷键构成采用甲基化衍生结合GC-MS分析的方法[11],称取干燥的多糖样品3 mg依次加入200 μL二甲基亚砜(dimethyl sulfoxide,DMSO)、100 μg NaOH粉末,吹吸混匀;加入碘甲烷进行甲基化反应3 h,用超纯水终止反应,然后用二氯甲烷进行萃取,氮气吹干;经水解、还原后,进行乙酰化衍生,得到部分甲基化的糖醇乙酸酯(partially methylated alditol acetates,PMAAs),之后用二氯甲烷进行萃取,GC-MS上机分析。GC-MS条件如下,色谱柱Thermo ScientificTMTrace GOLD TG-5MS GC Columns(30 m×0.25 mm i.d., 0.25 μm 滤膜);载气为氦气;升温程序为50 ℃ 2 min、50~150 ℃(20 ℃/min)、150~200 ℃(3 ℃/min)、200~280 ℃(20 ℃/min)、280 ℃持续7 min;MS条件为:离子源温度200 ℃,电子能量70 eV,探测器电压1.5 kV,质量扫描范围33~550。
1.2.3.3 多糖的FT-IR分析
称取1 mg多糖样品,充分干燥后采用KBr压片法[12]进行傅里叶变换红外光谱扫描,扫描范围为4 000~400 cm-1。
1.2.3.4 多糖分子量及分子构象分析
采用多角度激光光散射凝胶色谱系统(size exclusion chromatography-multiangle laser light scattering,SEC-MALLS)分析多糖的重均分子量(weight-average molecular mass,Mw)、均方根半径(root mean square radius, R.M.S. radius,又称回转半径,Radius of gyration,rg)[13]。MALLS光源为He-Ne激光源,波长为690 nm。所用凝胶柱为Ultrahydrogel@TM 2000(30 cm×7.8 mm i.d.),流动相为0.1 mol/L NaNO3溶液(用0.2 μm滤膜过滤,并且超声脱气),流速0.5 mL/min,柱温25 ℃。取经脱气处理的流动相溶解多糖样品,样品质量浓度为1 g/L。Astra软件用于实验数据采集与结果分析。
采用Zimm拟合法及公式(1)进行数据处理[14],即可得到多糖的Mw、R.M.S. radius等参数:
(1)

1.2.4 电镜分析
对1.2.1中粉碎过筛的虎奶菇菌丝体粉末、菌丝体细胞壁PTR-MCW及纯化并冻干后的MHA-I粉末进行SEM分析。取适量样品粉末,使其分散在样品板上,清除不被黏附的样品粉末,使得样品板上仅保留薄薄的一层待测样品,喷金后在10.0 kV下进行SEM观察[15]。为了进一步观测MHA-I的微观形态,将其充分分散溶解后进行TEM分析。将MHA-I多糖样品制成1 g/L的水溶液,与等体积1 g/L的SDS溶液混合,80 ℃加热2 h,梯度稀释至5 μg/mL,再80 ℃加热2 h,将样品滴在200目的多孔碳膜上,室温环境下干燥,80 kV下进行TEM观察[16]。
1.2.5 数据处理
所有试验均采用3次平行设计(n=3),试验数据采用Sigma plot 14.0软件进行统计和作图。
2 结果与分析
2.1 PTR菌丝体细胞壁的含量与组成
采用不同的溶剂对PTR-MCW进行提取分离,得到的组分及含量如表1所示。菌丝体细胞壁仅占干重(dry weight,DW)的(19.1±0.3)%,明显低于菌核[(78.4±0.7)% DW][5]和子实体[(46.6±0.9)% DW][10],说明PTR在不同生长阶段的细胞壁构成及形态特征具有明显差异。由表1可知,PTR菌丝体细胞壁中碳水化合物质量分数为79.0%,糖醛酸质量分数为5.06%,蛋白质质量分数为3.79%,各成分的比例与虎奶菇菌核和子实体中相应组分含量一致[5, 10]。
MCW分离后,热水提部分(MHW)占细胞壁的2.06%,其中蛋白质质量分数为55.61%,而总糖质量分数为41.3%(表1)。因此,菌丝细胞壁中可能含有少量水溶性蛋白质、多糖或糖蛋白组分。碱提组分(MCA-1、MCA-2和MHA)主要由碳水化合物和微量的糖醛酸组成,其中常温碱提组分(MCA-1、MCA-2)和热碱提组分(MHA)的含量分别占细胞壁干重22.06%和46.97%,与之前测定的PTR子实体细胞壁中相应组分含量(子实体常温碱提组分FCA和子实体热碱提组分FHA分别为20.5%和52.4%)接近[10],但与PTR菌核细胞壁中相应组分的质量分数(菌核常温碱提组分SCA和菌核热碱提组分SHA分别为41.2%和35.3%)[5]差异较大。此外,碱不溶性组分(MAI)中可测到的碳水化合物质量分数仅为45.7%,未检测到糖醛酸和蛋白质。
根据以上结果和溶剂提取强度顺序(由弱到强),预测PTR-MCW成分由外层到内层依次为水提多糖、蛋白质或糖蛋白,碱提多糖,不溶性多糖-几丁质复合物。
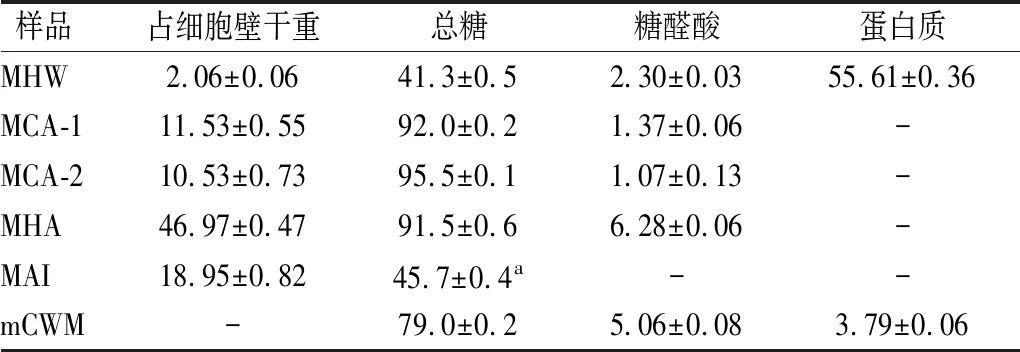
表1 PTR菌丝体细胞壁的组成成分 单位:%(质量分数)
注:a,苯酚-硫酸法检测不到几丁质中的葡萄糖胺[17];-代表无(下同)
由于细胞壁分离过程采用由弱到强的溶剂提取强度,以过往文献记载,所提取到细胞壁组分的顺序依次由外而内[18]。由此推断,PTR-MCW组分由外而内的顺序为MHW、MCA-1I、MCA-2I、MHA-I、MAI。PTR-MCW水溶性粗提物含量较低,且含有大量的蛋白质,所以对于MHW不进行进一步纯化,只分析其单糖组成;碱溶性组分经超滤膜纯化后,得到分子量较大的组分MCA-1I、MCA-2I和MHA-I,柱层析法进行纯化之后,分别从MCA-1I、MCA-2I和MHA-I中获得单一组分。对于分子量较小的组分MCA-1Ⅱ, MCA-2Ⅱ和MHA-Ⅱ,柱层析纯化之后,收集到样品含量极低。因此,纯化MCW多糖的分析主要集中于3种占主要成分的大分子可溶性组分MCA-1I、MCA-2I和 MHA-I。
2.2 细胞壁多糖的结构分析
2.2.1 PTR菌丝体细胞壁多糖的制备与组分分析
经检测,纯化多糖中不含糖醛酸,因此乙酰化衍生后采用GC-MS检测单糖组成。如表2所示[19],水提物MHW中含有较多的甘露糖、木糖、鼠李糖和半乳糖,随溶剂提取强度的增强,上述几种单糖组成含量依次降低,而葡萄糖含量逐步增加,具有明显的规律性。相比之下,不溶性组分MAI除含有质量分数为41.90%葡萄糖外,还含有58.10%的氨基葡萄糖(几丁质的结构亚基)。因此,MAI由葡聚糖-几丁质复合物组成[20]。

表2 PTR菌丝体细胞壁组分的单糖组成 单位:%(质量分数)
2.2.2 糖苷键构成分析
由于MCA-1I和MCA-2I在DMSO中的溶解度很低,无法顺利进行甲基化衍生和糖苷键构成分析,所以只对PTR-MCW的主要多糖组分MHA-I进行糖苷键构成分析。将GC-MS总离子色谱图(total ions chromatograph,TIC)中不同峰的质谱图与CCRC在线数据库中的标准质谱图比对[21],对MHA-I中糖苷键类型进行鉴定(表3),再根据TIC中单糖的峰面积和响应因子计算单糖残基的摩尔比[22]。
由质谱数据分析结果(表3)可知,MHA-I主要由T-葡萄糖(末端葡萄糖)、1,3-葡萄糖、1,4-葡萄糖、1,6-葡萄糖、1,3,6-葡萄糖和1,4,6-葡萄糖组成,此外,还含有少量T-木糖(末端木糖)、T-鼠李糖(末端鼠李糖)、1,3,6-甘露糖。其中鼠李糖、木糖、甘露糖和葡萄糖的质量分数分别为0.7%、1.2%、2.9%和95.3%,此结果与单糖组成分析结果一致(表2)。
分支度的计算公式为DB= (NT+NB)/(NT+NB+NL)[23],其中NT、NB和NL分别指末端残基、分支残基和线性残基的摩尔量,经计算,MHA-I的DB值为0.45,因此认为MHA-I是一种超支化的杂多糖。
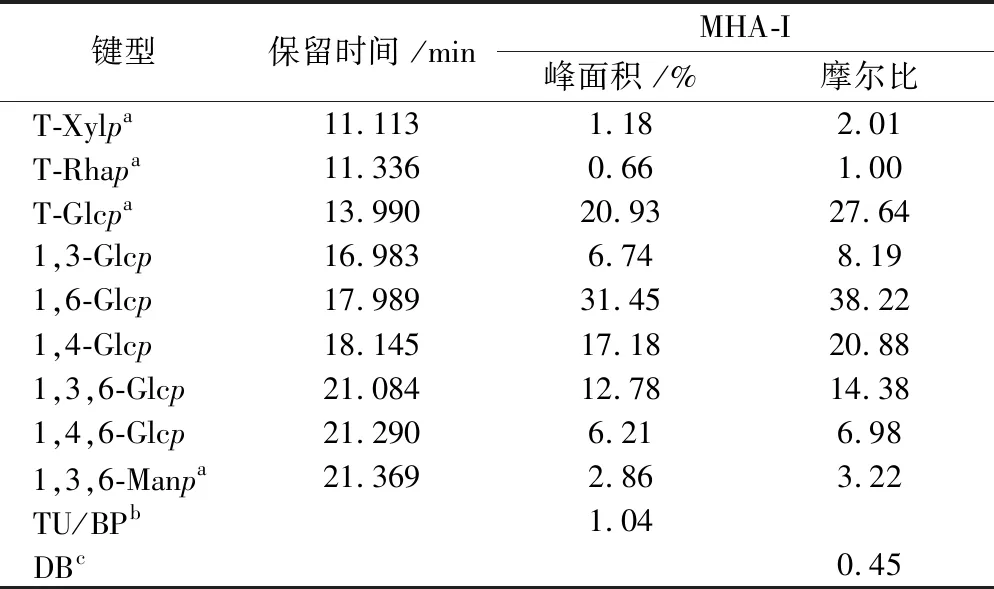
表3 甲基化分析MHA-I中糖苷键峰面积和摩尔比
注:a,T-Xylp, 末端吡喃木糖;T-Rhap, 末端吡喃鼠李糖;T-Glcp, 末端吡喃葡萄糖;Manp, 吡喃甘露糖;b,TU/BP (terminal units/branching points),末端单元/分支单元;c,DB (degree of branching),分支度
2.2.3 红外光谱分析
MHA-I的红外光谱如图2所示,在3 200~3 500 cm-1、2 700~3 000 cm-1、1 000~1 800 cm-1均有强吸收峰。其中,3 383 cm-1处的宽峰为—OH的伸缩振动,2 891 cm-1处的吸收峰是C—H的振动,1 638 cm-1处的吸收峰是由于羰基C—O—C键的伸缩振动,1 072、1 042 cm-1处的吸收峰表明MHA-I是吡喃糖905 cm-1处有吸收峰表明,MHA-I含有β-吡喃糖苷键[24]。
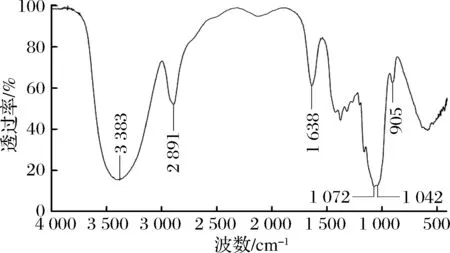
图2 MHA-I的红外光谱图
2.2.4 MHA-I分子量及分子构象
采用分子排阻色谱-多角度激光光散射联用系统(SEC-MALLS)测定多糖的分子量分布及多糖分子的构象信息。如图3所示,对称性较好的单峰表明MHA-I组分单一,具有较高的纯度(99.92%);图4显示纯化多糖MHA-I的(Rθ/Kc)c=0角度依赖关系。
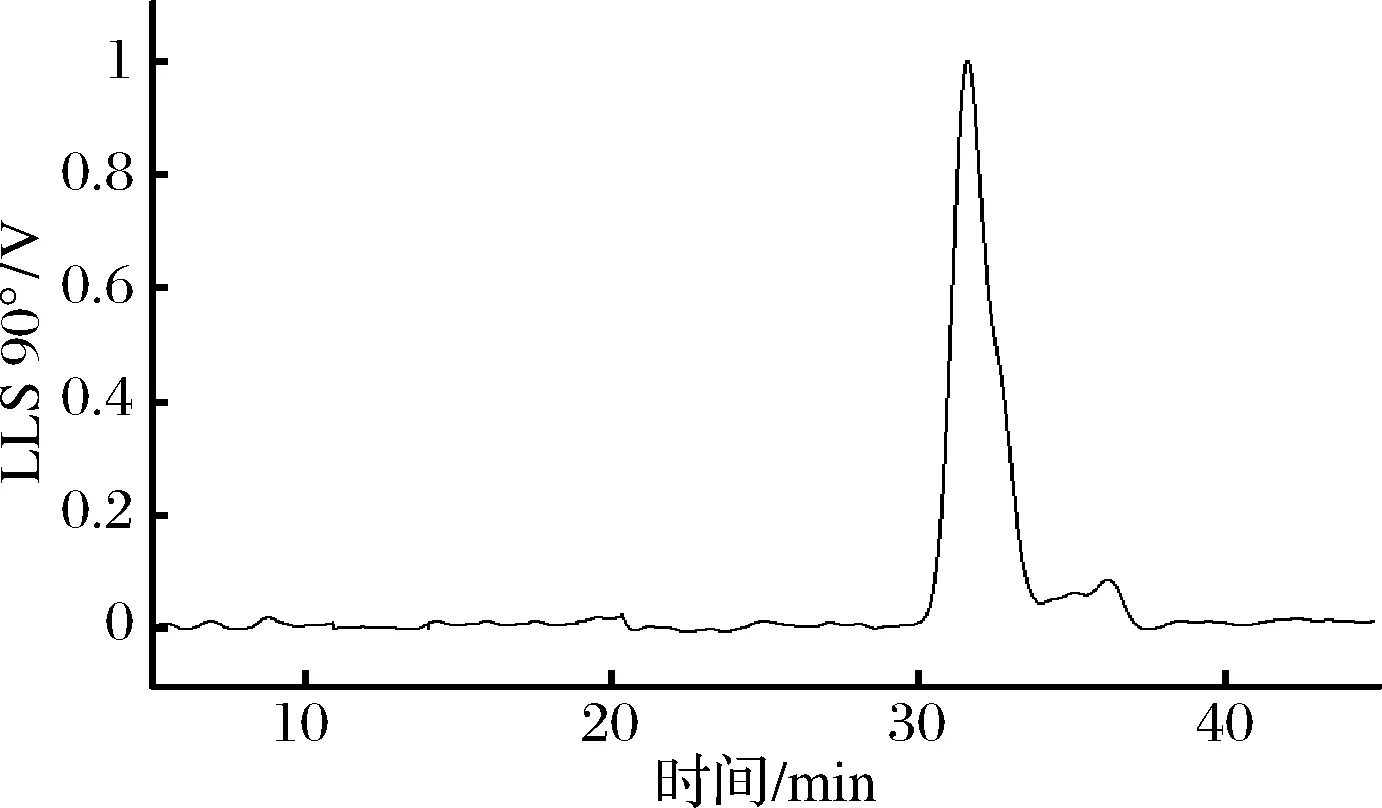
图3 MHA-I的SEC-MALLS色谱图
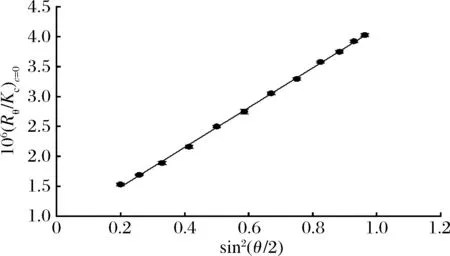
图4 MHA-I的(Rθ/Kc)c=0值与光散射角度的关系
MHA-I是从占细胞壁干重46.97%的MHA中纯化出的主要组分,表明该组分构成PTR-MCW的骨架。根据公式(1)和图4计算得到,MHA-I的Mw为4.502×104g/mol(表4),由图4的角度依赖的斜率得出R.M.S. 半径为33.2 nm。多分散系数(polydispersity index, PDI)反映了分子Mw的均一性,可由Mw/Mn计算得到,对于单分散分子,其值接近于1[25]。表4中Mw/Mn=1.154表明MHA-I具有较高的纯度。分形维数(df)是评价聚合物结构致密性的参数,df值越大,聚合物结构越致密。刚性杆或棒状结构分子的df值为1,无规则卷曲的线性聚合物的df值在5/3~2。分支残基越多,其df值越大,df=3代表具有理想三维空间结构的高分子[26]。df值可以根据公式(2)、公式(3)确定:
(2)
df=1/v
(3)
式中:指数v反映了聚合物的分子形状,当其值为0.33、0.50~0.60和1.0,分别表示球体、随机线圈和刚性杆的分子形状[27]。MHA-I的v值为0.37,对应的df值为2.69(表4),表明MHA-I的构象接近球形。

表4 MHA-I的SEC-MALLS分析结果
注:Mn,数均分子量;df,分形维数
与PTR菌核、子实体细胞壁(分别为SCA-I、FHA-I)[5, 10]多糖相比,MHA-I的Mw相对较小,且单糖组成较复杂,但是它们都被鉴定为超支化多糖;此外,糖苷键构成分析发现,SCA-I、FHA-I和MHA-I中主要的糖苷键类型一致,但MHA-I中含有更多其他类型的末端残基。
2.2.5 菌丝体及细胞壁形态观察
为了直观观测虎奶菇菌丝体及其细胞壁主要组分的微观形态,将相应组分进行电镜观测(图5)。由虎奶菇菌丝体粉碎后的SEM图像(图5-a)可知,粉碎过筛后断裂均匀,呈现表面形貌光滑的管状结构;与完整的菌丝体相比,细胞壁由于失去了胞内物质的支撑,并且在洗涤提取过程中经过了溶剂等的破坏作用而呈现表面粗糙的片状结构(图5-b)。而作为细胞壁的主要构成组分MHA-I在冻干后的SEM图像则呈现准球形的颗粒状态(图5-c),结果与SEC-MALLS结果一致。为了进一步观察MHA-I的微观形态,将其用SDS溶液溶解分散后以TEM观察,如图5-d所示,MHA-I分子为舒展的高分支聚合物,该结果与甲基化结果一致。因此,MHA-I组分为具有超支化结构特征的杂多糖聚合物,在干燥的粉末状态下和水溶液中呈现准球形,这也是超支化多糖的特点之一。
基于以上实验结果,初步预测PTR菌丝体细胞壁的结构为:细胞壁表面主要是可用沸水提取的蛋白,多糖和/或聚糖-蛋白复合物;细胞壁的第二部分是以葡萄糖为主的杂多糖,可以用不同浓度的常温碱溶液提取;第三组分由于含量较高,可认为是菌丝细胞壁的结构骨架,主要由具有超支化结构的葡聚糖构成,另含有少量的甘露糖、木糖和鼠李糖,可用80 ℃热碱溶液提取;葡聚糖和几丁质的复合物形成了细胞壁的第四部分,即使热碱溶液也不能将其从菌丝细胞壁中提取出来。
PTR-CWM的结构骨架与其子实体[10]类似,但超支化葡聚糖骨架中含有少量甘露糖、木糖等组分。与双孢菇菌丝体细胞壁[28]结构相比,它们菌丝体细胞壁的内层均为碱不溶性的多糖-几丁质复合物。不同的是,PTR-MCW的糖蛋白组分更多地集中于细胞壁的外层,而在双孢菇中糖蛋白贯穿整个菌丝体细胞壁;此外,双孢菇菌丝体细胞壁中的碱溶性多糖主要是葡聚糖,而PTR中是以葡聚糖为主的超支化杂多糖。
3 结论
本研究通过采用不同溶剂对PTR-MCW组分进行分离,得到4种细胞壁组分,分别为MHW、MCA、MHA、MAI,其比例为2.06∶22.06∶46.97∶18.95。从细胞壁主要组分MHA中纯化出的多糖MHA-I主要含有葡萄糖和少量甘露糖、木糖、鼠李糖。甲基化分析及FT-IR表明,MHA-I含有T-葡萄糖、1,4-葡萄糖、1,6-葡萄糖、1,3,6-葡萄糖等9种β-糖苷键,DB计算为0.45。结合SEC-MALLS分析结果可知,MHA-I为一种具有超支化结构的杂多糖,其分子量和半径分别为4.502×104g/mol、33.2 nm。电镜分析证实了MHA-I的超支化结构,而且该多糖在干燥的粉末状态下呈现准球形结构。本研究结果为探究细胞壁结构提供了新的思路和方法,PTR菌丝体作为一种重要的膳食纤维的来源,在食品工业等领域具有广泛的研究价值。

