高效液相色谱法测定静电层层自组装载药多层膜中葛根素的载药量
杨佳盈 盛振华 胡晓芬
1.浙江中医药大学生命科学学院 杭州 310053 2.浙江中医药大学中医药科学院
静电层层自组装多层膜是以聚阳离子、聚阴离子为组装基元,利用静电相互作用,由组装基元在基材表面交替沉积构筑而成[1]。以天然多糖为组装基元的静电层层自组装过程,可赋予多层膜独特的生物活性[2-4]。大量研究表明,以具有促进血管内皮细胞生长作用的壳聚糖作为聚阳离子,以抗凝作用确切、临床应用广泛的抗凝剂肝素作为聚阴离子,通过静电层层自组装技术构筑的壳聚糖/肝素多层膜涂层在生物相容性、生物降解性、促血管早期内皮修复及抗血栓等方面具有显著优势,可应用于构筑冠状动脉粥样硬化性心脏病介入支架的表面涂层[5-8]。
利用预包载药物分子的组装基元制备静电层层自组装多层膜,是构筑具有药物洗脱、局部释药作用的医用植入体涂层的重要策略之一[9-11]。葛根素是从中药葛根中分离的异黄酮类衍生物,可抑制平滑肌细胞增殖,保护心血管系统[12-13]。将葛根素载入表面呈电负性的聚合物混合胶束,利用壳聚糖与胶束的静电作用形成电正性的葛根素-壳聚糖/胶束预组装体,通过静电层层自组装技术,在基材表面交替组装肝素与葛根素-壳聚糖/胶束预组装体,可获得基于壳聚糖与肝素的载药多层膜。本研究利用十二烷基硫酸钠溶液崩解载药多层膜,建立高效液相色谱(high performance liquid chromatography,HPLC)测定多层膜中葛根素载药量的方法。
1 材料和方法
1.1 主要仪器和试药 LC-20AT高效液相色谱仪购于日本岛津公司;反渗透净水仪购于艾欧史密斯(中国)热水器有限公司;KQ5200DE数控超声波清洗器购于昆山市超声仪器有限公司;FD-1000冷冻干燥机为日本EYELA公司产品;XS分析天平购于梅特勒-托利多公司。葛根素对照品购自南通飞宇生物科技有限公司(纯度>99%,批号:FY12390810);壳聚糖购自阿拉丁化学试剂有限公司(中粘度200~400mPa·s,批号:F1917173);Pluronic®F127(F127)购自 Sigma-Aldrich试剂有限公司(批号:BCBC6633);肝素钠购自国药集团化学试剂有限公司 (优级纯,批号:20131017); 末端磺酸化的 Pluronic®P123(P123-SO3)由实验室自制[14];甲醇、甲酸为色谱纯,水为超纯水,其余试剂均为分析纯。
1.2 方法
1.2.1 静电层层自组装多层膜的制备 利用薄膜水化法将葛根素载入电负性的聚合物混合胶束[14],具体步骤如下:将浓度为75mg·mL-1的葛根素甲醇溶液1mL 逐滴加入含有 10mg·mL-1P123-SO3/F127(1/4,w/w)的 10mL 醋酸缓冲溶液(pH=4,0.1mol·L-1)中,磁力搅拌过夜,旋蒸除去多余的甲醇,0.45μm醋酸纤维素微孔滤膜过滤,制得载药混合胶束溶液。
将浓度为2mg·mL-1的壳聚糖醋酸缓冲溶液(pH=4,0.1mol·L-1)10mL 滴加至载药混合胶束溶液中,充分搅拌,制得电正性的葛根素-壳聚糖/胶束预组装体溶液。在相同条件下,使壳聚糖与P123-SO3/F127混合胶束作用,制得壳聚糖/胶束预组装体溶液。
石英片(1cm×2cm)在浓硫酸/H2O2溶液(7/3,v/v)中煮沸30min,三蒸水冲洗数次,氮气吹干,在1mg·mL-1的聚乙烯亚胺醋酸缓冲溶液(pH=4,0.1mol·L-1)中浸泡 30min,取出后在醋酸缓冲溶液(pH=4,0.1mol·L-1)中清洗数次,氮气吹干,制得表面呈正电性的基材。将基材浸入1mg·mL-1的肝素醋酸缓冲溶液(pH=4,0.1mol·L-1),浸泡 10min,取出清洗、吹干后浸入葛根素-壳聚糖/胶束预组装体溶液,浸泡10min,取出清洗、吹干;肝素与载药预组装体在基材表面交替沉积数次,分别制得组装层数为10、15和20双层的载药多层膜。在相同条件下,使壳聚糖/胶束预组装体与肝素在基材表面交替沉积,制得空白多层膜。
1.2.2 色谱条件 色谱柱:Hypersil BDS C18(4.6mm×250mm,5μm);流动相:甲醇-0.2%甲酸(18/82,v/v);流速:1.0mL·min-1;检测波长:250nm;柱温:30℃;进样量:10μL。
1.2.3 溶液配制
1.2.3.1 葛根素对照品储备液 精密称取葛根素对照品,甲醇溶解、定容,制得浓度为0.1mg·mL-1的葛根素对照品储备液。
1.2.3.2 供试品溶液 将载药多层膜浸没于十二烷基硫酸钠饱和溶液(0.25mol·L-1),超声 30min,37℃水浴振荡过夜后,收集崩解液,冷冻干燥。精密称取冻干产品,甲醇溶解、定容,制得浓度为25mg·mL-1的溶液,0.45μm微孔滤膜过滤,即得供试品溶液。
1.2.3.3 空白溶液 将空白多层膜按照1.2.3.2中的方法操作,制得空白溶液。
1.2.4 专属性试验 将葛根素对照品储备液稀释备用。分别取0.05mg·mL-1葛根素对照品溶液、供试品溶液和空白溶液,按照1.2.2中所述色谱条件进样检测,记录色谱图。
1.2.5 线性试验 精密量取葛根素对照品储备液1mL,甲醇稀释、定容,分别得到浓度为 2.0、4.0、6.0、8.0、10.0、12.0μg·mL-1的系列对照品溶液,以 0.45μm微孔滤膜过滤,按照1.2.2项所述色谱条件进样检测,以进样浓度(μg·mL-1)为横坐标(x)、葛根素峰面积为纵坐标(y),进行线性回归,得出标准曲线方程。
1.2.6 精密度试验 精密量取浓度为 2.0、6.0、12.0μg·mL-1的葛根素对照品溶液,分别连续进样6次,记录葛根素峰面积,依据标准曲线方程计算葛根素检出量。
1.2.7 稳定性试验 精密量取15双层载药多层膜的供试品溶液,分别于 0、1、2、4、6、8、12、24h 进样检测,记录葛根素峰面积,计算多层膜中葛根素的载入量。
1.2.8 重复性试验 精密称取10双层载药多层膜的冻干产品,按1.2.3.2所述方法分别制备5份供试品溶液,进样检测,记录葛根素峰面积,计算多层膜中葛根素的载入量。
1.2.9 空白回收率试验 精密称取一定量的葛根素对照品,加入十二烷基硫酸钠饱和溶液(0.25mol·L-1),将空白多层膜浸没于该溶液中,按1.2.3.2中所述方法操作,超声、水浴振荡过夜,获得崩解液,冷冻干燥后精密称取冻干产品,制备供试品溶液,进样检测葛根素含量,计算回收率。
1.2.10 多层膜载药量测定 制备3批组装层数分别为10、15和20双层的载药多层膜,按照1.2.3.2中所述方法,每批样品制备3份供试品溶液,进样检测,计算多层膜中葛根素的载入量。
1.3 统计学分析 采用SPSS 22.0统计软件进行统计学分析。计量资料以±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 专属性试验 葛根素的保留时间约为24min,空白溶液在葛根素保留时间处无干扰峰。见图1。表明多层膜组装基元不干扰葛根素的定量检测,显示本方法专属性较好。
2.2 线性试验 线性回归分析得到回归方程为:y=6.043×104x-2.229×104,r=0.9994。 结果表明,葛根素浓度在2.0~12.0μg·mL-1范围时,其浓度与出峰面积具有良好的线性关系。
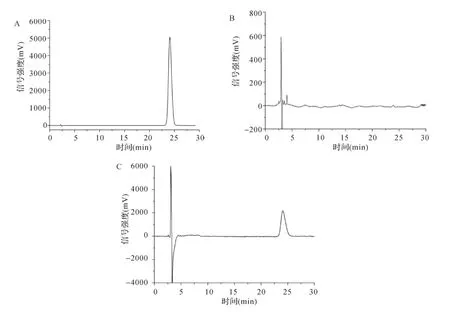
图1 HPLC专属性考察色谱图Fig.1 HPLC chromatograms of specificity investigation
2.3 精密度试验 结果显示,低、中、高浓度进样时,葛根素峰面积的相对标准偏差(relative standard deviation,RSD)分别为0.25%、0.73%和0.42%。 见表1。表明本方法的精密度良好。
2.4 稳定性试验 葛根素通过自组装作用载入多层膜后,于崩解液中释放,经冻干、复溶后配制成供试品溶液。专属性试验的结果验证了葛根素在供试品溶液配制过程中的稳定性,供试品溶液中药物的保留时间与对照品溶液一致。将供试品溶液24h内多次进样,测得多层膜中葛根素的平均载入量为2.52μg·cm-2,RSD为0.24%,结果表明供试品溶液在24h内保持稳定。
表1 精密度试验结果(n=6)Tab.1 Results of precision test(n=6)
2.5 重复性试验 平行制备5份供试品溶液,分别进样检测,测得多层膜中葛根素的平均载入量为2.02μg·cm-2,RSD 为 1.59%。
2.6 空白回收率试验 空白溶液制备过程中加入低、中、高剂量(1.00、2.00、4.00mg)的葛根素,考察包括崩解、冻干、溶液配制、进样检测在内的一系列实验步骤可能引起的药物损失。结果表明,药物损失在允许范围内。见表2。
2.7 多层膜的载药量测定 分别制备10、15和20双层载药多层膜的供试品溶液,依次进样检测,当多层膜组装层数由10双层增加至20双层时,单位面积多层膜中葛根素含量显著增加,葛根素含量分别为(1.92±0.54)μg·cm-2、(2.58±0.52)μg·cm-2和 (4.23±0.77)μg·cm-2,差异有统计学意义(P<0.05)。

表2 空白回收率试验结果(n=5)Tab.2 Results of recovery test based on blank samples(n=5)
3 讨论
近年来,越来越多的研究将中药活性组分作为客体分子载入基于高分子材料构筑的药物控释载体中,以达到延长药物半衰期、提高药物生物利用度、降低不良反应、实现靶向治疗等目的[15-16]。与光谱法、滴定法等其他定量检测技术比较,HPLC技术可同时实现混合物的分离与定量检测,在表征高分子药物载体系统的载药量方面具有显著的优势。
葛根素在心脑血管疾病治疗方面具有良好的疗效,本课题组曾报道HPLC技术检测壳聚糖微球制剂中葛根素含量的方法,色谱条件的确定与载体系统高分子材料结构特点密切相关[17]。在酸性溶液中,壳聚糖结构单元上的氨基质子化,可消除其与葛根素间的氢键作用,确保HPLC检测时葛根素峰的有效分离。本研究以甲醇-0.2%甲酸(18/82)为流动相,供试品溶液中的壳聚糖、肝素等聚电解质组分未与葛根素形成分子间作用,对药物的定量检测不产生干扰。
本研究构筑了基于Pluronic聚合物及天然多糖壳聚糖、肝素的静电组装多层膜作为葛根素的载体涂层,而崩解多层膜以获得含有游离药物的溶液是进行HPLC检测的首要步骤。研究证实,将静电组装多层膜浸没于十二烷基硫酸钠饱和溶液中充分孵育,利用离子作用崩解多层膜,具有高效、温和的特点,且不影响药物分子的稳定性[18]。本研究专属性试验结果表明,供试品溶液的主峰保留时间与葛根素对照品一致,验证了葛根素的稳定性。崩解液的冻干粉末在流动相甲醇-0.2%甲酸溶液中形成均质溶液,葛根素在溶液中处于游离状态。葛根素的保留时间与流动相中甲醇含量相关,降低甲醇含量可延长葛根素的保留时间,使其与多层膜组装基元材料、崩解剂等杂质有效分离。
本课题组前期研究表明,基于预组装体的静电层层自组装过程往往呈现非线性增长的特点[9,14]。本研究对多层膜载药量的定量检测结果显示,葛根素-壳聚糖/胶束预组装体在多层膜中的含量随着组装层数的增加而增加,载药量随之增加,也呈非线性增长的趋势。
综上所述,利用HPLC法定量检测静电层层自组装载药多层膜中葛根素的载药量,样品前处理方法简便、温和,制样及检测过程中葛根素载药量稳定,检测精密度、重复性及稳定性等良好,能够满足分析要求。该研究为深入探讨载药多层膜的性质奠定了基础,也为静电层层自组装多层膜的载药量研究提供了参考。

