合欢皮-白蒺藜药对对AngⅡ-ROS诱导下HSC-LX2细胞增殖及PKC/Nrf2/HO-1通路的影响
浙江中医药大学 杭州 310053
肝纤维化(hepatic fibrosis)是肝组织对慢性损伤的修复反应,是一系列复杂因素(如生长因子和氧化应激)共同作用的结果[1-2]。有研究报道肝星状细胞(hepatic stellate cell,HSC)活化是肝纤维化发生的中心环节,该过程受氧化应激、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)等诸多因素的影响,而诱导HSC凋亡或抑制其活化增殖被认为能够有效降低甚至逆转肝纤维化[3-4]。前期研究显示,AngⅡ能早期刺激 HSC产生活性氧簇 (reactive oxygen species,ROS),激活诸多因子参与的信号网络,刺激HSC增殖,诱导肝纤维化形成,提示AngⅡ诱导ROS的生成是肝纤维化发生的潜在机制[5-6]。
合欢皮-白蒺藜是浙江省名中医姚真敏教授在临床治疗慢性肝病时常用的药对,缓解肝脾肿大疗效显著。合欢皮性平味甘,归心、肝经,有安神解郁、活血消肿之功效[7-8]。白蒺藜性平,味苦、辛,入肝经,有平肝解郁、祛风明目之功效。已有报道证实白蒺藜具有抑癌和抗纤维化作用,也可增强抗氧自由基酶类的活性,拮抗脂质过氧化[9-10]。目前关于合欢皮-白蒺藜对肝纤维化影响的研究较少,故本研究采用血清药理学、MTT、Western blot及 Real-time PCR 等研究方法,观察合欢皮-白蒺藜药对含药血清对AngⅡ诱导的氧化应激环境下HSC的增殖情况以及对相关基因和蛋白表达的影响,以初步探讨合欢皮-白蒺藜药对含药血清的细胞干预机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物和细胞 SPF级雄性SD大鼠 60只,体质量180~200g,购于上海西普尔-必凯实验动物有限公司 [实验动物生产许可证号:SCXK (沪)2013-2016],饲养于浙江中医药大学动物实验研究中心[实验动物使用许可证号:SYXK(浙)2013-0184],每笼5只,以普通饲料喂养,温度25℃、每日光照黑暗时间各半。人源性HSC-LX2细胞购于北京北纳创联生物技术研究院。
1.1.2 主要药品和试剂 合欢皮购于杭州华东中药饮片有限公司(批号:180407);白蒺藜购于浙江中医药大学中药饮片有限公司(批号:171101);维生素E软胶囊购于浙江医药股份有限公司新昌制药厂 (批号:180531),使用时以蓖麻油溶解;马来酸依那普利片购于江苏制药股份有限公司扬子江药业集团 (批号:15092411),使用时以蒸馏水溶解。胎牛血清购于杭州四季青生物工程材料有限公司 (批号:11012-8611);RPMI 1640培养基、双抗(青霉素和链霉素)均购于美国 Gibco 公司(批号:8118320、15140-122);二甲基亚砜(dimethyl sulfoxide,DMSO)购于 Vetec 公司(批号:V900090);AngⅡ购于美国 Sigma 公司(批号:A9525);BCA蛋白浓度测定试剂盒购于上海碧云天生物技术有限公司(批号:P0012);蛋白激酶C(protein kinase C,PKC)兔单克隆抗体、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)兔单克隆抗体、血红素氧化酶-1(hemeoxygenase-1,HO-1)兔单克隆抗体和核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)兔单克隆抗体均购于abcam公司(批号:ab179522、ab5694、ab68477、ab62352);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔单克隆抗体和β-actin兔单克隆抗体均购于 Cell Signaling公司 (批号:D16H11、#4970);辣根过氧化物酶标记山羊抗兔二抗IgG购于达文生物有限公司(批号:DW-GAR007);Trizol、逆转录试剂盒和SYBR荧光定量试剂盒均购于Takara公司(批号:AHF1813A、AI40832A、AI40775A)。
1.1.3 主要仪器和设备 AE200倒置生物显微镜购于Motic公司;L500离心机购于长沙湘仪有限公司;Clinx化学成像分析仪购于上海勤翔科学仪器有限公司;PCR扩增仪为Applied Biosystems公司产品;imark酶标仪和实时定量PCR仪均购于Bio-Rad公司。
1.2 实验方法
1.2.1 含药血清的制备 根据临床的配伍经验,合欢皮-白蒺藜药对以5:4比例配比,分为高、中、低剂量组,另外设有空白组、维生素E组及依那普利组。合欢皮-白蒺藜药对高、中、低剂量组的剂量为60kg体质量成人每日总服药用量的2、1、0.5倍,换算成动物给药剂量分别为 10.8g/(kg·d)、5.4g/(kg·d)、2.7g/(kg·d),按10mL/kg的剂量灌胃给药;维生素E组以30mg/(kg·d)的维生素E溶液灌胃;依那普利组以10mg/(kg·d)的依那普利溶液灌胃;空白组以0.9%氯化钠溶液灌胃。各组大鼠灌胃2次/d,时间间隔6h,连续给药7d。末次给药2h后,大鼠腹腔注射3%异戊巴比妥麻醉,无菌条件下腹主动脉取血,静置1h后,4℃下3 000r/min离心20min,吸取上层血清至离心管,56℃灭活30min,微孔滤膜过滤后-20℃保存备用。
1.2.2 细胞培养 细胞采用含1%双抗和10%胎牛血清的RPMI 1640培养基,置于5%CO2、37℃的培养箱中培养,每2d换液,待密度达到80%~90%时进行传代。
1.2.3 MTT法检测细胞增殖率 取对数生长期的HSC-LX2细胞,胰酶消化制备单细胞悬液后,以5×103个/孔的细胞密度接种到96孔板,每孔100μL,细胞培养箱中培养过夜,使细胞贴壁。阴性对照组细胞正常培养,不加任何处理。除阴性对照组外,其余各组均加入 10-5mol·L-1的 AngⅡ 100μL 处理 24h,再正常培养。除AngⅡ组加入胎牛血清外,合欢皮-白蒺藜药对高、中、低剂量组、维生素E组、依那普利组以及空白血清组分别加入同样体积的相应大鼠血清:合欢皮-白蒺藜高、中、低剂量组大鼠血清、维生素E组大鼠血清、依那普利组大鼠血清以及空白组大鼠血清。各组加入血清后继续培养24、48、72h,每孔加入5mg·mL-1的 MTT 20μL,37℃孵育 4h 后,弃去上清液,加入DMSO 150μL,充分振荡10min,待蓝紫色甲臜结晶充分溶解,于570nm波长下检测各孔吸光值,各组吸光度与AngⅡ组吸光度的比值代表细胞增殖率。
1.2.4 Western blot检测相关蛋白的表达 细胞分组同1.2.3,待细胞贴壁,除阴性对照组外,其余各组细胞均以10-5mol·L-1的AngⅡ刺激 24h,再加入含药血清或胎牛血清配成的培养基培养24h。收集细胞,提取细胞总蛋白后用BCA试剂盒进行蛋白定量。10%SDS-PAGE电泳后转膜,用5%脱脂奶粉封闭1h,分别加入一抗(GAPDH稀释比例1:5 000、β-actin稀释比例1:5 000、PKC稀释比例1:2 000、α-SMA稀释比例 1:1 000、HO-1稀释比例 1:1 000、Nrf2稀释比例1:1 000)4℃孵育过夜,用TBST洗膜3次后加入二抗(羊抗兔IgG稀释比例1:2 000)室温振摇孵育2h。吸去二抗洗净后,以化学成像分析仪扫膜,以目标蛋白与内参蛋白条带灰度比值来表示蛋白相对表达量。α-SMA蛋白以GAPDH为内参,其余目标蛋白均以β-actin为内参。
1.2.5 Real-time PCR检测相关mRNA的表达 细胞分组同1.2.3,除阴性对照组外,其余各组均以10-5mol·L-1的AngⅡ刺激24h,再加入含药血清或胎牛血清配成的培养基培养24h。Trizol法提取总RNA,Nanodrop核酸蛋白测定仪检测RNA样本浓度与纯度,按照Takara逆转录试剂盒说明书逆转录获得cDNA,采用SYBR法进行Real time PCR反应。反应体系:SYBR Premix Ex TaqⅡ 12.5μL,10μmol·L-1的 Primer(mix)2μL,cDNA 2μL,灭菌水 8.5μL。 每个样本设3个复孔,在实时定量PCR仪上进行反应,反应条件:95℃ 30s,95℃ 5s,60℃ 30s, 共 40 个循环。以 β-actin 为内参基因,与 AngⅡ组比较,采用 2-ΔΔCt法计算基因相对表达量。引物由生工生物工程(上海)股份有限公司合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
1.3 统计学分析 采用Graghpad 7.0和SPSS 17.0统计软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析;进一步两组间比较采用Student-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖率比较 不同处理时长条件下空白血清组与AngⅡ组细胞增殖率无统计学差异 (P>0.05)。处理24h后,与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组均能显著抑制HSC-LX2细胞增殖(P<0.01,P<0.001,P<0.001),依那普利组细胞增殖也受到抑制(P<0.001),维生素E组细胞增殖则明显增强(P<0.05)。处理48h后,与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组均能显著抑制HSCLX2 细胞增殖(P<0.001,P<0.001,P<0.001),依那普利组细胞增殖也受到抑制(P<0.001),维生素E组细胞增殖则明显增强(P<0.05)。处理72h后,与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组均能显著抑 制 HSC-LX2 细 胞 增 殖 (P<0.05,P<0.001,P<0.001),依那普利组细胞增殖也受到抑制(P<0.001),维生素E组细胞增殖则明显增强(P<0.001)。见图1。2.2 各组细胞α-SMA表达比较 与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组α-SMA蛋白表达减低(P<0.001,P<0.001,P<0.001),依那普利组和维生素 E 组表达也降低(P<0.001,P<0.001)。 与 AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组α-SMA 的 mRNA 表达降低(P<0.01,P<0.001,P<0.001),依那普利组和维生素E组表达也降低 (P<0.001,P<0.001)。 见图 2。

图1 各组细胞增殖率比较Fig.1 Comparison of cell proliferation rate in each group
2.3 各组细胞PKC、Nrf2及HO-1蛋白表达比较 与AngⅡ组比较,合欢皮-白蒺藜药对低剂量组PKC蛋白表达降低(P<0.05),高、中剂量组PKC蛋白表达差异无统计学意义(P>0.05);依那普利组和维生素E组表达也降低(P<0.01,P<0.001)。 与 AngⅡ组比较,合欢皮-白蒺藜药对高、中剂量组Nrf2蛋白表达降低(P<0.001,P<0.01),低剂量组蛋白表达差异无统计学意义 (P>0.05);依那普利组蛋白表达也降低 (P<0.01),维生素E组蛋白表达差异无统计学意义 (P>0.05)。与AngⅡ组比较,合欢皮-白蒺藜药对高、中剂量组 HO-1 蛋白表达降低(P<0.001,P<0.001),低剂量组蛋白表达差异无统计学意义(P>0.05);依那普利组表达降低(P<0.01),维生素E组表达升高,但差异无统计学意义(P>0.05)。见图3。由此得出,与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组具有一定的抗氧化效果,维生素E组则呈现较好的抗氧化活性,依那普利含药血清也具有抗氧化活性。
2.4 各组细胞PKC、Nrf2及HO-1 mRNA表达比较与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组 PKC mRNA 表 达 减 少 (P<0.001,P<0.001,P<0.001),依那普利组和维生素E组表达也降低 (P<0.001,P<0.001)。 与 AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组Nrf2 mRNA表达降低(P<0.001,P<0.001,P<0.05),依那普利组表达降低(P<0.001),维生素E组表达升高(P<0.05)。与AngⅡ组比较,合欢皮-白蒺藜药对高、中剂量组HO-1 mRNA表达降低(P<0.001,P<0.001),低剂量组 HO-1 mRNA 表达差异无统计学意义(P>0.05),依那普利组表达降低,但差异无统计学意义(P>0.05),维生素E组表达升高(P<0.05)。 见图 4。
3 讨论
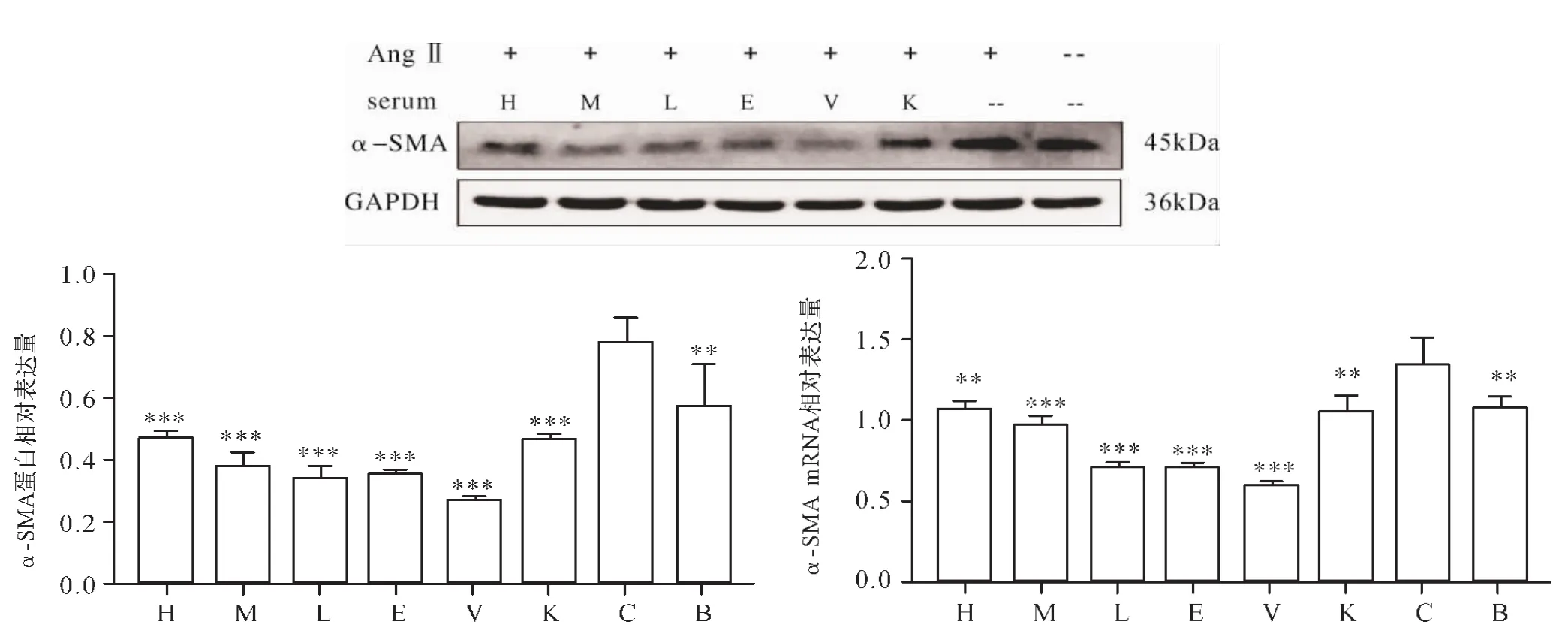
图2 各组细胞α-SMA表达比较Fig.2 Comparison of expression of α-SMA in each group

图3 各组细胞PKC、Nrf2及HO-1蛋白表达比较Fig.3 Comparison of protein expression of PKC,Nrf2 and HO-1 in each group

图4 各组细胞PKC、Nrf2及HO-1 mRNA表达比较Fig.4 Comparison of mRNA expression of PKC,Nrf2 and HO-1 in each group
众所周知,肝纤维化是一系列复杂因素(如生长因子和氧化应激)共同作用的结果。HSC活化是肝纤维化发生的中心环节,HSC的活化和增殖导致细胞外基质(extracellular matrix,ECM)异常沉积[1-2]。 研究证实,HSC的活化与氧化应激、AngⅡ等诸多因素相关,诱导HSC凋亡或抑制其活化增殖能够有效降低肝纤维化程度,甚至能逆转肝纤维化[3-4]。
研究指出,肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)在肝纤维化的发病过程中具有重要地位,肝组织也存在RAAS,而且与肝纤维化机制相关[11-12]。在诸多肝损伤因素诱导肝纤维化的过程中均可观察到不同程度的氧化应激反应,使细胞或机体内ROS过度产生,这一病理过程同时伴有抗氧化防御功能的减弱,氧化应激与抗氧化反应两者的平衡关系遭到破坏,导致细胞甚至组织损伤。氧化应激被认为是导致诸多肝脏疾病发生发展的重要因素[13-14]。HSC受到氧化因子刺激后,细胞膜上的PKC被激活,从而以磷酸化方式激活Nrf2[5,15]。Nrf2-抗氧化反应原件 (antioxidant response element,ARE)信号通路是被广泛报道的抗氧化应激信号通路,该通路对于肝脏疾病的防治具有重要意义[16-18]。PKC激活Nrf2-ARE通路并能够调控该通路上其他相关基因的表达。被激活的Nrf2进入细胞核后与ARE结合,进而激活HO-1等下游抗氧化保护性基因。因此,Nrf2被认为是治疗肝脏疾病的新靶点,同时PKC-Nrf2可调控HO-1表达,进而促进其抗氧化作用和组织保护作用[5,19]。
本研究发现,合欢皮-白蒺藜含药血清能抑制AngⅡ诱导的氧化应激,从而抑制HSC-LX2细胞的增殖。MTT结果显示,与AngⅡ组比较,合欢皮-白蒺藜药对高、中、低剂量组均能显著抑制HSC-LX2细胞增殖,且随着剂量减低,抑制效果有增强的趋势;与依那普利组比较,低剂量组抑制增殖效果相当;与阴性对照组比较,合欢皮-白蒺藜药对高、中、低剂量细胞增殖情况差异较小,表明经中药含药血清处理后细胞增殖活性能够恢复到AngⅡ刺激前的状态。α-SMA作为HSC活化的特有标志蛋白,其表达强度与HSC增殖以及肝纤维化程度呈正相关,即肝纤维化程度越严重,α-SMA表达越高[20-21]。AngⅡ刺激后,α-SMA表达上调,合欢皮-白蒺藜含药血清干预后表达降低;同时依那普利组和维生素E组α-SMA的表达也降低。
进一步研究发现,与阴性对照组比较,AngⅡ刺激后PKC的表达明显上调,Nrf2、HO-1也随之高表达,这提示AngⅡ激活了PKC,并通过诱导Nrf2、HO-1激发了机体潜在的抗氧化活性,但其中具体机制尚未明确。与AngⅡ组比较,经合欢皮-白蒺藜含药血清干预后,PKC的表达受到了抑制,其中合欢皮-白蒺藜低剂量组的抑制作用最明显,与α-SMA的结果类似;HO-1和Nrf2的表达也受到了不同程度的抑制,但低剂量组的抑制作用最弱。合欢皮-白蒺藜低剂量组对以上蛋白表达的影响趋势与维生素E较为相似,因此笔者推测合欢皮-白蒺藜的抗氧化作用机制可能类似于维生素E,但是否存在量效关系还需进一步研究。以上结果说明合欢皮-白蒺藜药对含药血清可能通过抗氧化途径抑制 HSC-LX2细胞增殖,从而阻止肝纤维化发展。
综上所述,AngⅡ可以诱导ROS产生,继而上调PKC、Nrf2、HO-1蛋白的表达,最终引起HSC-LX2细胞增殖。合欢皮-白蒺藜含药血清可能通过抗氧化途径抑制HSC-LX2细胞增殖,从而阻止肝纤维化发展,其作用机制可能类似于维生素E。关于合欢皮-白蒺藜的体内代谢问题以及含药血清在细胞内的具体作用途径,后续研究中将采用液质联用等技术进一步探讨。

