新型冠状病毒核酸检测的主要影响因素及控制措施*
阚丽娟,陈大洋,莫红梅,张秀明
(深圳市罗湖医院集团医学检验实验室&深圳大学第三附属医院检验科,深圳518001)
国际病毒分类委员会将新型冠状病毒命名为急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。由SARS-CoV-2导致的新型冠状病毒肺炎被世界卫生组织(WHO)正式命名为COVID-19(coronavirus disease 19)。国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第7版)》中将核酸检测列为确诊指标之一[1]。临床实践发现,某些疑似患者CT影像检查结果具有病毒性肺炎特征,但SARS-CoV-2 RNA检测多次甚至始终未检出,使临床对核酸检测的质量和意义提出质疑。本文结合本实验室在核酸检测过程中遇到的一些实际问题,对影响核酸检测的因素进行探讨和分析,并提出改善核酸检测质量的具体措施。
1 标本采集
研究证实,呼吸道标本SARS-CoV-2 RNA检出率由高到低为:肺组织>支气管肺泡灌洗液>抽吸痰或鼻咽吸取物>鼻咽拭子或口咽拭子>鼻拭子[2]。最新的报告指出,血液[3]、唾液[4-5]、粪便、尿液中均可检出病毒核酸,甚至有较高的检出率,但缺乏大样本多中心的临床验证。虽然COVID-19患者下呼吸道具有更高的病毒载量,病毒检出率也更高,但该类样本获取困难,且传播风险高,除重症患者外临床难以常规实施。因此,目前口咽拭子和鼻咽拭子仍是常用的样本类型,但这类样本的病毒核酸检出率与拭子材质、采集方法、样本采集量和采样时机等因素密切相关。
采样时,应选择质量好的无菌植绒拭子[6]。这类拭子易采集到更多的口咽和鼻咽分泌物,且置于样本保存液中细胞更易于洗脱,能最大程度地增加样本的采集释放量;而普通棉拭子与细胞的吸附力较强,难以洗脱,易造成部分细胞的丢失,降低采集释放量,因此不建议使用。
鼻咽拭子的采集及保存方法应规范[6]。此外,鼻咽拭子病毒核酸检出率与机体病毒感染进程密切相关,而目前SARS-CoV-2的自身特点和病程转归尚未完全阐明,采样的最佳时机无法确定,即便按照目前已发布的标准采样流程实施,也不能确保样本采集自病毒载量最高的时期,因此建议在疾病病程中多次、多部位取样,以提高检出率。
2 病毒灭活和核酸提取
2.1病毒灭活 标本灭活处理是生物安全防护的重要措施。根据现行的COVID-19诊疗指南,SARS-CoV-2经56 ℃ 30 min或75%乙醇处理等会被灭活[1]。虽然目前实验室在检测标本前均会对标本实施灭活处理,但不能明确标本的灭活处理是否会对后续的检测结果造成影响。陈培松等[7]对比灭活处理前后样本的RT-PCR结果,发现56 ℃ 30 min或75%乙醇灭活处理对核酸检测无明显的影响。但段秀枝等[8]采用不灭活处理和56 ℃ 30 min水浴、56 ℃ 60 min干浴及60 ℃ 30 min干浴3种灭活处理方式对鼻咽拭子标本进行病毒灭活,然后用商品化SARS-CoV-2 RNA实时荧光RT-PCR试剂进行检测,结果表明病毒灭活处理会使核酸降解,导致检测循环阈值(Ct值)降低,低浓度样本出现假阴性结果。病毒灭活处理是否影响核酸检测结果,还需要不同类型病毒保存液的比对实验研究予以证实。本实验室在初期未进行病毒灭活处理,出于安全考虑,后改用灭活处理后再提取核酸,未观察到灭活处理对检测结果有明显影响。
2.2核酸提取 目前SARS-CoV-2 RNA提取方法主要有直接裂解法、柱提法和磁珠法,其中以磁珠法最为常用;为保证人员安全、核酸提取纯度和效率,建议采用基于磁珠吸附的半自动或全自动核酸提取方法。提取量的大小与初始病毒载量呈正相关,提取量越大,扩增前病毒载量越大,假阴性率越低。适当增加PCR体系中的核酸洗脱液加入量及扩增反应体积也可以增加初始病毒载量,提高检测敏感性[2],各实验室可开展一定量的比对试验作为选择依据。
3 试剂盒的选择与性能验证
COVID-19暴发突然,各厂家开发的核酸检测试剂缺乏足够的临床样本进行完整的性能确认,而临床需求又迫在眉睫,因此,匆忙上阵的试剂盒质量可能参差不齐,其稳定性和可靠性有待进一步确认[9]。本实验室对国家药品监督管理局批准上市的5种核酸检测试剂盒和未上市的2种试剂盒(7种试剂盒的性能特征见表1)的检测结果一致性和检出能力进行了评估,选用本实验室初筛阳性且经深圳市罗湖区疾病预防控制中心复核确认为阳性的10例标本,用7种试剂盒进行检测,结果6种试剂的阳性检出率为100%,仅试剂盒D的阳性检出率为80%;另选一阳性样本核酸(B试剂检测ORF1ab基因Ct值为34.83、N基因Ct值为32.91)进行连续4倍稀释,得到共5个浓度梯度,使用7种试剂盒对每个梯度重复检测5次,计算各检测靶标阳性检出率,结果7种试剂对64倍稀释和256倍稀释样本的检测结果均为阴性,对原始浓度样本的检测结果均为阳性,但对弱阳性样本(4倍稀释和16倍稀释样本)的检出能力存在差异。建议弱阳性样本应至少用2个厂家的试剂复核检验,以保证结果的准确性。
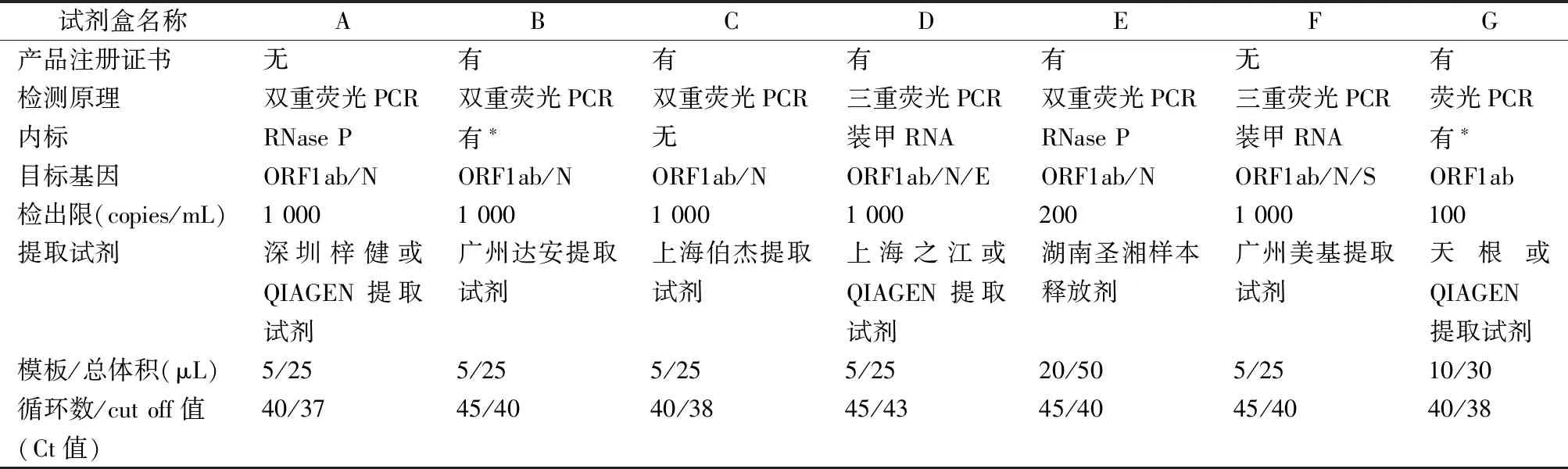
表1 7种国产SARS-CoV-2核酸检测试剂的主要特征
注:*,厂商未声明内标具体成分。
4 试剂盒的批间差对检测结果的影响
为提升产品质量,各试剂生产厂商不断优化检测试剂盒组分,包括内参、阳性对照的选择和扩增反应体系的优化等,可能造成不同批号试剂间存在差异。本实验室在核酸检测过程中发生了两起不良事件,都与更换试剂批号有关。
4.1内标改变 实验室使用A品牌试剂进行核酸扩增时,同一批样本用旧批号试剂检测,内标检测通道(CY5)呈典型S型扩增曲线,阴性对照无扩增曲线(图1A);更换新批号后,除阳性对照外,其余样本均无内标检测通道(CY5)的扩增曲线(图1B)。出现新批号试剂整批样本无内标曲线的情况后,本实验室除采用旧批号试剂比对外,还将该批样本的提取核酸用另一品牌试剂检测,排除了样本采样不合格和核酸提取失败的原因。联系厂商技术工程师和研发人员分析原因,发现该新批号试剂为厂商在不断优化产品的过程中生产的测试批次。该批号的试剂改变了内标及其引物序列片段,内标不再是“临床样本中上皮细胞固有的人源RNA基因片段”而是“外加RNA片段”,故按原说明书操作后内标检测通道(CY5)无扩增曲线。同时厂商改变了与之配套的阳性对照中的内标序列,使其在扩增过程中能够最大化地与内标引物结合。因此,阳性对照的扩增结果显示内标检测通道(CY5)的扩增曲线正常。新批次试剂尚处于试验调试阶段,厂商误将其当成品发出,造成此批试剂的实验室质检未通过。
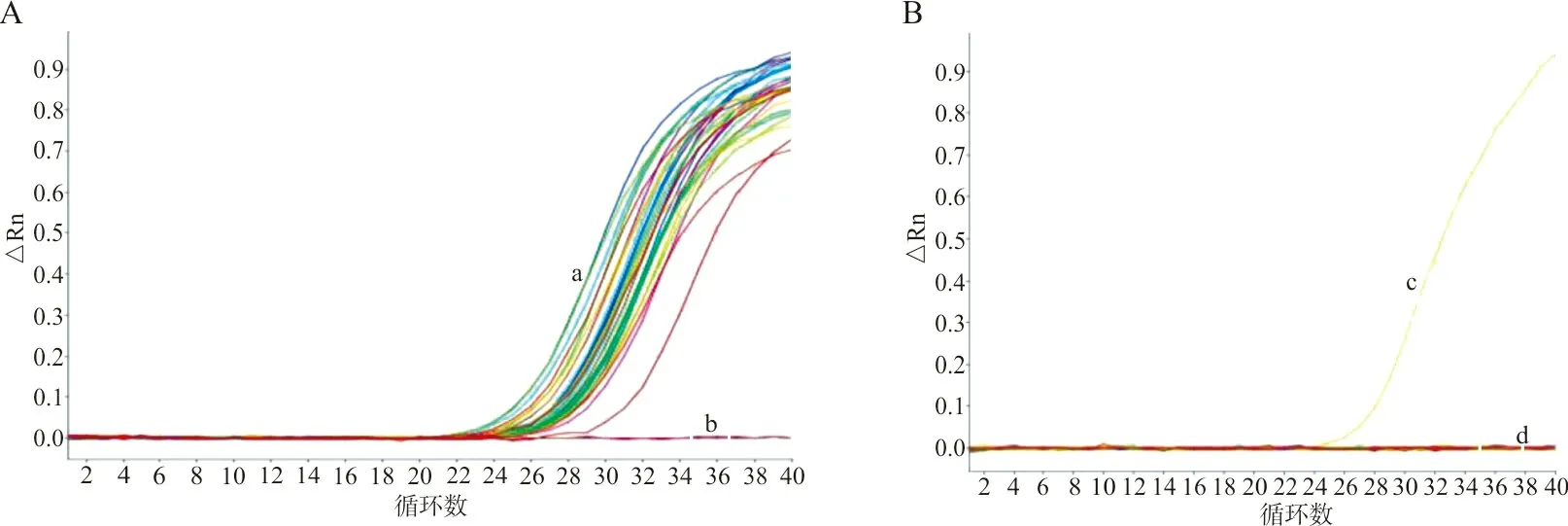
注:a,样本和阳性对照;b,阴性对照;c,阳性对照;d,样本和阴性对照。
4.2假阳性反应曲线 本实验室在核酸检测初期使用B品牌试剂,该试剂检测靶标为ORF1ab基因和N基因,经性能验证和临床测试满足预期用途。更换试剂批号时,同一天进行了4批次共204例样本的检测,ORF1ab基因出现阳性反应曲线的有42例,N基因出现阳性反应曲线的有68例,ORF1ab基因和N基因检测通道同时出现阳性反应曲线的有24例,见图2。4批次的12个阴性对照(试剂盒自带)中,1个出现ORF1ab基因阳性反应,3个出现N基因阳性反应。连续实验批次出现阳性率异常增高,实验室最初考虑为实验室内污染,随即停止操作,采取一系列措施查找污染源。

注:a,阳性对照;b,样本。
图2 B品牌试剂成批出现假阳性曲线
我们用无RNase水放置在样本处理间不同区域和生物安全柜内暴露2 h,上机扩增无反应曲线,由此可基本排除实验室内环境污染。同时,我们将实验中阳性反应曲线的样本核酸,分别采取用旧批号试剂、另一品牌试剂、原样本送疾病预防控制中心实验室3种方式再次检测,并与原实验结果比对。结果显示,样本均为阴性。表明新批号试剂检测的204例样本中,ORF1ab基因假阳性率达20%,N基因假阳性率达33%。经与厂商技术工程师交流,发现厂商在更换批号时“优化了试剂性能,尤其提高了N基因的反应灵敏度”,这和N基因假阳性率高于ORF1ab基因假阳性率相符合,且该新批号试剂在其他检测实验室也出现了同样的假阳性情况。所以,严格的试剂质检和批间比对不容忽视。
5 质量控制
5.1质控品的选择与使用 实验室最初可选择试剂盒中的阳性质控品、阴性质控品进行质量控制。每批检测至少1个阳性质控品、3个阴性质控品,阴性质控品应随机放置。后期在条件允许的情况下,实验室可将阳性标本灭活后用阴性样本稀释制成弱阳性质控品使用,以监控提取过程和扩增过程的有效性。
5.2实验室内污染控制 前述非特异性扩增的案例虽然最终证实不是室内污染,但防污染至关重要。实验室应按照《新型冠状病毒核酸检测专家共识》和《2019新型冠状病毒肺炎临床实验室生物安全防护专家共识》操作和安全防护,防止实验室内污染和假阳性结果。建议每天实验结束后配制3~5份无菌无RNase水分别放置于标本制备区、扩增区和生物安全柜内,暴露1 h以上,和样本一起上机扩增,用于实验室污染的监控。
5.3室间质量评价(external quality assessment,EQA) 最近,卫生部临床检验中心计划采用自研的无生物传染危险性的噬菌体病毒样颗粒样本开展SARS-CoV-2核酸检测EQA,在评价各实验室检测结果可比性或准确性的同时,还将有助于评价各实验室检测特异性和分析敏感性。
6 总结
影响SARS-CoV-2核酸检出率的因素涉及分析前、中、后的各个环节,需做好每一环节的质量把控。首先厂商应通过优化反应体系、提高引物特异性、完善质控试剂等开发出更可靠的检测方法;其次实验室应规范操作、充分验证其有效性,严格室内质量控制,积极参加EQA,以避免或减少假阴性;此外,临床和实验室应密切配合,对标本采集、保存与运输等分析前因素进行严格质量控制。

