1例诊断曲折的肺隐球菌病报道并文献复习
康宁 陈鸿志 周永慧 曹孟淑 庄谊 蔡后荣 李燕
近年来肺隐球菌病(Pulmonary Cryptococcosis,PC)的发病率逐步升高,其临床过程和影像学表现均缺乏特异性,容易误诊,进一步提高临床医师对该疾病的认识、及时明确诊断,对患者有着重要的意义。本文介绍1例辗转多家医院、历经曲折才被确诊的肺隐球菌病的诊治经过,并探讨肺隐球菌病的临床特点。
临床资料
患者女,59岁,因“间断发热、咳嗽5年余,再发1月余”于2018-12-23入住我科。患者2013年7月起出现低热,体温37.0~38.5℃,伴咳嗽、少量白痰。至当地医院行胸部CT(图1a)示两肺大小不等结节及团片影。行PET-CT检查示:双肺多发软组织影,代谢活跃(SUV最大值为14.9),考虑双肺多发转移,纵隔及双肺门多发软组织结节影,部分代谢增高,淋巴结转移不除外,颈部双侧、双侧腋窝、双侧腹股沟多发软组织结节影,代谢未见异常,多发淋巴结良性病变可能性大。患者至北京大学某医院就诊,行CT引导下经皮肺穿刺活检,病理示肺组织仅少数组织可辨认肺泡结构、大部分呈现机化性肺炎改变。为进一步明确诊断,患者至北京另一家医院再次行CT引导下经皮肺穿刺,病理示(肺)小块横纹肌及肺组织慢性炎、见上皮样细胞肉芽肿,特殊染色:PAS(-)、六胺银(-)、抗酸染色(-)。2013年10月开始予异烟肼、利福平、乙胺丁醇抗结核治疗,1个月后肺部病变有吸收好转(图1b)。但9个月疗程的抗结核治疗结束1月余后,患者发热、咳嗽反复,2015年8月复查胸部CT(图1c)示两肺病变较前进展。予口服美卓乐 28mg qd。1个月后复查胸部CT示两肺病变再次好转(图1d)。美卓乐逐渐减量至半年后停用。但美卓乐停用半个月左右后于2016年3月复查胸部CT(图1e)示病情再次进展,出现多发实变,予强的松30 mg qd口服。1个月后复查胸部CT示肺部病情好转(图1f)。口服强的松逐渐减量。2017年9月患者右侧股骨头坏死行手术治疗,停用强的松。之后复查胸部CT示肺部病情稳定。2018年5月患者因担心病情反复,再次口服强的松20 mg qd,2个月后减量为15mg qd。2018年11月患者发热、咳嗽反复,至我院门诊就诊,查胸部CT(图1g)示两肺多发斑片、结节影,局部小叶间隔增厚,部分结节可见空洞。为进一步明确诊治于2018-12-23收住入院。患者2012-09-04因“子宫内膜腺癌”行“子宫及双附件全切术”。2017-09-18因“右侧股骨头坏死”行“右侧股骨头置换术”。家族史无特殊。对“头孢”过敏。家庭主妇,无特殊职业接触史。无烟酒嗜好。入院体格检查:T 36.6℃,P 112次/分,R 18次/分,BP 121/72mmHg,SPO295%(未吸氧),神志清,精神可,皮肤巩膜无黄染,浅表淋巴结未及肿大,两肺呼吸音稍粗,两肺未及明显干湿啰音,心律齐,各瓣膜听诊区未及病理性杂音,腹平软,无压痛、反跳痛,肝脾肋下未及,双下肢无水肿。入院后完善相关检查:血常规示WBC 11.5×109/L、N 77.0%、Hb 124 g/L、PLT 262×109/L;尿常规示尿潜血(+);大便常规(-);生化全套示总蛋白59.9 g/L、白蛋白36.1 g/L、CRP 21.4 mmol/L,余基本正常;ESR、凝血五项、自身抗体全套、抗中性粒细胞胞浆抗体、类风湿三项、免疫常规、肺癌三项、淋巴细胞亚群计数、T细胞γ干扰素、G试验、GM试验均无明显异常;痰培养、痰真菌培养、3次痰抗酸杆菌涂片均无明显异常;常规心电图示正常窦性心律,V1导联R/S≥1,T波低平;血清隐球菌荚膜抗原阳性。进一步行B超引导下肺穿刺活检,病理(图2a)示肉芽肿性病变,其内见较多量真菌,倾向于隐球菌。免疫组化示(图2b、2c):GMS(+)、PAS(+)。患者最终诊断:肺隐球菌病。行腰椎穿刺除外中枢神经系统感染。予口服氟康唑400 mg qd,1月余后复查胸部CT(图1h)示肺部病变明显好转。
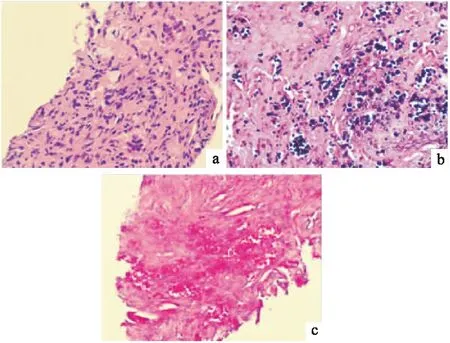
图2 该病例肺穿刺活检病理
讨 论
肺隐球菌病是由隐球菌感染引起的一种急性、亚急性或慢性真菌病。致病菌主要为新生隐球菌,该菌广泛分布于自然界的土壤及动物粪便中。致病途径为隐球菌孢子经呼吸道吸入达肺泡,因此呼吸系统常是隐球菌入侵人体的门户[1]。皮肤、黏膜或肠道也有作为侵入途径的可能。隐球菌对中枢神经系统的亲和性较高,当抵抗力减弱时,可经血液循环累及中枢神经系统。男女之间的发病率约为2∶1,发病年龄多为20~65岁,婴幼儿及老年人较少受累[2]。无明显职业倾向性。以往认为该病多发生于慢性消耗和免疫受损患者,近年来无基础疾病史、无接触史的免疫功能正常的患者亦逐渐增多。临床症状无特异性。常见症状有咳嗽、咳痰、发热、咯血、胸痛等,少见症状包括胸闷、呼吸困难及盗汗、纳差、体重下降等。这些症状与呼吸系统常见疾病如肺癌、肺炎、肺结核等的表现相似,无明显特异性[3],临床极易误诊。少数患者无任何症状而于体检时发现。
肺隐球菌病的影像学取决于病理学改变,而病理学改变又取决于患者的免疫状况[4]。隐球菌吸入肺泡后,巨噬细胞、多核巨细胞吞噬病原体,转变为非干酪性肉芽肿病变,从而形成结节或肿块,在巨噬细胞和多核巨细胞胞浆内含有被吞噬的隐球菌。而免疫功能抑制或低下的宿主,不易形成肉芽肿,且易在肺内播散,表现为弥漫性、多发性结节影或斑片状影,甚至多种形态病灶同时存在,在肺泡腔内充满隐球菌孢子[5]。肺隐球菌病特征性CT表现包括:单发结节或肿块型、多发结节或肿块型、单发或多发斑片影型、斑片与结节影混合型[6]。
根据美国感染病学会2010年更新的隐球菌病处理临床实践指南[7],免疫正常及免疫抑制轻至中度隐球菌肺炎患者,可选择氟康唑口服治疗(400 mg/d)6~12个月,免疫正常及免疫抑制重症隐球菌肺炎患者的治疗与中枢神经系统隐球菌感染治疗相同,疗程12个月。
血清隐球菌荚膜抗原检测对本病有很好的诊断价值,目前可采用乳胶凝集试验(LA)、酶联免疫吸附试验(ELISA)或胶体金免疫层析法(GICA),总敏感性和特异性分别可达到93%~100%和93%~98%[8]。本例患者采用的是GICA方法,正是由于该项检测阳性,再重新行经皮肺穿刺活检得以明确诊断。临床确诊需查见隐球菌病原体。可行经支气管镜肺活检、经皮肺穿刺活检、胸腔镜或开胸肺活检等[9]。肺隐球病病灶大多位于肺外周,经支气管镜肺活检阳性率较低,经胸腔镜或开胸肺活检创伤性较大,若术前未经抗真菌治疗则手术后可能造成播散,经皮肺穿刺活检操作相对简单、创伤小,针对大多数情况下表现为肺外周病变的肺隐球菌感染阳性率高[10]。本病例行3次肺活检均采用经皮肺穿刺方法。隐球菌HE染色不易着色,在临床工作中需注意,送检疑似隐球菌感染的病理标本时需注明行PAS染色或六胺银染色以便于明确诊断[11]。
该患者在我院查血清隐球菌荚膜抗原检测阳性、组织病理查见隐球菌,同时经抗隐球菌治疗后病变好转,故本次肺隐球菌病的诊断明确。回顾本例患者的诊治过程,初始予正规抗结核治疗,病情曾一度好转,但停药后病情很快反复,之后长期单独应用激素治疗病情即能得到缓解,故考虑病初诊断为肺结核的可能性不高。那是否有可能5年多前肺部病变即为隐球菌感染?该患者主诉“间断发热、咳嗽5年余”,曾多次在外院诊治,先后经抗结核、激素抗炎等治疗,并未行抗真菌治疗,但胸部影像学均有吸收好转,这是否可以用隐球菌感染解释?笔者检索文献发现,肺隐球菌病有自发缓解倾向[12-13],故该患者病情多次反复可以用隐球菌感染一元论解释。这提醒临床医生在未应用针对性抗真菌治疗时、即便观察到患者胸部影像学有短期吸收缓解,仍不应完全排除隐球菌感染可能。
综上所述,肺隐球菌病临床表现及胸部影像学无明确特异性,血清隐球菌荚膜抗原检测阳性对本病有很好的提示作用,经皮肺穿刺活检是针对该病较好的活检取材方法,肺隐球菌病有自发缓解的可能,故临床医师要加强对该病的认识及警觉性,需谨慎验证诊治结果,必要时需多次活检取材寻找病原学依据,避免误诊误治。

