特发性膜性肾病患者临床与肾脏病理表现的相关因素分析
郭广凤 谢大星 张雪琴 任慧敏 陆晨
832000 新疆石河子,石河子大学医学院(郭广凤,任慧敏);830001 乌鲁木齐,新疆维吾尔自治区人民医院肾病科(谢大星,张雪琴,陆晨)
膜性肾病(membranous nephropathy,MN)是指肾小球基底膜上皮细胞下免疫复合物沉积伴基底膜弥漫增厚为特征的疾病,其中发病原因未明者称为特发性膜性肾病(idiopathic membranous nephropathy,IMN)[1]。IMN占MN的70%,占全部原发性肾小球疾病的29.2%,约占所有肾小球疾病的9.9%~13.3%,是仅次于IgA肾病的高发肾脏疾病,随着生活方式的改变及环境污染等因素影响,其发病率逐年上升[2],约有20%的IMN患者在5~15年内进展至终末期肾病,给患者及社会造成巨大的心理及经济负担[3]。相关研究表明,估算肾小球滤过率(eGFR)下降是IMN预后不良的独立危险因素[4]。但近期国内尤其新疆地区关于IMN肾功能报道较少,我们通过对119例IMN患者的资料进行分析,探讨IMN患者的临床及病理特征及对肾小球滤过率的影响,以期提高临床医生对IMN患者肾脏功能的重视,进而延缓肾衰竭,改善预后。
资料与方法
一、研究对象
选取2017年1月1日至2018年12月31日于新疆维吾尔自治区人民医院肾内科行经皮穿刺肾组织活检并确诊为IMN的119例患者,其中男79例,女40例男女比例为1.98∶1,年龄为19~79岁,平均年龄(46.6±16.0)岁。纳入标准:(1)符合IMN肾脏病理特点者;(2)一般资料及临床、病理资料完整者。排除标准:(1)存在继发性膜性肾病,如自身免疫性疾病、病毒肝炎、感染、肿瘤、药物等疾病所致膜性肾病;(2)年龄<16岁者;(3)病理检查肾小球数<10个者;(4)合并原发性高血压、恶性肿瘤、重症感染、肝胆及血液等其他系统疾病者。
按eGFR将纳入患者分为两组,eGFR<90 mL·min-1·(1.73 m2)-1者为eGFR下降组(58例),eGFR≥90 mL·min-1·(1.73 m2)-1者为eGFR正常组(61例),比较两组患者的临床和病理资料。
二、研究方法
1.资料收集与比较 研究对象的临床和病理资料均来自住院病历。收集所有患者的一般资料包括性别、年龄、血压、病史、临床表现等。收集所有患者的实验室检查指标包括血清白蛋白(Alb)、尿酸、血肌酐(Scr)、尿素氮(BUN)、胆固醇、红细胞沉降率、24 h尿蛋白定量等。eGFR的计算应用简化的MDRD公式推算:eGFR=186×(Scr/88.4)-1.154×年龄-0.203×(女性×0.742)。
收集所有患者的病理资料,患者均于新疆维吾尔自治区人民医院肾内科行超声引导下经皮肾穿刺活检术,活检标本常规行电镜、光镜及免疫荧光检查。光镜检查:包括苏木精-伊红染色(HE)、PAS染色、过碘酸六胺银染色(PASM)、Massion染色,观察肾小球硬化、肾小管间质和肾小血管的病变性质和程度。免疫荧光检查:活检标本冰冻切片,采用直接免疫荧光法观察肾组织中IgG、IgM、IgA、C3、C4、C1q沉积的强度及部位。电镜检查:电镜观察脏层上皮细胞足突融合的情况及肾小球电子致密物沉积的部位强度。按照Ehrenreich-Churg分期标准将IMN分为4期。
2.诊断标准 高血压指既往有高血压病史或查体收缩压≥140 mmHg和(或)舒张压≥90 mmHg。肾病综合征:(1)尿蛋白>3.5 g/24 h,(2)Alb<30 g/L,(3)水肿,(4)血脂升高;其中(1)(2)两项是诊断所必需。镜下血尿:离心后尿沉渣镜检每高倍视野红细胞>3个。低蛋白血症:血清总蛋白低于60 g/L,或Alb低于30 g/L。肾小球硬化指肾小球毛细血管袢发生硬化性改变,镜下可见部分肾小球的片段为玻璃样均质蛋白质,硬化区的典型病变可见大量无细胞生物基质物质及透明样物质,PAS染色呈阳性反应,电镜下硬化病灶有大块电子致密物沉积[5]。肾间质纤维化指肾间质胶原纤维增生,以Ⅲ型胶原增生为主,可呈局灶性、多灶状、大片状和弥漫性分布[5]。肾小管萎缩指肾小管上皮细胞体积缩小、基底膜增厚、管腔狭窄、有阻塞时管腔扩张,可分为局灶性、多灶状、大片状和弥漫性萎缩[5]。
三、统计学处理
结 果
一、临床资料分析
共纳入119例IMN患者,占我院同期肾活检总数的16.0%,年龄为19~79岁,平均年龄(46.6±16.0)岁,其中男性79例,女性40例。患者中表现为肾病综合征的有65例(54.6%),镜下血尿42例(35.3%),低蛋白血症99(83.2%)。患者存在高血压46例(38.7%),水肿97例(81.5%),高尿酸血症26例(21.8%)。119例IMN患者全部进行了血清抗PLA2R抗体检测,总体阳性率为73.1%(n=87/119),eGFR正常组血清抗PLA2R抗体阳性率为70.5%(n=43/61),eGFR下降组血清抗PLA2R抗体阳性率为75.9%(n=44/58),eGFR下降组患者年龄、高血压患者比例、Scr、BUN显著高于eGFR正常组(P<0.05),而其血清总蛋白、Alb水平显著低于eGFR正常组(P<0.05)。(表1)
二、病理资料分析
119例IMN患者病理分期中,Ⅱ期最常见为50例(42.0%),Ⅰ期5例(4.2%),Ⅰ~Ⅱ期26例(21.8%),Ⅱ~Ⅲ期28例(23.5%),Ⅲ期10例(8.4%),无Ⅳ期患者。免疫荧光主要表现为IgG沉积,为116例(97.5%),另外IgA、IgM、C3、C1q沉积分别为36例(30.2%)、38例(31.9%)、75例(63.0%)、11例(9.2%)。光镜下大多数可见轻度系膜增生改变,镜下见肾小球硬化31例(26.0%),肾小管萎缩31例(26.0%),肾间质纤维化20例(16.8%),间质炎性细胞浸润27例(22.7%),小动脉增厚17例(14.3%)。eGFR下降组患者病理表现为肾小球硬化、肾小管萎缩、肾间质纤维化、间质炎性细胞浸润、小动脉增厚的比例显著低于eGFR正常组,差异具有统计学意义(P<0.05)。(表2)
三、患者eGFR影响因素的Logistic回归分析
将前述P<0.05的指标纳入多因素Logistic回归分析,分析患者eGFR的影响因素,结果发现高龄(OR=7.447,95%CI2.557~21.691,P<0.01)、肾间质炎性细胞浸润(OR=7.546,95%CI2.325~24.494,P<0.01)是IMN患者eGFR下降的独立危险因素,高Alb(OR=0.866,95%CI0.800~0.938,P<0.01)是eGFR下降的保护因素。(表3)
讨 论
IMN可发生于任何年龄,但中老年患者最常见,且以男性多见。本研究中IMN肾病患者119例,占我院同期肾活检的16.0%,男女比例为1.98∶1,与之前国内外报道基本一致[6],IMN临床表现为肾病综合征或水肿、大量蛋白尿等,多数患者伴有高血压或者镜下血尿。本研究中IMN患者主要临床表现为水肿(81.5%)、低蛋白血症(83.2%)、肾病综合征(54.6%)、镜下血尿(35.3%)、高血压(38.7%)、高尿酸血症(21.8%),与国内外研究基本一致[7-8]。但肾病综合征及镜下血尿的比例略低于国内外其他研究报道,如李虎才等人[9]研究发现IMN患者肾病综合征占72.43%,镜下血尿约占50%,可能与地域、医疗水平及与患者进入肾脏穿刺的时机等因素不同有关。
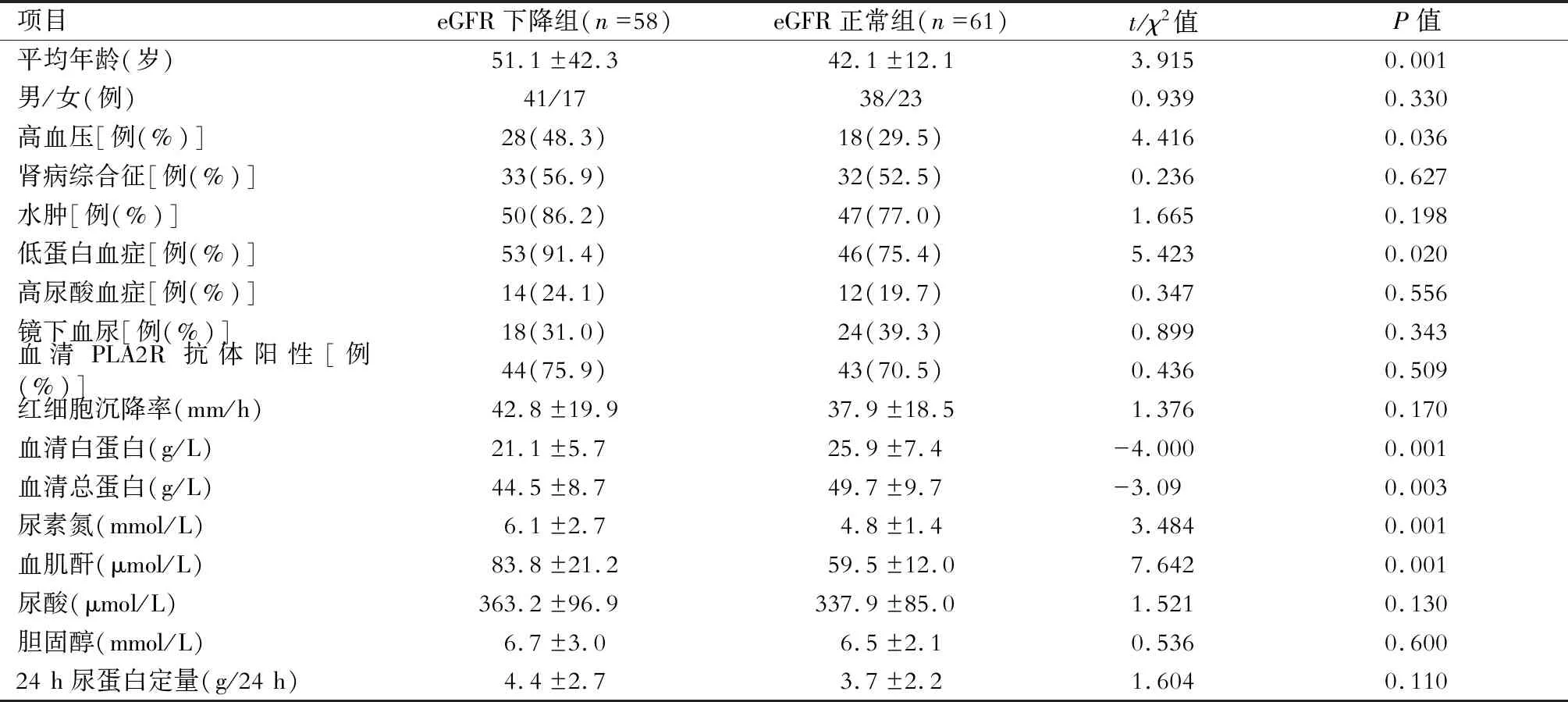
表1 eGFR下降组和eGFR正常组临床资料的比较
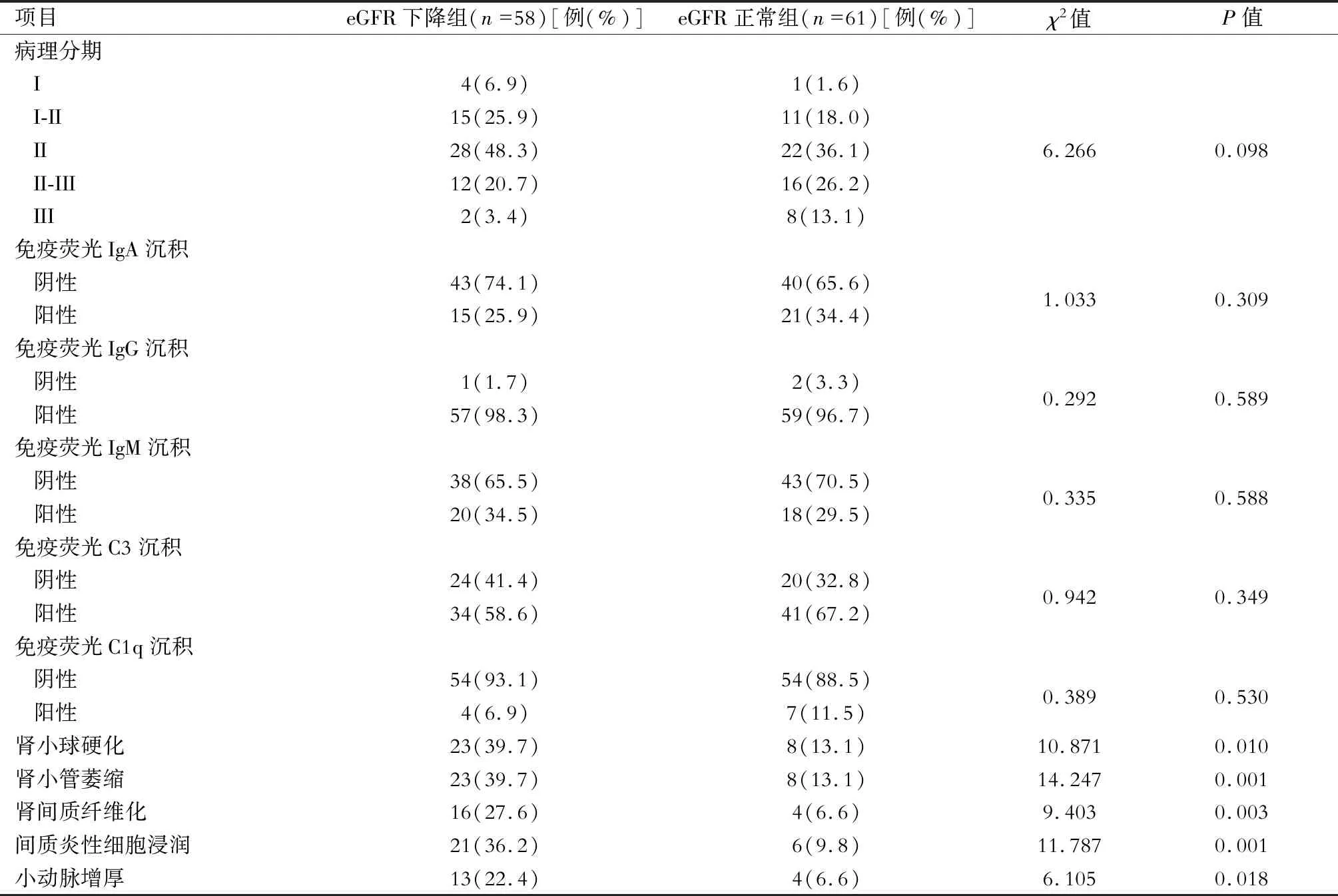
表2 eGFR下降组和eGFR正常组病理资料的比较
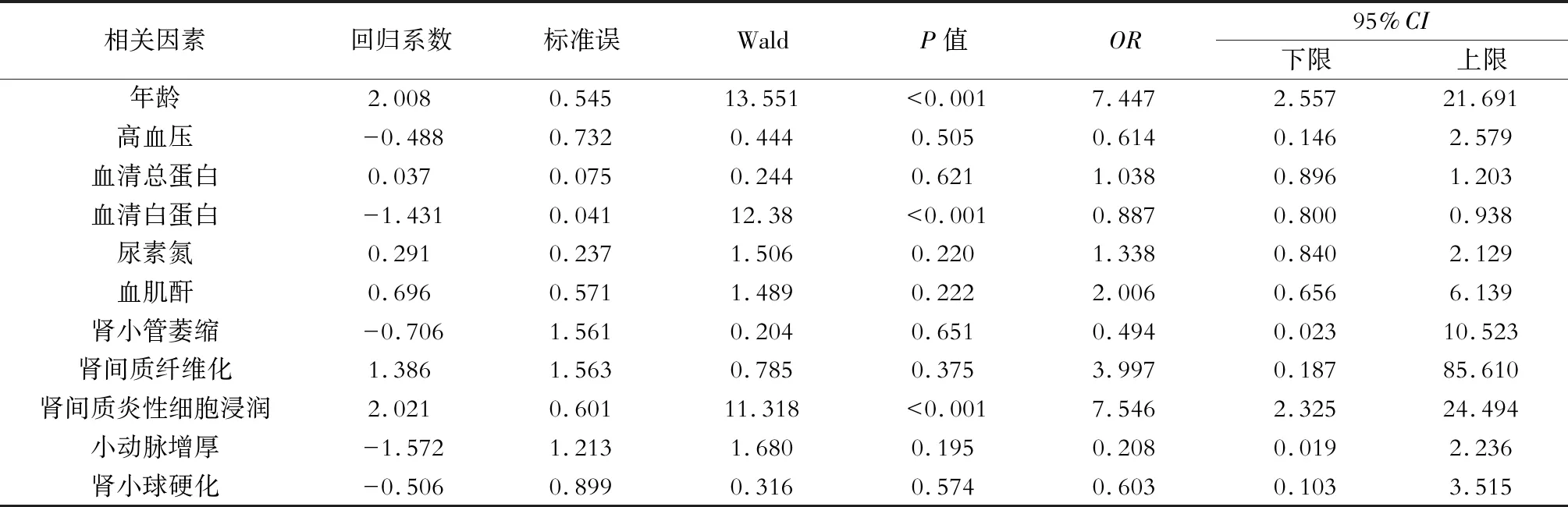
表3 eGFR影响因素的Logistic回归分析结果
本研究发现,eGFR下降组患者的年龄及高血压比例较eGFR正常组更高(P<0.05),另外多因素Logistic回归分析发现高龄是IMN患者eGFR下降的独立危险因素,这与既往研究一致[8-9]。左科等[10]研究发现肾活检时存在较高血压的IMN患者预后较差。随着年龄的增长,高血压患病率逐渐增加,长期的高血压可导致肾小球囊内压升高,肾小球纤维化、萎缩,肾动脉发生动脉硬化,氧缺乏及肾小管血流供应不足则导致肾脏滤过功能下降,加重肾脏病理病变,而肾脏功能下降又可以造成水钠潴留、激活肾素-血管紧张素-醛固酮系统等,从而促进高血压的发生和发展。本研究对两组患者病理资料的分析结果提示eGFR下降组患者肾小球硬化、肾小管萎缩、肾间质病变、小动脉病变的比例高于eGFR正常组,差异具有统计学意义(P<0.05)。因此对于IMN患者尤其中老年患者应密切监测肾功能,以期延缓IMN病程的进展。
有研究提示,高尿酸血症可能是原发性肾小球肾病的独立危险因素[11]。Jalal等人[12]通过回顾性研究证实eGFR下降的早期即有血尿酸升高,降低血尿酸有助于延缓肾脏病的进展。但本研究结果显示IMN患者eGFR正常组与eGFR下降组的尿酸水平及高尿酸血症的发生率均未见明显差异(P>0.05)。另外既往研究表明,男性、持续大量蛋白尿可以导致肾脏的严重并发症,而且是IMN进展为终末期肾病的独立危险因素[13]。但本研究结果显示eGFR下降组患者24 h尿蛋白定量、男女比例与eGFR正常组比较不具有显著差异(P>0.05)。可能与本次研究是单中心的研究且时间跨度较短、样本量相对不足有关,后期可进一步扩大样本量进行相关研究。
Alb全部由肝脏合成,占人体血浆蛋白总量的40%~60%,其具有维持血浆胶体渗透压、结合配体及运输代谢物质、抗氧化、防止细胞凋亡、维持内环境稳态等重要作用[14]。IMN患者出现蛋白尿时,约三分之一的尿蛋白为白蛋白,因此IMN患者极易出现Alb下降。段玉静等[15]对IMN患者研究发现Alb与eGFR密切相关,Alb能够提示IMN患者eGFR下降风险。Wiedermann等人[16]的一项荟萃分析提示低蛋白血症可以作为急性肾损伤发生及死亡的独立危险因素,并支持Alb在维持肾脏完整性和功能方面发挥重要作用。我们的研究发现高Alb水平是IMN患者eGFR下降的保护因素,因此对于IMN患者要积极地检测Alb及eGFR,早期纠正低Alb水平,减少肾损伤因素,尽可能延长患者进入终末期肾病的时间[17]。
IMN的主要病理特点是免疫复合物沿肾小球基底膜上皮细胞下形成和肾小球基底膜弥漫增厚,一般系膜区改变轻微,免疫荧光主要以IgG、C3沿基底膜呈颗粒状沉积。本研究纳入患者的IgG、C3、IgA、IgM、C1q沉积分别为116例(97.5%)、75例(63.0%)、36例(30.2%)、38例(31.9%)、11例(9.2%),免疫荧光以IgG、C3沉积为主,病理分期以Ⅱ期患者最多(42.02%),其次为Ⅰ~Ⅱ期(21.8%)和Ⅱ~Ⅲ期(23.5%),两组肾组织补体沉积及病理分期无明显差异(P>0.05),基本符合IMN病理特点[18-19]。目前IMN发病机制不清楚,上皮侧原位免疫复合物形成后激活补体,形成膜攻击复合物C5b-9、氧自由基,从而引起一系列细胞因子和炎症因子的活化,可以导致肾小球滤过膜及小管间质的损伤。有研究证实肾小管间质损伤和肾小血管病变是IMN预后不良的相关因素[20]。南京军区总医院一项对IMN患者随访2年的研究发现,活检时肾功能衰竭以及肾小管间质慢性病变为IMN患者进展为终末期肾病的独立危险因素[10]。本研究发现eGFR下降组肾小球硬化、肾小管萎缩、肾间质纤维化、间质炎性细胞浸润、小动脉增厚的的肾脏病理病变程度更为严重,且多因素Logistic回归分析表示肾间质炎性细胞浸润是eGFR下降的独立危险因素。多项研究结果与本研究一致,Wright等[21]研究发现肾小管间质损伤是IMN进展至终末期肾病的独立危险因素,同时Chen等[22]研究认为,IMN肾活检显示肾间质炎性细胞浸润者发生eGFR下降的风险增加约9倍。因此,对于疑似IMN患者在排除禁忌症后应尽快行肾活检明确病理类型;对存在肾间质炎性细胞浸润的eGFR下降的患者,应积极控制肾脏病理进展,保护肾功能,延缓病程,改善远期预后。
综上所述,本研究结果显示IMN好发于中老年患者,主要临床表现为肾病综合征,病理分期以Ⅱ期最多。高龄、肾间质炎性细胞浸润是eGFR下降的主要危险因素,高Alb水平是eGFR下降的保护因素,因此IMN患者应及时就诊,尽早行肾活检穿刺,积极进行个体化治疗,改善预后。但本研究是一个单中心、回顾性观察研究,今后我们将继续扩大样本量,进行前瞻性的研究以便得到更多证据。

