维持性腹膜透析患者血清总胆红素水平与全因死亡、心血管事件死亡的相关性
李静 李洛华 蒋红樱 董云萍 李玉凤
650101 昆明,昆明医科大学第二附属医院肾内科
透析治疗是目前对终末期肾脏病(end stage renaldisease,ESRD)患者维系生命的主要方式,包括血液透析(hemodialysis,HD)、腹膜透析(peritonealdialysis,PD)。有数据显示PD是肾脏替代治疗的主要方式之一,目前在世界范围内有超过272 000例终末期肾脏病患者接受PD治疗,占所有透析方式的11%[1]。我国透析治疗的患者是一个不可忽视的群体。然而,透析目前仍是一种死亡风险高、花费高的治疗方法,且心血管死亡是其主要死亡因素。血清总胆红素(total bilirubin,TBIL)主要来源于衰老红细胞中血红蛋白分解代谢。长期以来的观点认为其浓度升高对人体是有害的,在临床上血清TBIL对疾病的诊治应用广泛。胆红素是一种强还原性物质,近年的研究发现胆红素是一种内源性的强抗氧化剂,具有强大的抗氧化应激、清除自由基、减轻氧损伤、提高患者的抗氧化应激能力、抑制脂质过氧化,并在应激情况下能发挥对动脉粥样硬化、冠心病、炎症性疾病、肿瘤、肾病的保护作用[2]。氧化应激是慢性肾脏病(chronic kidney disease,CKD)的发病机制之一,并能促进CKD的发展,与CKD形成恶性循环。在CKD患者中,血清TBIL与肾功能水平密切相关。目前血清TBIL预测CKD患者,尤其是PD患者死亡风险的证据较为有限,国内仅有少数研究探讨过血清TBIL与PD不良预后的关系。因此,本研究回顾性分析了昆明医科大学第二附属医院126例接受PD治疗患者的临床资料。旨在探讨TBIL与持续不卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)患者全因死亡及心血管事件死亡风险的相关性。
资料与方法
一、研究对象
本研究为单中心回顾性研究,纳入标准为2013年1月1日至2015年12月31日在昆明医科大学第二附属医院肾内科置管并开始腹膜透析3个月及以上患者。收集患者的临床资料和实验室结果,排除标准为:(1)年龄<18岁;(2)透析时间小于3个月;(3)患有血液病、风湿病、器质性心脏病、近期手术且在研究前3个月内接受了输血;(4)透析前4周内出现过心脑血管事件、感染和出血;(5)转血液透析和肾脏移植患者。本研究经昆明医科大学第二附属医院伦理委员会审查通过。
二、方法
1.治疗方法 选用美国Baxter公司标准乳酸盐透析液,每天交换3~4次,每次2 L。选用的标准乳酸盐透析液中葡萄糖的浓度分别为1.5%,2.5%;离子成分:钠132 mmol/L、钙1.77 mmol/L、镁0.25 mmol/L、氯96 mmol/L、乳酸根40 mmol/L。
2心血管事件 死亡定义由心律失常、心力衰竭、冠心病、心源性猝死及脑血管事件所导致的死亡[3],由我院PD中心的医师及护士共同确定。
3.临床资料收集 收集所有入选患者透析初始时的基线数据,包括人口学资料、年龄、性别、体质量指数(BMI)、血压、原发性肾脏疾病、透析年份、KT/V值、高血压、糖尿病、心血管事件和实验室生化指标(白蛋白、血清TBIL、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、谷氨酰基转移酶、总胆汁酸、BUN、肌酐、尿酸、三酰甘油、总胆固醇、高密度酯蛋白胆固醇、低密度酯蛋白胆固醇、铁、钙、磷、C反应蛋白(C-reactiveprotein,CRP)、甲状旁腺激素(parathroidhormone,PTH)等,以CKD-EPI公式估算肾小球滤过率(eGFR)。以及患者转归、死亡原因等信息,死亡诊断判定以心血管因素为直接死因者归为心血管事件死亡。
4.分组 按照血清TBIL中位数水平分为两组,低血清TBIL组(TBIL≤5.9 mmol/L),高血清TBIL组(TBIL>5.9 mmol/L)。
三、统计学处理
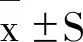
结 果
一、人口学与临床资料特点
2013年1月1日至2015年12月31日在昆明医科大学第二附属医院肾内科的195例CAPD患者,排除了年龄<18岁9例,透析时间小于3个月15例,转HD及肾移植的29例,16例患者缺失基线TBIL数据。剩余126例PD患者纳入本研究。PD的年龄为(52.8±13.5)岁,男性占65.9%,糖尿病占9.5%,高血压占57.1%。
二、分组及组间临床指标的比较
低血清TBIL组和高血清TBIL组间的血清TBIL、BUN、肌酐、eGFR、磷、钙磷乘积水平差异均有统计学意义(P<0.05)。而年龄、性别,合并高血压、糖尿病、心力衰竭、左心室肥厚、冠心病、脑血管意外、HBV、HCV,收缩压、舒张压、透析龄、血清白细胞、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、谷氨酰基转移酶、总胆汁酸、尿酸、铁、总胆固醇、三酰甘油、白蛋白、血糖、红细胞压积、钙、CRP、PTH两组间差异均无统计学意义。(表1)
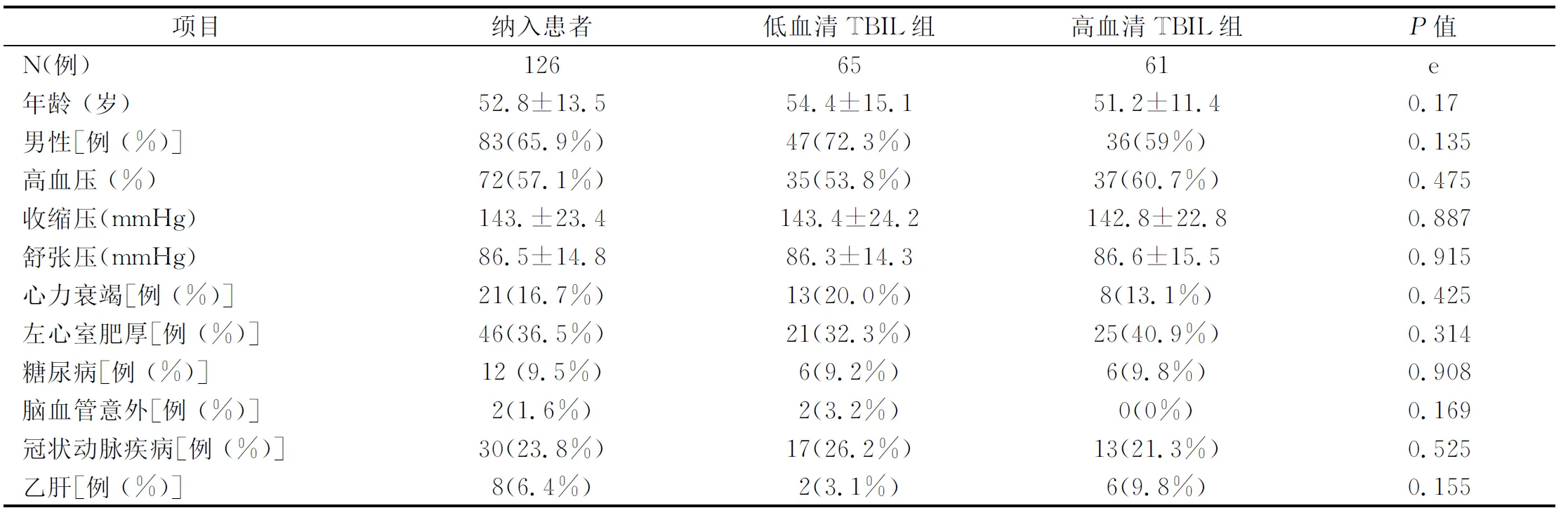
表1 根据血清总胆红素中位数分组后两组患者的临床资料比较
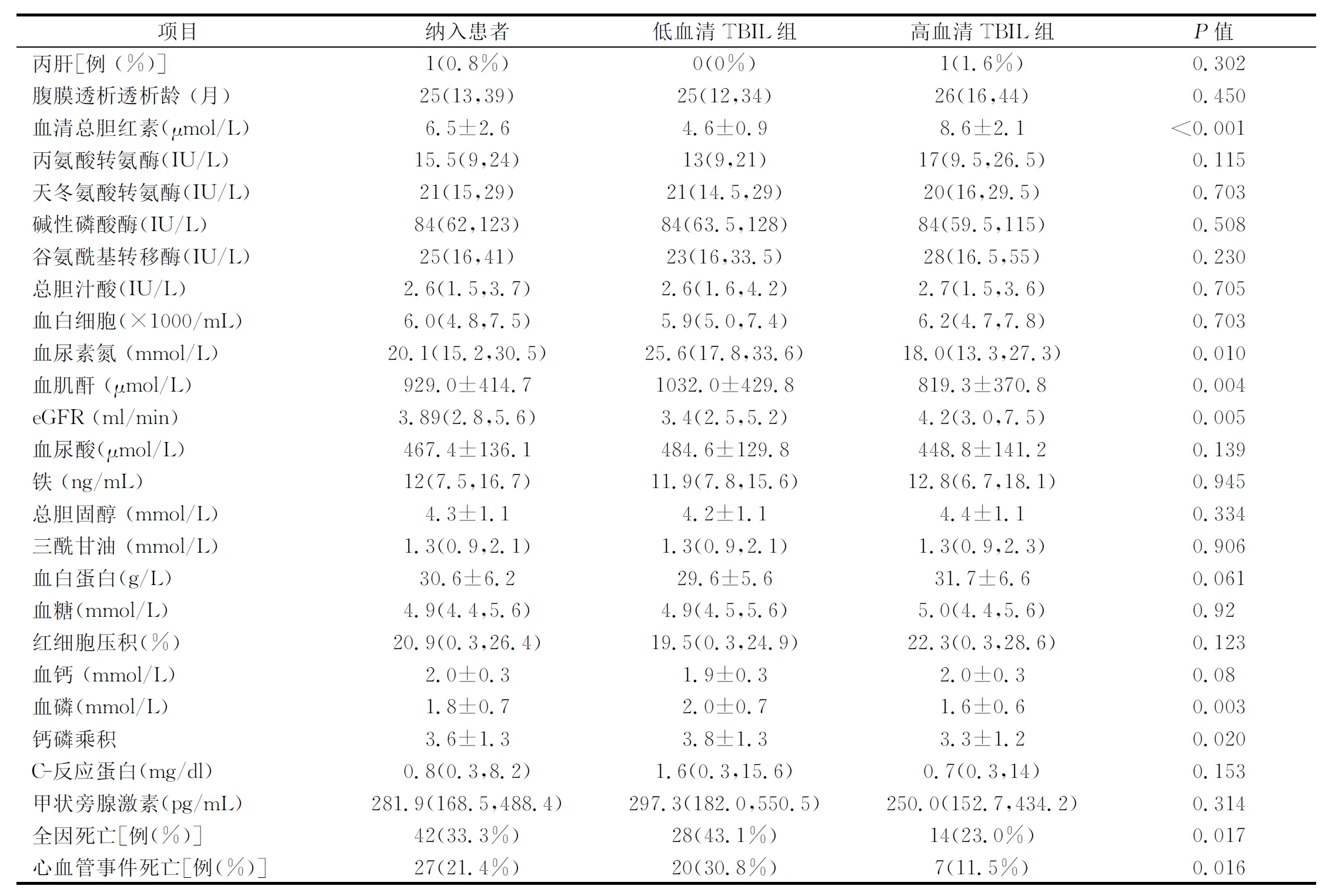
续表1
三、预后比较
患者随访时间为25(13,39)个月,全因死亡42例(33.3%),其中心血管事件死亡27例(21.4%)。低血清TBIL组中位随访时间25(12,34)个月,全因死亡28例(43.1%),心血管死亡20例(30.8%)。高血清TBIL组中位随访时间26(16,44)个月,全因死亡14例(23.0%),心血管事件死亡7例(11.5%)。低血清TIBL组的全因死亡率及心血管事件死亡率均高于高血清TIBL组(分别是P=0.017,P=0.016)(表1)。Kaplan-Meier生存分析显示,低血清TIBL组的全因死亡累计生存率及心血管事件死亡率累计生存率均低于高血清TIBL组(χ2=10.098,P=0.001;χ2=10.225,P=0.001)。(图1,图2)
四、血清TBIL与PD患者各影响因素的相关性分析
Spearman相关分析结果显示,血清TBIL与PD患者的透析龄、eGFR、钙、红细胞压积、血红蛋白呈正相关(均P<0.05),与磷、肌酐、尿素、尿酸、钙磷乘积呈负相关(均P<0.05),与性别、年龄、收缩压、舒张压、血清白细胞、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、谷氨酰基转移酶、总胆汁酸、铁、总胆固醇、三酰甘油、高密度酯蛋白胆固醇、低密度酯蛋白胆固醇、白蛋白、白细胞无相关性。(表2)
五、全因死亡及心血管事件死亡影响因素分析
低血清TBIL组与高血清TBIL组的1年、3年生存率分别是88.72%比93.23%,80.09%比87.75%。组间差异有统计学意义(P=0.001)。总体中位生存时间59个月,低血清TBIL组与高血清TBIL组中位生存时间分别是42个月和96个月。充分矫正后的多因素COX回归分析显示,低血清TBIL是CAPD患者全因死亡(HR=2.855 95%CI:1.476~5.524,P=0.002),心血管事件死亡(HR=3.5011 95%CI:1.442~8.498,P=0.006)的独立危险因素。(表3、4)
讨 论
本中心回顾性的纳入了126例PD患者,探讨了基线血清TBIL与126例PD患者生存率之间的关系,在校正混杂因素后发现低血清TBIL是PD患者全因死亡及心血管事件死亡的独立危险因素。胆红素是血红蛋白代谢过程中的正常最终产物,是一种内源性的强抗氧化剂,有研究发现胆红素因其抗氧化应激的特性,在脂代谢、消除自由基、减少蛋白尿和保护肾小球细胞等方面具有重要的生理保护作用,提高胆红素水平可缓解肾病综合征的进展[3]。在生理浓度下,胆红素通过抗氧化应激、清除自由基、并可与谷胱甘肽发挥协同作用,增强抗氧化作用,保护细胞膜脂肪酸免受氧化。一项Meta分析显示男性血清TBIL与动脉粥样硬化呈反比关系[4],同样的结果在大脑和肾脏系统也观察得到[5]。血清TBIL水平升高与成人心血管疾病发生率和全因死亡率较低有关,氧化应激是CKD的发病机制之一,并能促进CKD的发展,与CKD形成恶性循环。胆红素通过有效清除过氧化自由基并抑制肾脏组织脂质及脂蛋白氧化从而影响CKD 的进展[6]。一项研究显示低血清TBIL对发生肾功能恶化的风险是高血清TBIL的3倍以上,正常范围内血清TBIL水平轻度升高可能会延迟肾病发展进程[7]。血清胆红素具有潜在的肾脏保护作用,Targher等人[8]发现血清胆红素与eGFR呈负相关,提示血清胆红素是肾脏的危险因素。既往有研究发现血清TBIL和间接胆红素水平的升高是2型糖尿病和CKD患者1~5期的独立的保护因素,且血清TBIL和间接胆红素水平随CKD1~5期而下降,血清胆红素与eGFR正相关,与24 h尿蛋白负相关[9]。在一项台湾健康人的横断面研究中发现血清TBIL水平与高eGFR独立正相关,胆红素水平较高的患者其肾损害风险较低[10]。同样来自日本的一项研究证明,老年人血清TBIL水平下降与eGFR降低密切相关。这一关系背后的潜在机制尚不清楚,但似乎独立于传统的心血管危险因素,如性别、年龄、高血压,血脂异常和糖尿病[11]。低血清TBIL水平是eGFR小于60 mL·min-1·1.73 m-2的患者肾功能恶化的危险因素[12]。在生理范围内的相对高胆红素血症与肾功能下降延迟相关,研究通过证明胆红素治疗可改善小鼠和体外实验的肾纤维化,从而发现胆红素是肾脏疾病进展的保护因子,对肾脏纤维化的影响可能是其作用机制[13]。
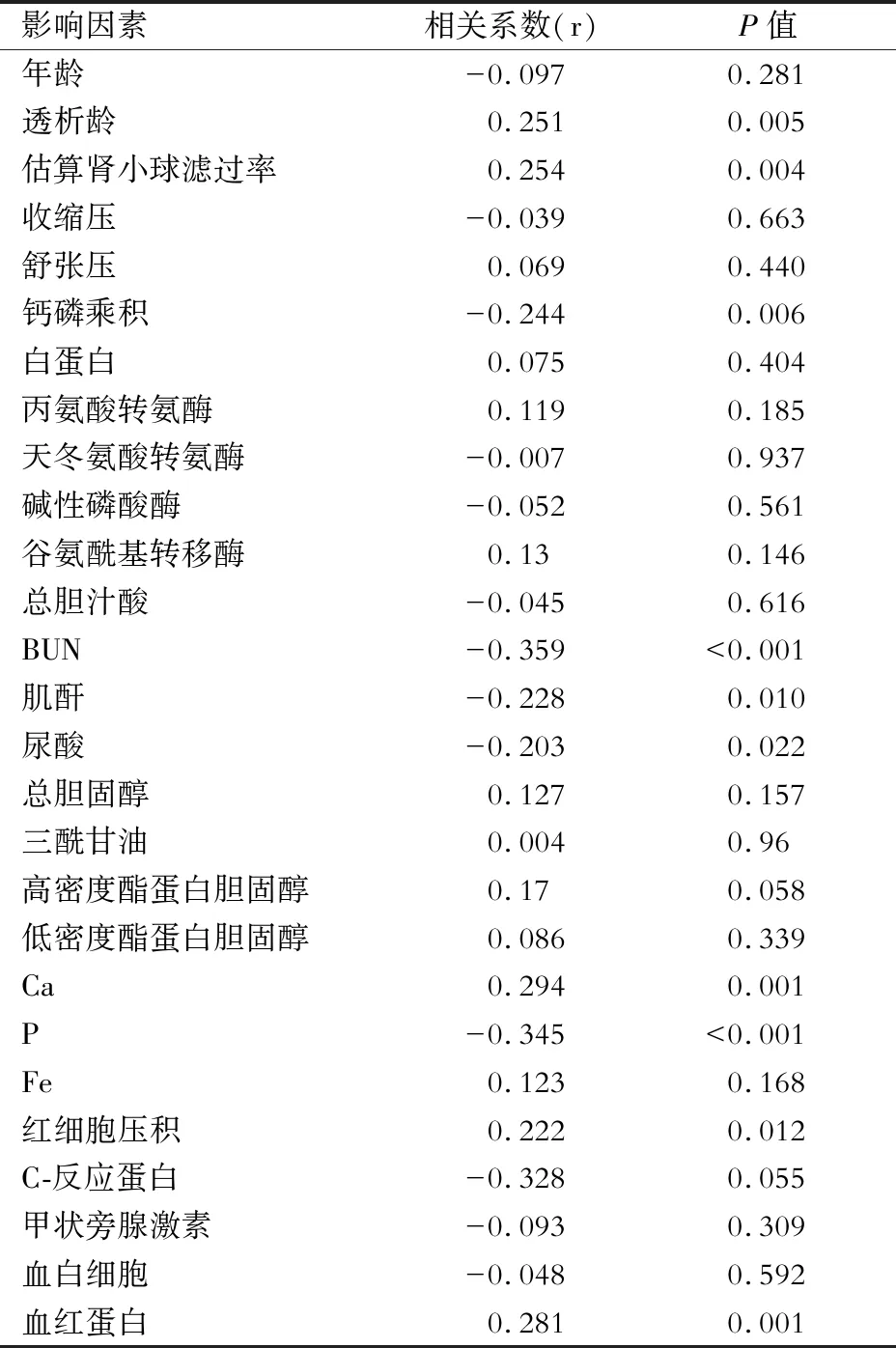
表2 血清总胆红素水平与临床资料相关分析(Spearman相关分析)

表3 血清总胆红素水平与全因死亡相关性COX回归分析结果

表4 血清总胆红素水平与心血管事件死亡相关性COX回归分析结果
注:模型1:未矫正混杂因素
模型2:校正了性别、年龄、合并HBV、合并HCV、高血压、糖尿病、CVA、CVD、CHF、LVH。
模型3:在模型1的基础上进一步校正了ALB、ALT、UA、BUN、CEAR、eGFR、Ca、P、HCT、Hb、钙磷乘积。
最近国外的一项研究显示炎症、高血压和氧化损伤是胆红素保护作用的靶机制,胆红素可能是减轻纤维化相关肾损伤的潜在治疗靶点,与ALB结合的胆红素治疗可能对肾纤维化有潜在的益处[14]。一项研究显示在血清TBIL浓度的生理范围内轻度增加与高血压的发生呈负相关,而且在女性和非吸烟者中胆红素对高血压的发展的作用更加明显[15]。目前对血清TBIL与透析患者的相关研究较少,一项对台湾的47 650名血液透析患者研究发现血清TBIL较高组的患者死亡率显著增加,差异有统计学意义[16]。而另一项关于PD患者研究发现血清TBIL水平与PD患者3年死亡率之间的关系呈U形曲线,最低点范围为0.5~0.6 mg/dL,认为血清TBIL水平可作为预测PD患者生存一种新的标志物[17]。国内最近的一项研究认为,基线血清TBIL≤3.4 mmol/L,与PD患者全因死亡相关,与心血管事件死亡的相关性差异无统计学意义[18]。在我们的研究中发现低血清TBIL组患者的透析龄、eGFR、LVH、钙、红细胞压积、血红蛋白均低于高血清TBIL组,与合并CVA、磷、肌酐、尿素、尿酸、钙磷乘积均高于高血清TBIL组。本研究发现血清TBIL与eGFR呈正相关,与Liu Y等研究结果一致。低血清TIBL组的全因死亡率及心血管事件死亡率均高于高血清TIBL组(P=0.017,P=0.016),两组间全因死亡、心血管事件死亡率差异均有统计学意义,Kaplan-Meier生存分析显示,低血清TIBL组的全因死亡累计生存率及心血管事件死亡累计生存率低于高血清TIBL组(分别为P<0.001,P=0.001),差异有统计学意义。低血清TBIL组与的1年、3年生存率均低于高TBIL组,组间差异有统计学意义(P=0.001)。充分矫正后的多因素COX回归分析显示,低血清TBIL是CAPD患者全因死亡及心血管事件死亡的独立危险因素,(P=0.002,P=0.006)。
综上,基于本研究,认为低血清TBIL是PD患者全因死亡及心血管事件死亡的独立危险因素。血清TBIL水平可作为预测腹膜透析患者生存一种新的标志物。并且血清TBIL作为当前生化常规的常见检测项目,具有方便、简单、快速、价格低廉等优点。因此,我们可以根据PD患者的生化检测项目分析血清TBIL的值,如果血清TBIL水平低,可采取相关的干预措施进行治疗,通过调控血清TBIL水平降低心血管事件的发生,从而降低PD患者的死亡风险,提高患者的生存率,改善生活质量。血清TBIL可能是PD患者的一种潜在的治疗靶点。但是这只是我们研究的猜测,还需要进一步的、多中心的临床研究加以证实。本研究与其他研究结果存在的差异,可能与地域、医疗卫生条件、患者自身情况的差异有关,另外,本研究为单中心、小样本的回顾性研究,不能完全排除混杂因素的干扰,血清TBIL对于PD患者的临床应用价值及其确切的作用机制有待在以后的前瞻性研究中进一步探讨,同时也需要确定对PD患者生存最有利的血清TBIL区间以利指导临床应用。TBIL中间接血清胆红素、直接胆红素等各亚型对PD患者死亡的预测也待进一步研究。

