hs-CRP、NLR、PLR与维持性血液透析患者心脏瓣膜钙化的相关性
王云丹 蒋卫杰
上海 200435,上海市静安区市北医院肾内科
维持性血液透析(maintenance hemodialysis,MHD)对治疗慢性肾脏疾病具有较大临床价值,可提高患者五年甚至十年生存率。而血管钙化(vascular calcification,VC)为透析患者常见并发症,其中心脏瓣膜钙化最常见。心脏瓣膜钙化发病机制较复杂,主要包括成骨蛋白刺激、骨细胞增殖和分化等主动过程和血管壁周围平滑肌细胞物质沉淀被动过程,相关研究显示其与超敏C-反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、碱性磷酸酶(alkaline phosphatase,AKP)等蛋白反应有关[1]。目前最新研究显示骨细胞增殖和分化受到炎性因子影响,其中血小板淋巴细胞比值(platelet lymphocyte ratio,PLR)、中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)对VC诊断敏感性和特异性较高[2]。另有文献指出,PLR、NLR在参与VC过程中,hs-CRP表达显著增高,提示PLR、NLR在心脏瓣膜钙化中可为理想生物标志物[3]。由于心脏瓣膜钙化高发病率和多因素发病机制,其分子机制和血清指标已受到广泛关注。但综合文献发现目前对心脏瓣膜钙化风险相关性指标的相关报道较少,且尚未有对该病的定量预测和判断标准。因此,本研究探讨心脏瓣膜钙化与hs-CRP、NLR、PLR水平相关性,旨在建立特异性和敏感性较高的预测和诊断模型。
资料与方法
一、研究对象及分组
回顾性分析2016年2月至2019年2月于上海市静安区市北医院肾内科80例行MHD患者的临床资料,其中男性45例,女性35例。研究获得医学伦理会批准,患者及家属均签署知情同意书。入组标准:(1)由专科医师根据临床表现、实验室、影像学全面检查确诊为慢性肾脏疾病;(2)有MHD适应症且行MHD;(3)年龄30~85岁;(4)无其他严重感染;(5)由慢性肾脏疾病引起的血清学指标异常和代谢紊乱;(6)不合并风湿性关节炎或变应性支气管哮喘。排除标准:(1)合并心、肝、肾、肺方面严重疾病;(2)对本研究不配合,中途退出;(3)合并恶性肿瘤;(4)生命体征不平稳;(5)合并免疫性疾病;(6)临床资料不完整,各项检查不完善;(7)使用华法林治疗者。
根据是否发生心脏瓣膜钙化分为两组,研究组(n=51)为发生心脏瓣膜钙化患者,对照组(n=29)为未发生心脏瓣膜钙化患者。研究组包括重度钙化18例、中度钙化20例、轻度钙化13例;二尖瓣瓣膜钙化18例,主动脉瓣瓣膜钙化25例,二尖瓣和主动脉瓣瓣膜均钙化9例。
二、方法
1.判定标准 (1)瓣膜钙化诊断标准:病理学检查肉眼见灰白色或灰黄色区域,质地硬、脆,切之有沙粒感;苏木素-伊红(HE)染色镜下呈紫蓝色,组织学上呈现大小不一的颗粒状或片块状物质沉积;经胸超声心动图(transthoracic echocardiography,TTE)检查见瓣膜增厚,回声增强且有1个及以上>1 mm强回声。(2)瓣膜钙化分级标准:瓣膜有所增厚,轻度钙化见灶性光点或亮线瓣叶;中度钙化:瓣膜增厚较大,瓣叶有1~2条呈粗糙条索状强回声亮线或多层回声;重度钙化:瓣膜显著增厚,回声强弱不匀,有多条宽0.4~1.0 cm粗糙强回声带或钙化强回声带,无瓣膜曲线。
2.资料收集及指标检测 联合自制问卷调查表(经验证K=0.621,可信度高),问卷调查剔除重复样本和不合格问卷。比较患者一般资料包括年龄、性别、体质量指数(BMI)、家族史、吸烟史、饮酒史、心血管病史;透析时长;临床指标:白细胞计数(WBC)、血红蛋白(Hb)、白蛋白(ALB)、三酰甘油(TG)、高密度酯蛋白(HDL)、尿酸(UA);实验室检查:分别抽取两组患者前臂肘空腹静脉血5 mL,置于含促凝剂的真空采血管中,20 min内采用离心机(德国Sigma)以1 000 r/min转速离心15 min,分离血清后置于-80℃冰箱保存备用;参照 ELISA试剂盒(日本东芝/min) 说明书测定hs-CRP水平,仪器为东芝TBA-120FR全自动生化仪;采用电阻抗法检测NLR、PLR水平,仪器为Sysmex XT-4000i全血细胞分析仪;试剂盒购自迈瑞生物医药公司,操作方法由5年及以上临床经验专科医师按照使用说明执行;比较研究组和对照组hs-CRP、NLR、PLR水平;并按照瓣膜钙化分级标准将其分为重度、中度、轻度钙化组,比较3组hs-CRP、NLR、PLR。
三、统计学处理
采用SPSS 18.0软件进行统计分析,多组间计量资料比较采用单因素方差分析,两两比较采用Snk-q检验,非参数检验Mann-Whitney法检验分级资料;计数资料(性别、家族史、吸烟史、饮酒史、心血管病史)比较采用χ2检验;Pearson相关分析hs-CRP、NLR、PLR与钙化程度相关性;logistic回归方程分析其发病高危因素;以P<0.05表示差异有统计学意义。
结 果
一、一般资料比较
研究组和对照组性别、年龄、BMI、家族史、吸烟史、饮酒史、心血管病史、透析时长、Hb、UA比较P>0.05,研究组和对照组WBC、ALB、TG、HDL、校正钙使用比较P<0.05。(表1)
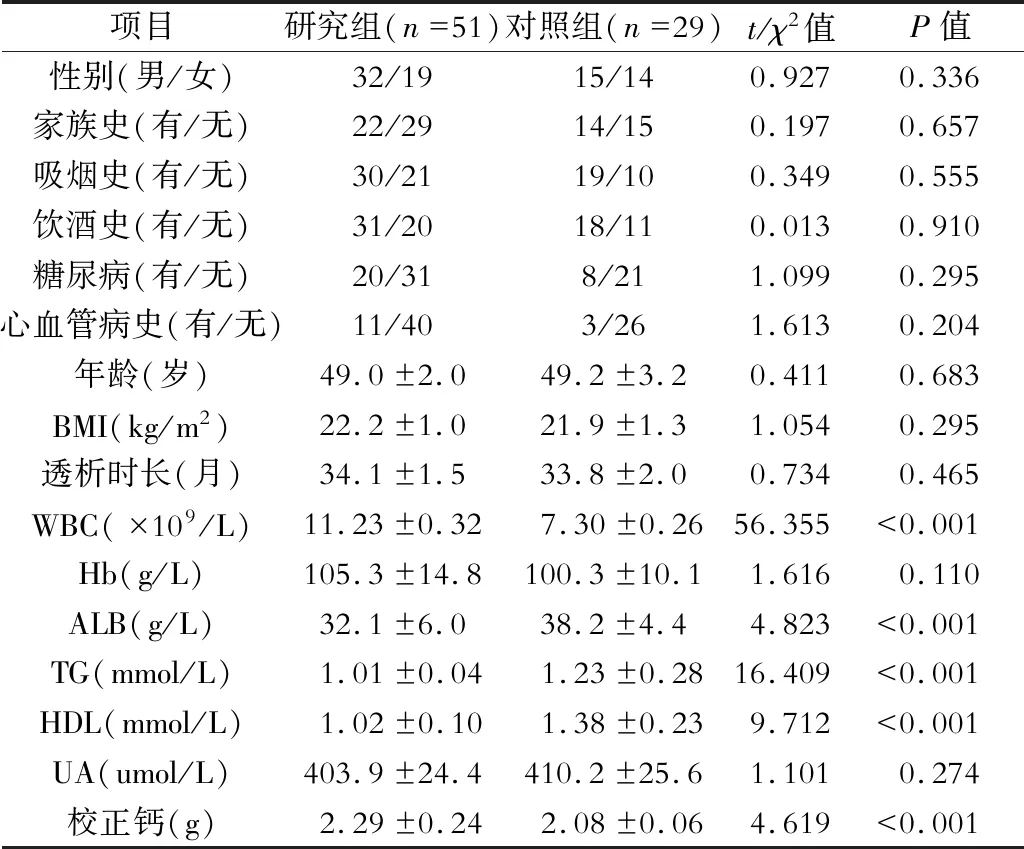
表1 研究组和对照组一般资料比较
注:BMI:体质量指数;WBC:白细胞计数;Hb:血红蛋白;ALB:白蛋白;TG:三酰甘油;HDL:高密度酯蛋白;uA:尿酸
二、研究组和对照组hs-CRP、NLR、PLR比较
研究组hs-CRP、NLR、PLR高于对照组(P<0.05)。(表2)

表2 研究组和对照组hs-CRP、NLR、PLR比较
注:hs-CRP:超敏C反应蛋白;NLR:中性粒细胞/淋巴细胞比值;PLR:血小板淋巴细胞比值
三、轻度、中度、重度钙化组hs-CRP、NLR、PLR比较
采用单因素方差分析,3组hs-CRP、NLR、PLR差异有统计学意义(P<0.05);进一步两两比较,重度钙化组hs-CRP、NLR、PLR水平高于中度钙化组高于轻度钙化组(P<0.05);hs-CRP、NLR、PLR与钙化程度呈显著正相关关系(P<0.05)。(表3、图1)

表3 不同程度钙化组hs-CRP、NLR、PLR比较
注:hs-CRP:超敏C反应蛋白;NLR:中性粒细胞/淋巴细胞比值;PLR:血小板淋巴细胞比值
四、心脏瓣膜钙化发生的多因素logistic回归分析
hs-CRP、NLR、PLR是心脏瓣膜钙化发病危险因素 (P<0.05);WBC、ALB、TG、HDL、校正钙不是心脏瓣膜钙化发病高危因素(P>0.05)。(表4)
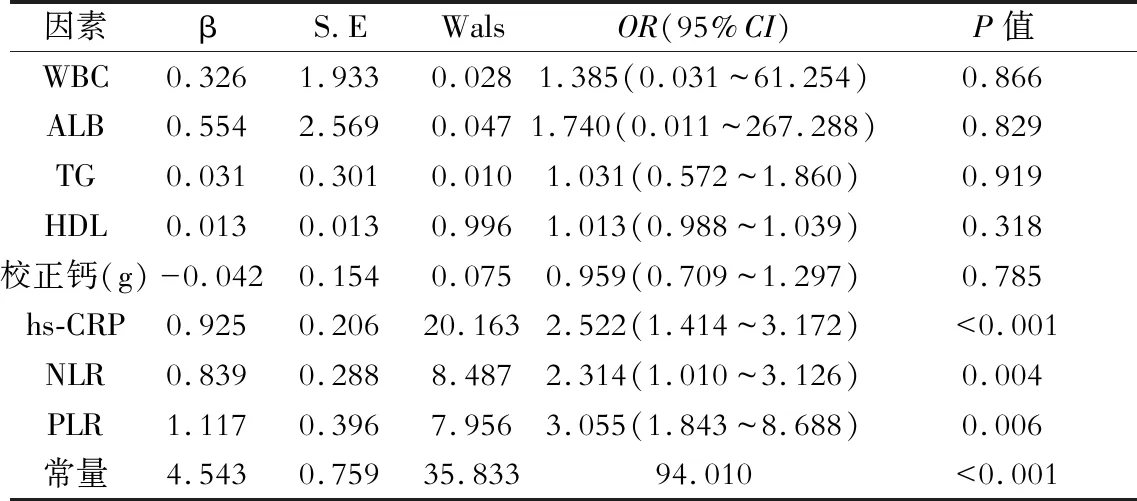
表4 发生心脏瓣膜钙化多因素logistic回归分析
注:WBC:白细胞计数;ALB:白蛋白;TG:三酰甘油;HDL:高密度酯蛋白;hs-CRP:超敏C反应蛋白;NLR:中性粒细胞/淋巴细胞比值;PLR:血小板淋巴细胞比值
讨 论
流行病学显示,心脏瓣膜钙化发病率逐年增多,其随年龄增长而增高,多见于60~65岁以上老年人[4]。使用常规影像学检查具有检测方便、微创且重复性高的特点,在心脏瓣膜钙化中已取得广泛[5]。近年来,随着分子学和免疫学研究水平提高,Liu等人[6]研究显示,找出特异性更强的心脏瓣膜钙化标志物对减少机体损伤、提高诊断效率有较高价值。
周围血常规是临床最常用化验检查方法,机体发生钙化后各种血细胞数量迅速上调或下降,可通过血清学检查诊断心脏瓣膜钙化。hs-CRP、NLR、PLR已被证实在肿瘤及各种类型心脏病中可判断系统性炎症,且与疾病发生和发展有关[7]。本研究在探讨MHD患者心脏瓣膜钙化相关血清因子中发现,NLR、PLR高于无钙化组,提示NLR、PLR可作为评价有无钙化新指标。考虑该结果与心脏具有独特快速再生能力,可避免心功能急性损伤或心脏细胞死亡有关。这意味着在慢性持续性损伤情况下,驱动再生分子机制对延缓钙化进展有重要价值。进一步分析血清指标与临床相关性可得,hs-CRP是区分低水平炎症状态敏感指标,与动脉粥样硬化和脑梗死发生、严重程度及预后密切相关。Han等人[8]的研究显示,hs-CRP是诱导机体局部炎性反应重要介质,其值异常升高是心衰发生的重要危险因素,而心衰与心脏瓣膜钙化具有相关性。另李小莉等[9]研究指出,高度钙化患者体内hs-CRP水平显著高于轻度钙化患者,考虑其具有一定判断价值。张国娟等[10]分析血管钙化积分的研究显示,腹主动脉重度钙化组NLR、PLR水平升高更显著,提示与钙化严重程度有关,且可能与严重程度呈正相关。本研究中NLR、PLR与钙化严重程度相关性与上述文献较为一致,考虑NLR、PLR为反馈炎性因子通路一部分,通过正反馈来加快钙化进展。另炎性因子通路激活剂在钙化组织中超表达时发挥着保护血管和抵抗钙化的价值,这已在陈艳红等[11]大鼠模型试验结果中得到证实,陈艳红等学者指出由于在晚期检测到NLR、PLR在钙化模型中过度表达,对防御机制和血管壁钙化均有恶化作用。
临床数据也证实,炎症反应可提高早期心脏细胞周期异常调控和基因异常转录,进一步说明炎症指标对钙化预测价值较高[12]。有学者指出肝肾疾病存在炎症反应,中性粒细胞、WBC、淋巴细胞可参与钙化过程[13]。另有文献显示,NLR、PLR在MHD患者中的上升与是否钙化呈显著正相关关系,直接影响术后心血管疾病发生和发展[14]。且在Omran A等人[15]文献中发现,NLR、PLR与hs-CRP存在正相关关系,说明其协同作用。本研究通过探讨hs-CRP、NLR、PLR与临床特征及钙化程度相关性建立特异性更高的判断指标,结果显示低钙化患者hs-CRP、NLR、PLR水平显著低于中分化低于高分化,且各指标水平与分化程度均呈正相关,进一步说明病情发展与这些指标相关。另hs-CRP、NLR、PLR与临床症状呈相关性,提示对hs-CRP、NLR、PLR水平的检测可直接反映临床症状,与诊断有一定关系。随后对心脏瓣膜钙化发生相关危险因素进行分析发现血清指标hs-CRP、NLR、PLR为其危险因素,说明其预测价值,且是预测该病敏感指标。
本研究结果与既往糖尿病、老龄、透析时间是瓣膜钙化危险因素不一致[16],考虑与本研究样本量少有关。既往资料多显示华法林及钙的使用可影响瓣膜钙化法的发生,但由于华法林用药特殊性且用于透析合并房颤的病例较少,无法排除药物使用的误差性,因此本研究排除了华法林使用者。在许多研究中曾提出ALB为瓣膜钙化危险因素,主要与患者营养不良有关。ALB一般与总胆固醇及TG呈显著负相关,因此ALB的升高直接导致心脏瓣膜钙化。本研究结果显示ALB不是心脏瓣膜钙化发病高危因素,可能与本研究选择的患者BMI这一基线资料无显著差异有关。
综上,hs-CRP、NLR、PLR与MHD患者心脏瓣膜钙化有显著相关性,早期关注hs-CRP、NLR、PLR变化可降低钙化发生率,提高患者生存质量。

