乙醇-乌头碱致心律失常的毒理分子机制研究进展
潘美辰,周小伟,刘艳,王宇宁,邱鑫罡,吴士凡,刘茜
(1.华中科技大学同济医学院法医学系,湖北 武汉 430030;2.湖北崇新司法鉴定中心,湖北 武汉 430403)
乌头属植物作为广泛使用的中草药代表之一,具有祛风除湿、温经止痛等药理功效[1]。民间有用草乌、川乌泡酒,或在烹饪食物时添加草乌、附片等食疗习惯。但乌头属植物大多全株有毒,乌头碱是乌头属植物最主要的毒性成分,主要作用于心和神经系统,引起多种心律失常而导致死亡[2]。其治疗剂量与中毒或致死剂量较为接近,是具有药用价值的有毒植物的典型代表[2]。0.2 mg乌头碱口服即可中毒,3~5 mg口服即可致死,使用过程中因药物耐受性的个体差异、用法不当或误服、故意投毒等原因,易引起中毒和死亡[3]。
法医学实践中常遇到乌头类药酒引起的中毒案例。LIU等[4]报道的7例乌头碱中毒死亡的案件中,6例是饮用含乌头类药材的药酒引起的中毒。乙醇的主要毒性机制是抑制中枢神经系统,但近年来,乙醇对心脏电生理和离子通道功能影响的研究也日渐增多。研究结果[5]表明,急性摄入乙醇可引起心律失常。乌头碱与乙醇联合摄入,两者是否对心脏产生直接的毒性作用,以及毒性相互作用机制等问题值得深入研究。
本文通过综述近年来乙醇及乌头碱心脏毒性机制的研究报道,分析讨论其心脏分子毒性作用的共同机制,为进一步探索乙醇-乌头碱致心律失常分子毒理学机理的研究提供参考。
1 乌头碱、乙醇分别致心律失常的毒理机制研究现状
早期研究[3]发现,乌头碱可兴奋迷走神经,引起窦房结抑制,使心肌内异位节律点兴奋性增强;还可激活下丘脑的腹内侧核导致心动过缓[2],产生各种心律失常;更重要的是使心肌细胞膜钠离子(Na+)通道持续去极化[6]。近年来,乌头碱对心肌细胞钙离子(Ca2+)通道的影响逐渐被重视,且成为乌头碱致心律失常分子机制的研究热点。
适量与高剂量的乙醇均可诱发心律失常,最著名的与乙醇相关性的心律失常是“假日心脏综合征”[7]。近年来,乙醇致心律失常的分子机制研究正逐渐增多。
1.1 细胞膜电压门控型Na+通道
电压门控型Na+通道位于心肌细胞膜上,负责动作电位的产生。乌头碱抑制Na+通道的失活,延长通道的开放时间造成膜的持续去极化[8-9]和钠超载,钠超载引起延迟后去极化(delayed after-depolarization,DAD),DAD可诱导产生异常性的节律紊乱和(或)触发性恶性心律失常[10]。KLEIN等[7]采用细胞贴附膜片钳技术发现乙醇对心肌Na+通道具有急性抑制作用并呈浓度依赖性,主要通过减少钠通道的开放率和可用性来降低细胞内Na+浓度。这一结果与BEBAROVA等[11]报道的乙醇对Na+通道的影响相似。
1.2 心肌细胞内Ca2+通道
1.2.1 心肌细胞内钙平衡调节及其在心律失常中的作用
Ca2+是引发心肌收缩的直接激活剂,是心肌细胞兴奋收缩偶联的介质。细胞内钙平衡需特殊的钙结合蛋白严格调控。胞外Ca2+主要通过L-型Ca2+通道(L-type calcium channel,LTCC)和 Na+-Ca2+交换器(Na+-Ca2+exchanger,NCX)进入胞内,内向钙电流再刺激肌质网中Ca2+通过肌质网兰尼碱受体2(ryanodine receptor,RyR2)释放到胞浆中,产生“钙促钙释放”的级联放大效应,内流的Ca2+激活RyR2通道,产生肌质网中Ca2+的同步释放,这一过程被称为钙火花。去极化过程中许多钙火花的同步出现将导致整个细胞的钙瞬变。这一过程将产生足量的Ca2+引起心肌的收缩。心肌舒张时RyR2通道关闭,肌质网膜上的肌质网Ca2+-ATP酶(sarcoplasmic reticulum calcium ATPase,SERCA2)在受磷蛋白(phospholamban,PLB)的调节下将Ca2+重吸收回肌质网,同时胞膜上的NCX 将Ca2+排出胞外,使胞浆内的Ca2+水平迅速回复[12]。心肌细胞内Ca2+浓度在钙调控蛋白的作用下保持动态平衡的过程[13](图1)。随着研究深入,人们逐渐认识到钙平衡紊乱在心律失常病因中的重要性。心肌细胞内Ca2+调控的紊乱,尤其是产生钙瞬变的蛋白调控发生紊乱是心律失常的重要原因。
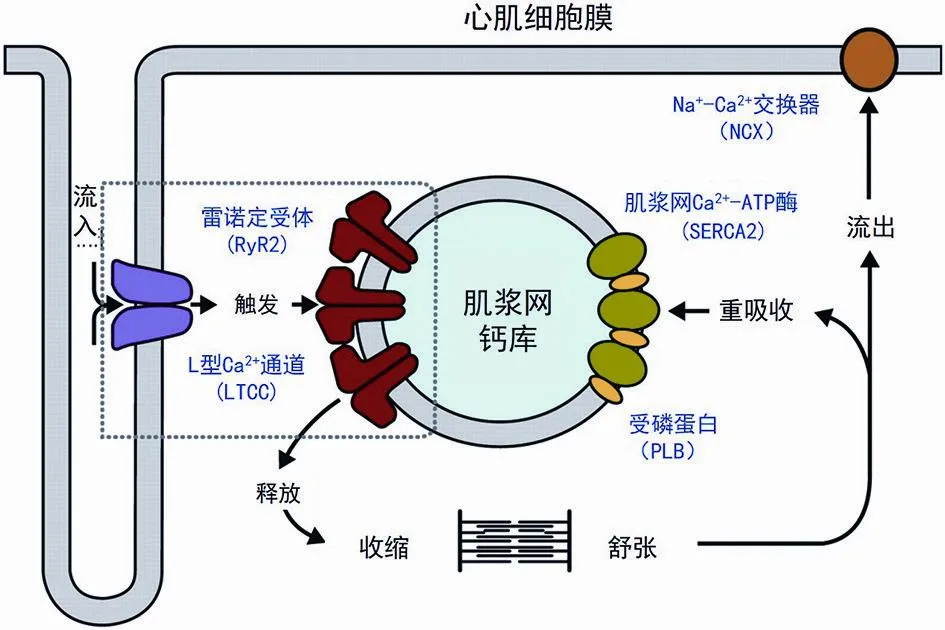
图1 心肌细胞内Ca2+循环示意图[13]Fig.1 Schematic diagram of Ca2+circulation in cardiomyocytes
1.2.2 乌头碱、乙醇对心肌细胞Ca2+平衡的影响
FU等[14]建立的用小干扰RNA(small interfering RNA,SiRNA)下调RyR2表达的心肌细胞模型中,正常的细胞显示平稳周期性的钙振荡,钙离子电流基线保持低水平。乌头碱染毒后出现心肌细胞钙振荡振幅降低,典型的钙火花尖峰消失[14-16],提示钙信号的改变在乌头碱致心律失常的病理过程中起着关键作用。急性乙醇染毒后心肌细胞内Ca2+瞬变下降且呈浓度依赖性[17]。
SUN等[18]发现,在大鼠心室肌细胞中,乌头碱显著加重Ca2+超载并引起心律失常,说明Ca2+超载在心律失常的发病机制中发挥重要作用。在心肌细胞内LTCC的调节下,1μmol与6.6μmol乌头碱染毒后[19-20]分别出现对LTCC的促进作用与抑制作用。而不同浓度的乌头碱染毒后均出现RyR2、NCX蛋白的表达上调,SERCA2a的表达下调,进而使胞质内Ca2+浓度升高,导致心律失常[14,19,21]。
乙醇通过Ca2+渗漏发挥心肌毒性[5]。乙醇抑制LTCC的活性,通过加速LTCC的失活来实现[11]。不同浓度的乙醇表现出对钙通道蛋白的不同作用,MUSTROPH等[5]发现1‰、3‰和6‰乙醇溶液均通过RyR2增加了心肌肌质网的Ca2+渗漏,同时乙醇还增强了NCX及SERCA2的活性。但50 mmol乙醇却抑制RyR2的活性,进而明显降低心肌细胞内钙火花频率[22]。LI等[23]用4%乙醇溶液处理野生型FVB小鼠,发现SERCA2a、NCX和PLB表达量均下调。
1.3 心肌细胞其他通道蛋白
乌头碱[24]与乙醇[11]对瞬时外向钾离子(K+)电流(transient outward K+current,Ito)均表现出抑制作用。此外,乌头碱亦抑制心肌细胞中的超快速延迟整流K+电流[8](ultra-rapid delayed rectifier K+current,IKur),使复极时间延长,增加后除极化的发生率,引起心律失常。乙醇表现为双重抑制内向整流钾电流(inward rectifier K+current,IK1),在浓度≤2mmol/L时表现为抑制,浓度≥8 mmol/L时表现为激活作用[17]。ZHANG等[16,25]研究结果发现,乌头碱对心肌细胞缝隙连接蛋白connexin 43(Cx43)的总量并不产生影响,而是通过影响其磷酸化状态(诱发其脱磷酸化)发挥作用。HUNG等[26]发现,4%和6%乙醇溶液干预组的小鼠心肌细胞中Cx43表达均下调。
2 乙醇-乌头碱致心律失常的毒理机制研究进展
KURITA等[27]将0.6 mL 96%乙醇溶液直接注射到17只由1.0 μg乌头碱诱导的室性心动过速(ventricular tachycardia,VF)的实验狗心肌内,15只恢复了正常窦性节律。在另外13只乌头碱诱导的VF狗中,注射2.0 mL 96%乙醇溶液,7只恢复正常的窦性心律,其余6只狗死于VF。由此可见,随着乙醇浓度的增高,与乌头碱的拮抗作用变弱,但这种拮抗作用的具体机制如何,未进行探索。GAO等[28]通过心电图检测发现,在乌头碱诱导的心律失常模型中,低浓度乙醇(0.4 g/kg)与乌头碱表现为拮抗作用,减少室性心律失常的发生,而中、高浓度乙醇(0.8g/kg和1.6g/kg)与乌头碱则表现为协同作用,加重心律失常的发生。GAO等[28]认为,0.4 g/kg乙醇与乌头碱表现出拮抗作用,可能是由于心肌细胞中乙醇诱导的Na+电流减少所致,而高剂量乙醇的致心律失常作用可能涉及更复杂的机制。
李浩然[29]发现乌头碱-乙醇共同干预的原代大鼠心室肌细胞钙振荡改变较乌头碱单独干预组更明显,Ca2+振幅变小,典型的钙火花消失。乌头碱及乙醇可能通过协同作用影响钙通道,使得心肌细胞内钙振荡改变。前期研究结果[30]显示,乙醇与乌头碱联合干预对大鼠心室肌细胞RyR2蛋白表达的影响,发现单纯(1 μmol)乌头碱干预与不同浓度乙醇与乌头碱联合干预均使RyR2蛋白含量升高,但与单一乌头碱干预组比较,低、中浓度(5、50mmol/L)乙醇与乌头碱表现为拮抗作用,但中等浓度的拮抗作用较弱;而高浓度(100 mmol/L)乙醇与乌头碱联合干预组与单独乌头碱干预组RyR2含量无统计学差异。联合干预时对心肌细胞的影响并非简单的协同或拮抗效应,可能因乙醇浓度而异,在对心肌RyR2的影响上,低浓度乙醇对乌头碱引起RyR2含量增加有拮抗作用,随着乙醇浓度逐渐升高,这种拮抗作用逐渐减弱,且有向协同作用转化的趋势。这一联合作用与YE等[22]报道的乙醇单独影响RyR2的趋势较相似。
综上所述,目前乙醇和乌头碱分别对钠通道、部分钙通道(LTCC、RyR2、NCX)影响的研究较多,而对PLB、SERCA及钾通道的研究相对较少。现有的研究多集中在对心肌细胞内通道蛋白量的测定上,对其功能状态及上游调控机制的研究较少(心肌细胞内的通道蛋白含量不能完全作为整体结构和功能改变的衡量标准,蛋白激酶依赖的磷酸化状态是心肌细胞钙调控蛋白活性调节的重要机制)。此外,乙醇-乌头碱联合作用对心脏毒理分子机制的研究逐渐增多,联合染毒效应因乙醇浓度不同而异。
乌头碱与乙醇联合作用对心肌的毒性效应及具体机制方面的研究正逐渐增多,从电生理和分子水平揭示两者对心肌细胞毒性作用的内在相互关系有助于了解并阐述在法医病理学实践中遇到的乌头类酒精中毒死亡的机制,亦为酒-药联合中毒的防治及临床制药的解读提供理论依据。笔者认为,乙醇-乌头碱联合染毒时对心肌细胞的影响,并非单纯协同或拮抗作用,可能因乙醇与乌头碱的浓度不同而异,这一现象及其机制值得更深入地探索。在今后的研究中,可关注联合染毒对钙通道(如PLB、SERCA)以及钾通道的影响,从通道蛋白功能状态及其上游调节机制方面进行更全面细致的研究。

