GC-MS衍生化方法快速检测生物样品中的氨
(中国医科大学法医学院,辽宁 沈阳 110122)
以血氨为代表的生物样品中的氨是非蛋白氮重要的化学表现形式,蛋白质代谢过程中产生含氮废料在肝中通过鸟氨酸循环(尿素循环)合成尿素后由肾排出,在这一过程中会有少量的氨生成,构成了体内氨的正常值本底[1]。在意外摄入大量氨时也通过形成尿素的形式进行解毒。因此,在临床检验中血氨和尿素氮一直作为评价肝肾功能的重要指标。在法医学领域,血氨同样可以用来评价生前的肝功能状况辅助确定死亡原因,严重肝坏死的个体血氨值明显超过正常值。
此外,如果口服大量尿素可以在胃肠道细菌作用下产生氨,吸收入血后引起中毒。一些反刍类动物常常因此中毒死亡[2]。尿素是反刍畜类(牛、羊、骆驼等)动物良好的氮源饲料添加剂。这些反刍食草动物的胃和肠道内具有特殊微生物可分解尿素形成氨,并能够利用氨作为自身蛋白质的氮源[3]。这些微生物可分解人类不能分解的植物纤维素为单糖。然而,过量添加尿素可以产生过量的氨和二氧化碳,引起中毒死亡。最近几年,因尿素过量而导致牛、羊等家畜死亡的意外事件时有发生[4-5]。但关于偶蹄类反刍畜类的氨中毒数据甚少。本研究探讨了用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)衍生化技术对生物样品中的氨进行快速检测的方法。
1 材料与方法
1.1 仪器与试剂
Agilent 7890B-5977A气相色谱-质谱联用仪(美国Agilent公司);HP-5ms(30m×0.25mm,0.25μm)弹性石英毛细管柱;IKA®VORTEX 2涡旋混匀器(德国IKA公司);TG16K-Ⅱ高速离心机(长沙东旺实验仪器有限公司)。
衍生化试剂七氟丁酰氯(98%,美国Sigma公司)。氨标准溶液(批次编号:104210;质量浓度为500μg/mL;中国环境保护部标准样品研究所)。提取溶剂乙酸乙酯等有机溶剂均为色谱纯试剂。二次除氨去离子水(美国Agilent公司)。
1.2 气相色谱-质谱条件
气相色谱条件:采用HP-5ms(30 m×0.25 mm,0.25μm)弹性石英毛细管柱。采用程序升温:初始柱温为60℃,保持1 min,以20℃/min升温至260℃,保持15 min,共计运行26 min。进样口温度为265℃,不分流进样1μL。载气为高纯氦气(99.9%),流速为1.0mL/min。
质谱条件:采用电子离子轰击源(EI源,70 eV),离子源温度为230℃,四极杆温度为150℃,SIM扫描方式,以m/z166为定量离子,溶剂延迟3min。
1.3 标准样品的配制
吸取适量标准氨溶液于100mL容量瓶中,用二次去离子水分别稀释,制作质量浓度为0.005~2 mg/mL的标准氨溶液。
1.4 生物样品处理
精密称取生物样品全血0.5 mL或牛瘤胃内容物0.5 g于10 mL试管中,加入1 mol/L的NaOH溶液0.5mL。加入七氟丁酰氯衍生化试剂10μL。漩涡振荡30s后,功率800W微波反应1min。加入乙酸乙酯2.0mL振荡1min,1000×g离心10min,用移液器取出1.5mL上清液至2mL的微量离心管中,浓缩至0.1mL体积后进GC-MS检测分析。
1.5 方法学验证
1.5.1 专属性试验
取正常人新鲜静脉血0.5 mL以及添加氨标准液至质量浓度为0.5μg/mL的标准添加血浆样品0.5mL于10 mL试管中,按照“1.4生物样品处理”方法进行处理后,用GC-MS分析,进行专属性考察。
1.5.2 线性与范围
经向0.5mL正常人新鲜静脉血中添加氨标准液,制备质量浓度范围在0.5~200.0μg/mL的标准曲线血浆样品,按照“1.4生物样品处理”方法进行处理后,用GC-MS分析,记录m/z166衍生化产物离子峰面积。
1.5.3 精密度试验
取正常人新鲜静脉血0.5mL于10mL试管中,向其中添加氨标准液,制备血氨质量浓度分别为1.0、50.0和200.0 μg/mL的标准添加样品,每个浓度5份,按照“1.4生物样品处理”方法进行处理后,用GC-MS分析,进行日内日间精密度考察。
1.6 衍生化条件考察
1.6.1 衍生化pH值考察
取6份正常人新鲜静脉血各0.5 mL于10 mL试管中,向其中添加氨标准液,制备血氨质量浓度为20.0 μg/mL的标准添加样品。分别加入pH值为9、10、11、12、13、14的NaOH溶液0.5 mL。余步骤按照“1.4生物样品处理”方法进行处理后,用GC-MS分析,记录衍生化产物的峰面积。
1.6.2 衍生化振荡时间考察
取5份正常人新鲜静脉血各0.5 mL于10 mL试管中,向其中添加氨标准液,制备血氨质量浓度为20.0 μg/mL的标准添加样品。分别加入1 mol/L的NaOH溶液0.5mL,加入七氟丁酰氯衍生化试剂10μL。分别漩涡振荡 0.5、1、5、10、20 min后。余步骤按照“1.4生物样品处理”方法进行处理后,用GC-MS分析,记录衍生化产物的峰面积。
1.6.3 衍生化微波反应时间考察
取5份正常人新鲜静脉血各0.5 mL于10 mL试管中,向其中添加氨标准液,制备血氨质量浓度为20.0 μg/mL的标准添加样品。分别加入1 mol/L的NaOH溶液0.5mL,加入七氟丁酰氯衍生化试剂10μL。漩涡振荡30s后,使用功率800W进行微波反应,分别考察反应时间1、2、3、4、5min。剩余步骤按照“1.4生物样品处理”方法进行处理后,用GC-MS分析,记录衍生化产物的峰面积。
2 结果与讨论
2.1 七氟丁酰化的衍生化产物
氨在碱性条件下与七氟丁酰氯发生酰化反应,形成七氟丁酰胺目标产物。在反应机制上属于亲核取代反应。氨的N原子作为亲核试剂进攻七氟丁酰氯的羰基。生成的HCl被NaOH中和。衍生化试剂脂肪链上的F有助于羰基正碳离子的形成(图1)。
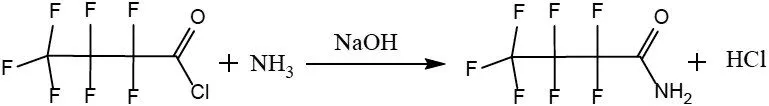
图1 七氟丁酰氯与氨的反应式Fig.1 The reaction formula of heptafluorobutyryl chloride and ammonia
生成物性质稳定,极性较小,具有良好的色谱行为。保留时间3.25min,特征离子为m/z214(分子离子峰)、m/z194、m/z166、m/z146、m/z100、m/z69和m/z44(基峰),其中m/z166为定量离子。该产物质谱图(图2)与美国国家标准与技术研究所(National Institute of Standards and Technology,NIST)质谱库[6]中七氟丁酰胺谱图基本一致。
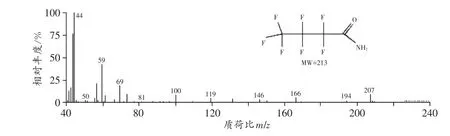
图2 氨的七氟丁酰化的质谱图Fig.2 Mass spectrum of heptafluorobutyrylation of ammonia
2.2 方法学验证
2.2.1 专属性试验
专属性试验结果表明,在上述试验条件下内源性物质不干扰血氨的检测。
2.2.2 线性与范围
以血氨质量浓度(x)为横坐标,衍生化产物峰面积(y)为纵坐标,得到标准曲线回归方程:
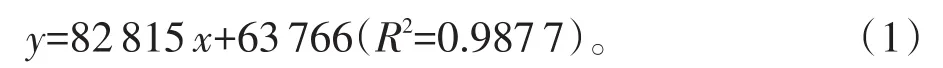
如图3所示,在0.5~200.0 μg/mL范围内获得了良好的线性关系。定量限为0.5 μg/mL,检出限为0.1μg/mL。
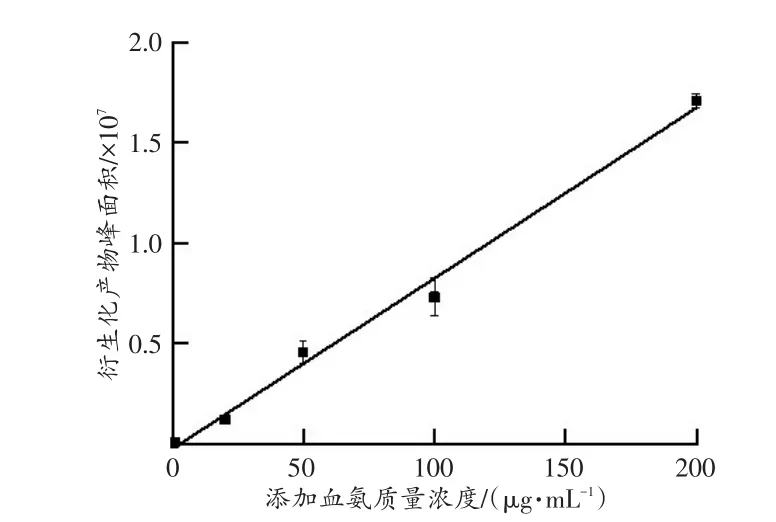
图3 血中添加氨的标准曲线Fig.3 Standard curve of additive ammonia in blood
2.2.3 精密度试验
试验结果经计算,日内精密度相对标准偏差(relative standard deviation,RSD)范围 2.59%~3.88%,日间精密度RSD范围3.21%~3.76%,该方法精密度符合要求(表1)。
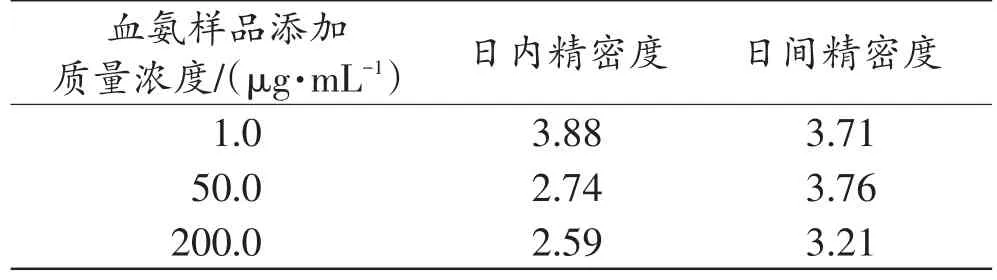
表1 血氨样品的精密度实验Tab.1 Precision experiment of blood ammonia sample(n=5,%)
2.3 衍生化反应条件优化
2.3.1 衍生化pH值考察
酰氯和胺反应生成酰胺,需要在碱性条件下进行,产物中生成氯化氢,加入缚酸剂可提高反应效率,本研究对pH=9以上的碱性条件进行了考察。结果表明,随着反应体系pH的升高,衍生化产物峰面积随之升高,1mol/L的NaOH溶液(pH=14)最有助于产物的稳定(表2)。
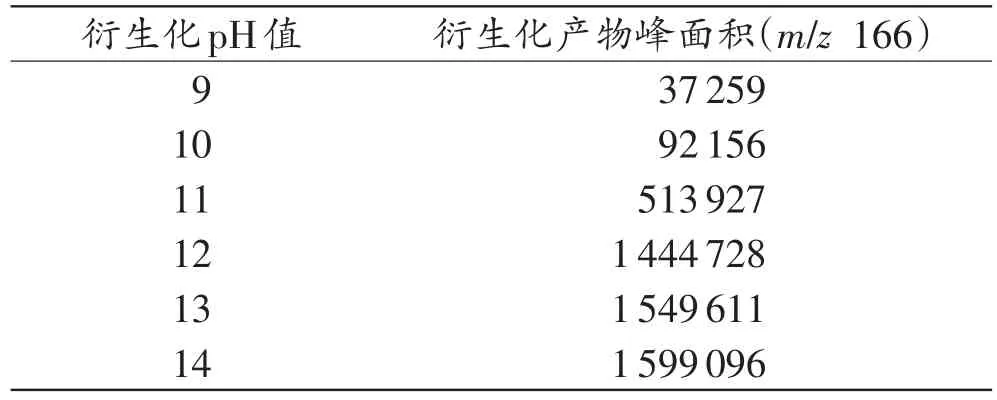
表2 衍生化pH值考察Tab.2 Study on pH value of derivatization
2.3.2 衍生化振荡时间考察
衍生化反应通常预留出一定的反应时间,加入衍生化试剂后随即进行下一步操作的情况并不多见。本研究对20min以内的衍生化时间进程进行了考察,并没发现衍生化产物峰面积明显提高(表3)。因此,默认为衍生化反应是瞬间完成的。选择涡旋振荡30s作为衍生化振荡时间。

表3 衍生化振荡时间考察Tab.3 Study on the oscillation time of derivatization
2.3.3 衍生化微波反应时间考察
衍生化产物的峰面积见表4。微波反应时间的延长并未提高衍生化产物的产率,为节省反应能源,缩短反应时间,选择功率800W,反应时间1min作为微波反应条件。
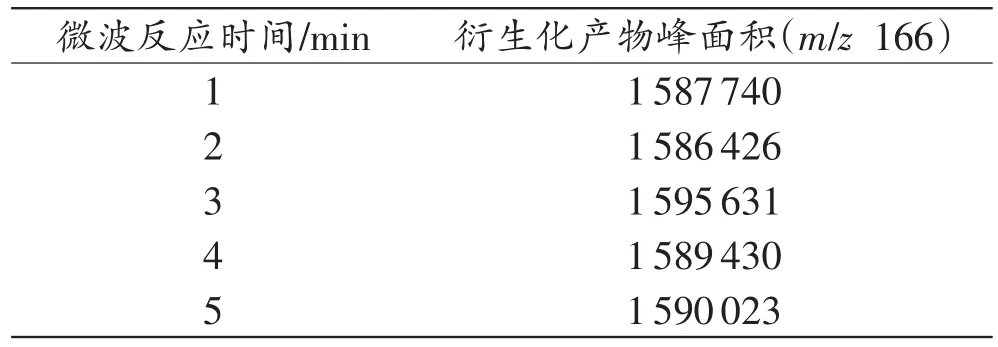
表4 衍生化微波反应时间考察Tab.4 Study on microwave reaction time of derivatization
2.3.4 衍生化反应试剂的选择
近些年绿色化学理念逐步兴起,以往大量使用的高挥发性高毒性苯类和烷烃类有机提取溶剂逐渐淡出实验室,转变为应用少量的酯类有机溶剂进行提取。在非衍生化的毒物筛查提取的场合,乙酸乙酯的使用频率逐渐增加。氨或七氟丁酰胺理论上可以与乙酸乙酯发生氨解反应生成乙酰胺,但是反应产物图谱中并未见乙酰胺的色谱和质谱峰。综合分析,仍然沿用常见毒物筛查使用的乙酸乙酯作为提取溶剂。
2.4 本方法的临床和法医学应用
血氨和尿氨是临床评价非蛋白氮的重要指标之一。人血氨浓度的正常值范围比尿素氮(尿素)低得多,为18~72 μmol/L[7]。换算成法医毒物分析常用质量单位为306~1 224 ng/mL,上限即约为1.22 μg/mL。肝昏迷患者的血氨值会大幅度突破上限。临床上检测氨是依据光谱学原理,要求静脉血新鲜且不能溶血。本方法可以作为临床现有方法的补充或佐证。在法医毒物分析领域中可以追溯死者生前的肝肾功能状况,辅助确证死亡原因。
2.5 本方法在畜类生物样品中的应用
目前,牛、羊等家畜尿素中毒死亡的案件量明显上升。大型哺乳动物与人类有相似的尿素循环通路,尿素循环是以合成和排泄尿素为主的,尿素进入牛的瘤胃后,其中微生物群产生的脲酶将其分解为氨和二氧化碳,部分氨经瘤胃、网胃壁吸收,再经肝形成尿素,随尿液排出体外,或返回瘤胃或分泌于唾液中去。部分氨转化为氨基酸,进而合成菌体蛋白质,作为自身消化、吸收和利用的蛋白质来源。当尿素超量,分解成氨的速度加快,导致氨在瘤胃内大量蓄积,而被吸收进入血液,即可发生氨中毒,导致机体的器质和功能性损伤[8]。有文献[9]报道:牛血氨正常值约为6μg/mL,空腹瘤胃内容物氨含量约为75μg/g;氨中毒时血氨含量可达10μg/mL,瘤胃内容物中氨含量可达700~1 000 μg/g,若同时瘤胃内容物pH值大于8即可确诊。
案例应用:2016年4月,辽宁某县发生农户家养黄牛不明原因死亡案件。经过当地兽医检查后将其血液委托我鉴定中心进行毒物检测。经血液生化检测,测得牛血清尿素含量为16 mmol/L。应用本文方法测得牛血氨为91μg/mL,确定该牛为氨中毒。
综上所述,在临床检验中血氨一直是评价肝肾功能的常规检测项目。然而,由于临床的检验方法均是以光谱法为基础的,在遇到血液样品溶血、结块,形态复杂时,或胃内容物等复杂的生物基质时容易引入误差。因此,有必要开发测定血氨和生物样品中氨的GC-MS方法。用色谱法测定氨,早期是应用分子筛等填充柱的吸附色谱方法,但由于氨为气体,极性强,在柱内严重扩散达不到相应的最低检测限[10]。本研究尝试了在样品中直接用七氟丁酰氯衍生化后经过常规提取进行氨的快速检测,对临床检测血氨和毒物分析领域中确定死者生前的肝功能状况及反刍偶蹄类动物(牛、羊和骆驼等)的氨中毒鉴定具有重要意义。

