Marc-145细胞低血清适应培养传代稳定性和无血清驯化研究
阿尔祖古丽·阿依丁,卢美琳,李自良,贺丹,乔自林,阿依木古丽·阿不都热依木,*
(西北民族大学 a.生物医学研究中心 甘肃省动物细胞技术创新中心; b.生命科学与工程学院,甘肃 兰州 730030)
猪繁殖和呼吸障碍综合征(porcine reproductive and respiratory syndrome,PRRS),俗称蓝耳病,1987年在美国首次发现[1],2006年在我国首次爆发,给养猪业带来了极大的经济损失[2]。PRRS是由猪繁殖和呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)所引起的一种接触性传染病,主要侵害猪的呼吸系统和繁殖系统。猪被病毒感染后,先在局部易感巨噬细胞中复制,然后迅速向全身淋巴线组织和在肺部扩散。大约一周左右,猪出现高烧不退、腹泻等,怀孕母猪染病后易流产、早产,产死胎[3-5]。疫苗免疫是PRRS主要的预防措施。以哺乳动物细胞作为病毒增殖的基质生产疫苗,具有重复性高、生产稳定、抗原特异性更接近自然株、变态反应少等优势[6]。
Marc-145细胞属于恒河猴肾细胞系,是目前PRRSV体外增殖的最主要宿主细胞,是最适用于生产PRRSV疫苗的细胞[7]。目前,国内外PRRS疫苗生产时,常采用贴壁培养的Marc-145细胞增殖病毒,这种培养模式难以满足大规模疫苗用细胞生产的需求[8]。许多疫苗生产用宿主细胞都实现了大规模、无血清悬浮培养,治疗性抗体的发展极大地推动了生物反应器在生物制药行业中的应用[9-10]。无血清悬浮培养细胞不仅降低了生产成本,也降低了疫苗产品下游分离纯化的难度,可保证疫苗产品的质量稳定。因此,Marc-145细胞的大规模悬浮培养具有很大的发展前景。Marc-145细胞属于上皮细胞,具有极强的贴壁依赖性,因此对无血清培养条件的适应需要一定的驯化传代过程。本试验通过缓降培养液中血清浓度的方法驯化Marc-145细胞,对传代和驯化过程中的P10、P20、P30、P40、P50代细胞的形态、倍增时间、生长曲线、染色体和对PRRSV敏感性等特性进行对比分析,并将细胞驯化成无血清悬浮细胞,分析驯化传代对细胞特性的影响,旨在为大规模无血清生产蓝耳病病毒疫苗提供可靠的依据。
1 材料与方法
1.1 试验材料
Marc-145细胞,由甘肃省动物细胞技术创新中心提供;PRRSV株,由百灵生物科技有限公司提供。DMEM培养基、0.25%胰蛋白酶、细胞悬浮培养基,购自百灵生物科技有限公司;新生牛血清(newborn bovine serum,NBS),购自兰州民海生物科技有限公司;SDS-PAGE试剂盒,购自北京索莱宝科技有限公司。
1.2 仪器设备
CK40-32PH倒置相差显微镜,日本奥林巴斯;C02培养箱,美国Thermo Scientific;CASY细胞计数仪,德国INNOVATIS公司;WSZ-100A回旋振荡器,上海一恒科学仪器有限公司。
1.3 试验方法
1.3.1 Marc-145细胞复苏
将细胞冻存管从液氮罐中取出,置于37 ℃水浴,常温1 000 r·min-1离心5 min,去除上清后用少量细胞生长液重悬细胞,并转入细胞培养瓶中,加入15 mL细胞生长液,于37 ℃、5% CO2培养箱中静置培养。待细胞长成单层后,用0.25%胰蛋白酶消化液消化,并进行传代培养。
1.3.2 Marc-145细胞低浓度血清适应及驯化
采用逐步降血清的方法驯化Marc-145细胞以适应低浓度血清培养。在含有10% NBS的DMEM培养液中稳定生长的Marc-145细胞培养至P10代时,更换其培养液为含有8% NBS的DMEM培养液,连续传代3代后,更换其培养基为含有6% NBS的DMEM培养液,连续传代3代后,更换其培养基为含有3% NBS的DMEM培养液。3~4 d可做1次传代操作。Marc-145细胞在含3% NBS的DEME培养液中存活率维持在95%以上,并保持正常的贴壁性能和较快的生长速度,可做进一步降血清驯化培养。将培养液中血清浓度降低至3%的细胞株连续传代到P20、P30、P40和P50代,冻存。
1.3.3 Marc-145细胞生长曲线绘制
10%血清培养的P10细胞株和3%血清培养的P20、P30、P40、P50代Marc-145细胞铺满培养瓶后,使用0.25%胰蛋白酶消化,调整细胞密度为1.0×104mL-1,分别接种到24孔板,每孔接种1 mL,置37 ℃、5% CO2培养箱中培养,每隔24 h对细胞进行计数,培养至细胞密度开始下降时停止,绘制细胞生长曲线,测定最大增殖密度和倍增时间。
t=T/A;
(1)
A=log2(Y/X)。
(2)
式中:T为培养时间,h;X为初始接种细胞数,mL-1;Y为细胞最大增殖密度前1 d的细胞数,mL-1;t为倍增时间,h;A为最大增值密度,mL-1。
1.3.4 Marc-145细胞染色体分析
按照常规方法对含有10% NBS的DEME培养的P10细胞株和含有3% NBS的DEME培养的P50细胞株进行染色体制片,Gimesa染色后观察拍照。对50个铺展完好的中期细胞进行染色体计数,并用Adobe Photoshop CS6软件进行核型分析。
1.3.5 PRRS病毒敏感性分析
10%NBS培养的P10细胞株和3%NBS培养的P20、P30、P40、P50细胞株用T-flask方瓶培养,待细胞单层长满后,弃去旧培养液,加入10 mL含2% NBS的病毒维持液,按照感染复数为0.05的量加入PRRS病毒液,37 ℃吸附1 h后补加10 mL病毒维持液,置37 ℃、5% CO2培养箱培养。镜下观察病变情况,培养到72 h和96 h后收集上清液,测算半数组织培养感染剂量(median tissue culture infective dose median tissue culture infective dose,TCID50)。
1.3.6 Marc-145细胞低浓度血清适应及驯化
以适应了3% NBS培养条件的P50代Marc-145细胞作为初始细胞,在含1% NBS的DMEM培养液中连续传代3代后,在无血清的细胞悬浮培养基中进行无血清悬浮培养驯化适应,细胞初始接种密度2×106mL-1,培养转速为100 r·min-1,每24 h进行细胞计数,每48 h更换细胞培养液,培养48 h后观察细胞形态。
2 结果与分析
2.1 Marc-145细胞形态特点
10%血清浓度培养Marc-145细胞,单层长满后进行传代培养至P10后,缓降培养基中血清浓度至3%并传代至P20、P30、P40和P50。如图1所示,5个不同代次的细胞贴壁初期,细胞边缘清晰、体积较大,36~48 h后细胞长满瓶底,呈扁平多边形。
2.2 Marc-145细胞生长曲线
P10、P20、P30、P40和P50代Marc-145细胞生长曲线均呈“S”形(图2)。如图所示,P10代细胞培养至第8天时细胞密度最大,达到4.15×105mL-1;P20、P30、P40、P50代细胞培养至第9天时细胞密度最大,分别为4.23×105、4.53×105、4.45×105、4.37×105mL-1。如图所示,Marc-145细胞生长趋势基本相同。P10代和P50代细胞密度的倍增时间分别为34.15、36.16 h。
2.3 Marc-145细胞染色体分析
经50组分裂中期细胞染色体数据分析,Marc-145细胞P10和P50代染色体条数众数均在88~90条。P10代染色体条数众数在88~90条的占50%,P50代染色体条数众数在88~90条的占44%(图3)。从P10传代到P50代染色体数目没有发生明显变化。P10和P50代染色体见图4。
2.4 PRRSV在Marc-145细胞上的增殖
由图5可知,P10、P20、P30、P40和P50代Marc-145细胞接种PRRSV,P50代细胞接种PRRSV 72 h后出现病变,出现病变所耗的时间比P10代细胞长,但病变程度严重。接毒96 h后,P50代Marc-145细胞大部分已病变脱落。分别于PRRSV感染Marc-145细胞72、96 h后,测算TCID50。如表1所示,不同代次的Marc-145细胞TCID50间差异不显著(P>0.05)。
2.5 Marc-145细胞无血清驯化
无血清驯化培养的Marc-145细胞悬浮培养48 h后细胞密度达4.14×106mL-1,细胞存活率95%,细胞圆缩明亮,无挂壁、结团等现象,细胞状态良好(图6)。
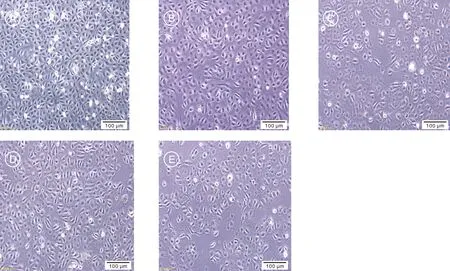
A,P10细胞;B,P20细胞;C,P30细胞;D,P40细胞;E,P50细胞。A, P10 cells; B, P20 cells; C, P30 cells; D, P40 cells; E, P50 cells.
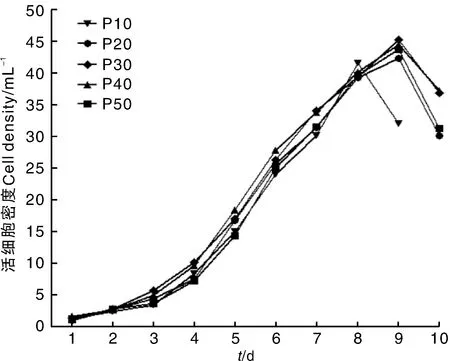
图2 Marc-145细胞生长曲线Fig.2 Growth curve of Marc-145 cells
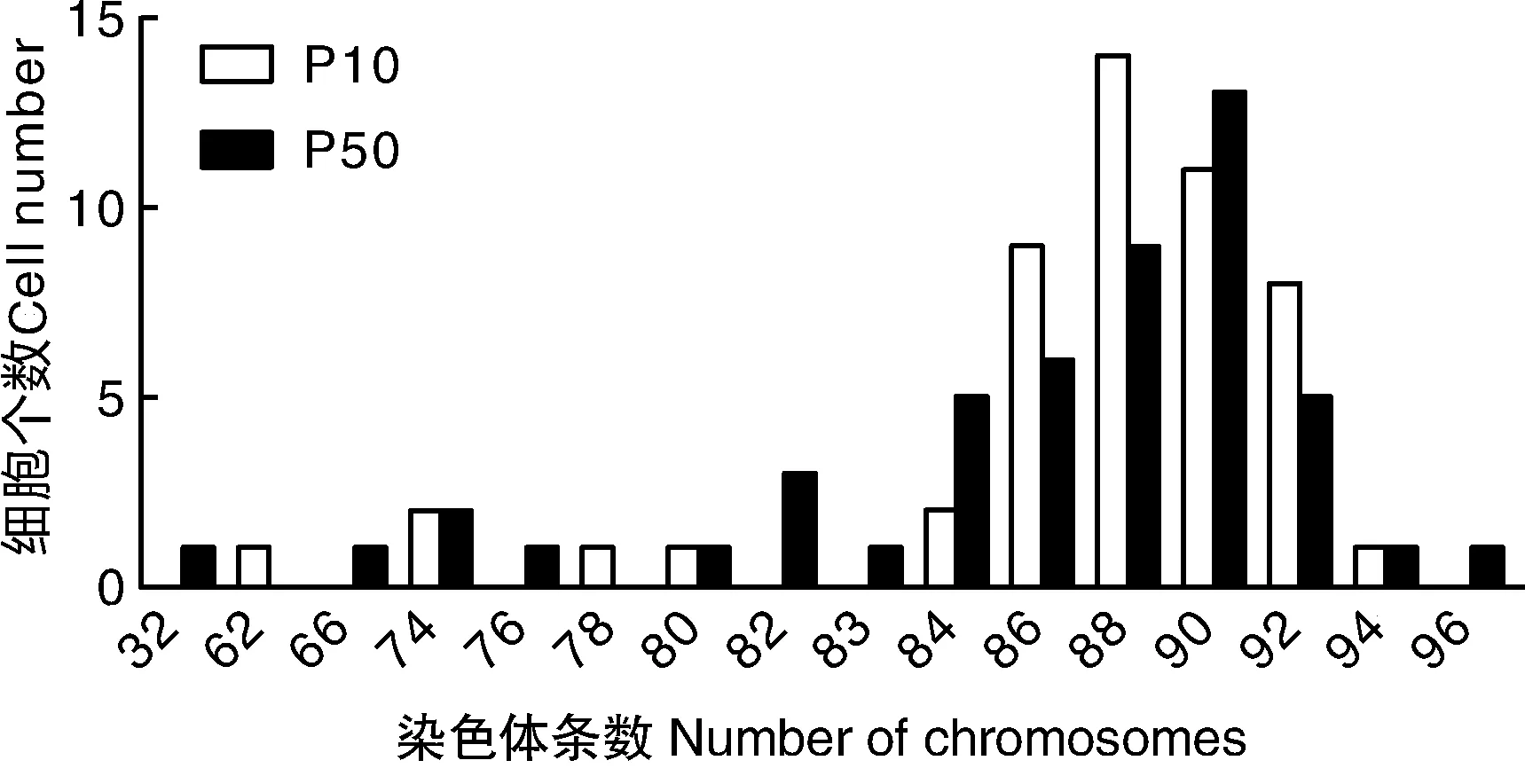
图3 P10和P50代Marc-145细胞染色体众数分布图Fig.3 Distribution of chromosome number in Marc-145 cells of P10 and P50 generations
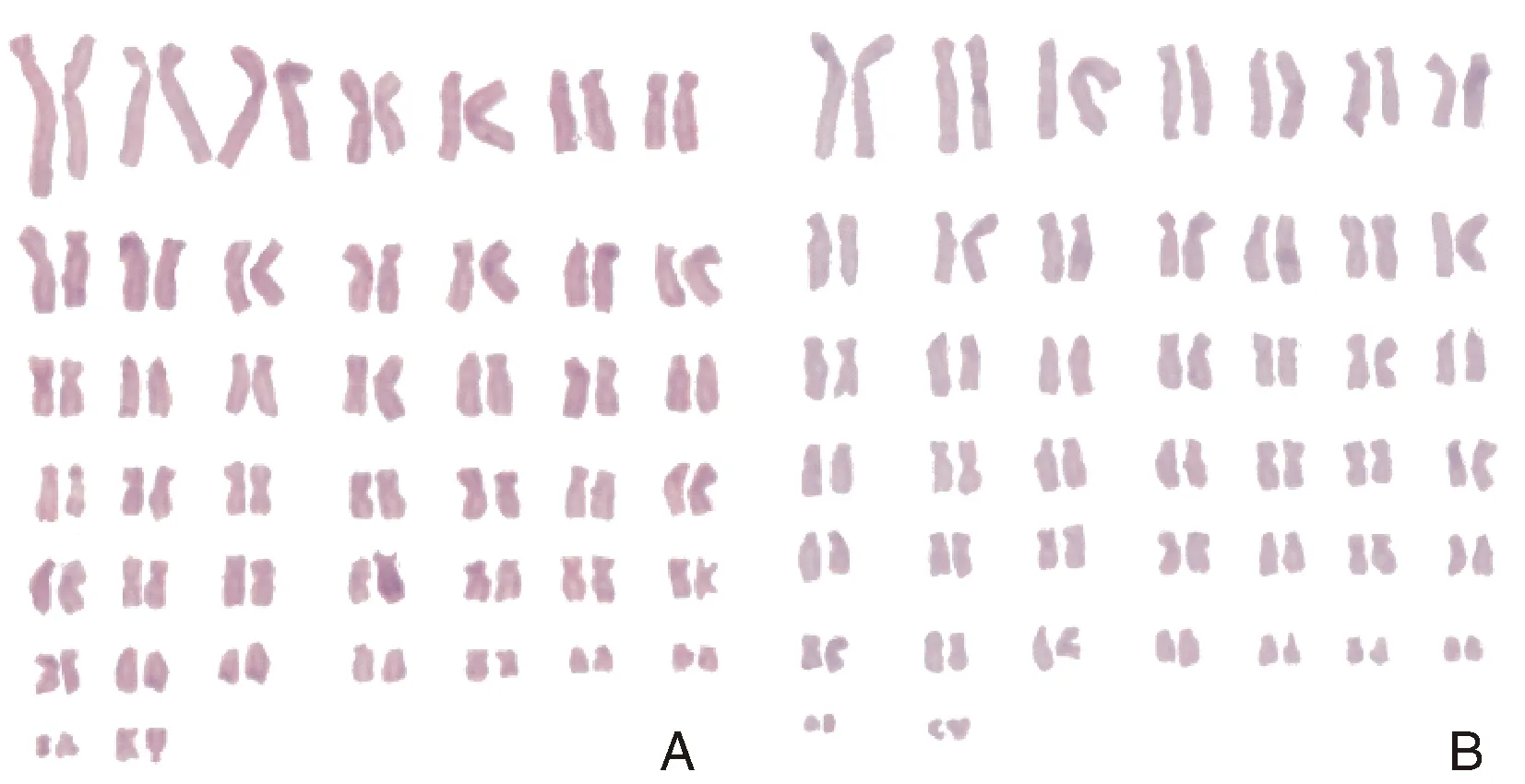
A,P10细胞;B,P50细胞。A, P10 cells; B, P50 cells.
3 讨论
利用无血清悬浮培养细胞生产猪繁殖和呼吸障碍综合症疫苗,可在短期内大规模增殖病毒,在疫情爆发时提供足够的疫苗产品。Marc-145悬浮细胞的大规模培养,可以有效扩大细胞的生长密度,同时也避免了动物源性成分对疫苗生产过程中带来的不确定性风险因素。

A,P10细胞;B,P20细胞;C,P30细胞;D,P40细胞;E,P50细胞。A, P10 cells; B, P20 cells; C, P30 cells; D, P40 cells; E, P50 cells.
表1 不同代次Marc-145细胞中PRRSV增殖能力比较
Table1Comparison of proliferation ability of Marc-145 cells to PRRSV

接种时间Inoculation time/hTCID50/(0.1 mL)-1P10P20P30P40P5072 10-4.25010-4.62510-4.25010-5.37510-4.50096 10-4.50010-4.37510-4.25010-4.75010-4.625
每列未标注字母代表差异不显著(P>0.05)。
In the same column, the unlabeled letters indicated the difference was not significant(P>0.05).

A,驯化后24 h;B,驯化后48 h。A, 24 h after acclimation; B, 48 h after acclimation.
细胞传代稳定性的研究主要是评估细胞在连续传代后其特性是否发生改变,也是评估细胞可否应用于疫苗生产的重要的、必不可少的部分[11]。本试验结果显示,Marc-145细胞在降血清驯化过程中,随着传代次数的增加,细胞倍增时间稍有延长,可能与培养基中血清含量降低有关。染色体核型分析反映了遗传稳定性,本试验中不同代次Marc-145细胞染色体无显著变化。病毒在细胞内的增殖受很多因素的影响。Marc-145细胞接种病毒后,P10、P20、P30、P40和P50代细胞TCID50值间无显著差异,表明连续传代后Marc-145细胞对PRRSV的敏感性未发生显著性的变化。陈宏等[12]用缓降血清的方法建立了无血清悬浮培养的MDCK细胞,而且驯化的细胞能够稳定的连续传代培养,并保持较高的活力。Chu等[13]通过CRISPR基因编辑技术,使MDCK细胞稳定表达siate7e基因,进而驯化成悬浮细胞。本试验将P50代的Marc-145细胞株初步驯化成无血清悬浮培养的Marc-145细胞,细胞活力达95%。Marc-145细胞能初步驯化成无血清悬浮培养细胞株,但由于缺乏专门适用于Marc-145细胞的无血清悬浮培养基,因此不能达到高密度悬浮培养。Marc-145细胞在培养过程中如果营养缺乏会导致细胞过早进入维持期并逐渐死亡。细胞高密度培养工艺中,营养是制约细胞培养效果和细胞密度的重要因素。因此,应根据实际生产细胞株的生长代谢特性及病毒增殖需要开发无血清培养基。
Marc-145细胞在降血清驯化传代的过程中细胞特性较稳定,尤其是Marc-145细胞PRRSV的敏感性没有发生改变,该细胞株具备大规模无血清悬浮培养的基本能力,为PRRSV疫苗的无血清悬浮培养生产制备奠定了试验基础。

