CuFe2O4活化过一硫酸盐降解四环素*
王 艳,张佳文,范行军,赵建荣
(安徽科技学院资源与环境学院,安徽 蚌埠 233100)
0 引 言
目前,医药作为一种新型的污染物受到越来越多的关注,也引起了世界各国环保工作者的兴趣。在地表水、地下水、生活污水和饮用水中均已经检测到多种药物,例如抗生素、荷尔蒙、防腐剂和麻醉药等[1]。其中由于抗生素广泛用于人类和畜牧业中而成为环境保护学者的重点研究对象。特别是在农业、牲畜养殖业和渔业中,四环素主要用于防治和治疗动物的疾病,还被作为饲料添加剂用于促进动物的生长,提高经济价值。然而,四环素在动物体内不能完全代谢,很大一部分随动物的粪便、尿液等排泄物排出体外[2-4]。如果这些排泄物得不到适当的处理将会进入到环境体系中,污染生态环境[2]。由于四环素具有一定的生物毒性和在生物体内积累的特性,长期处于四环素污染的环境或是食用以被四环素污染的动植物为原料的食品,会不同程度的危害到人体健康[5,6]。然而,四环素因其自身具有广泛的抗菌作用,而很难通过传统的生物方法降解,消除其生物毒性。
近年来,基于过硫酸根自由基(SO4·-)的高级氧化技术由于其具有很强的氧化能力而在去除难降解有机污染物方面得到广泛应用[7-9]。紫外光照射、碱活化、热处理、电化学和低价过渡金属等方法被用于活化PMS生产[7-9]。其中,非均相催化氧化体系由于其成本低、操作方便,无需外加能量,在大型水处理中具有广阔的应用前景。CuFe2O4,作为一种尖晶石型磁性纳米颗粒,因为它便于固液分离,具有较好催化活性和理想的稳定性而受到广大学者们的青睐[7,10-12]。而且CuFe2O4被广泛应用于催化臭氧、H2O2和过硫酸盐(PS与PMS)降解有机污染物[7,12-17]。但是,CuFe2O4活化PMS降解四环素类抗生素的报道还未见。
以四环素类抗生素的代表物盐酸四环素作为研究的目标污染物,考察在CuFe2O4活化PMS的催化氧化体系中主要操作条件如PMS浓度、初始pH值、CuFe2O4投加量等对四环素降解效果的影响。并通过引入自由基抑制剂和EPR技术鉴别CuFe2O4/PMS催化氧化体系中的活性物种。同时,采用发光菌检测了四环素在降解过程中出水的急性生物毒性。
1 材料与方法
1.1 材料与试剂
过一硫酸钠(PMS),氯化铁(FeCl3),氯化铜(CuCl2),硼氢化钠(NaBH4),叔丁醇(TBA),叠代钠(NaN3),乙醇(EtOH),盐酸四环素(TC),均为分析纯,购于国药集团化学试剂有限公司。5,5-二甲基-1-吡咯啉-N-氧化物(DMPO),4-氧代-2,2,6,6-四甲基哌啶(4-oxo-TEMP)均为分析纯,购于阿拉丁试剂有限公司。明亮发光杆菌T3冻干粉购于南京土壤所。
1.2 主要仪器
高效液相色谱仪(HPLC,SHIMADZU公司,日本);扫描电子显微镜-能谱分析仪(SEM-EDS,日立S-3400N,日本);X射线衍射仪(XRD,布鲁克D8A,德国);电子自旋顺磁共振波谱仪(EPR,布鲁克A200,德国);智能化生物毒性仪(DXY-3,中国);总有机碳分析仪(TOC,TOV-L,SHIMADZU公司,日本);紫外-可见光分光光度计(UV1750,SHIMADZU公司,日本);生化培养箱(SPX-250AB)等。
1.3 试验方法
1.3.1 CuFe2O4催化剂的制备
将1 mmol FeCl3和1 mmol CuCl2溶解在50 mL去离子水中,搅拌至完全溶解后,加入1 g NaBH4,继续搅拌10 min后;再加入1 g NaOH,搅拌15 min。然后,将棕色悬浮物和溶液转移到100 mL具有聚四氟乙烯内衬的不锈钢高压反应釜中。将反应釜置于180 ℃的烘箱内,反应24 h。最后,将反应釜自然冷却至室温,采用0.45 μm滤膜过滤,所得褐色固体采用去离子水反复冲洗至中性,放在60 ℃烘箱内烘干,研磨,即得CuFe2O4粉末。
1.3.2 催化降解实验
在室温(25 ℃)条件下,将200 mL初始浓度为50 mg/L的盐酸四环素废水置于300 mL烧杯中,并将烧杯放在六元搅拌器上(其中搅拌棒为聚四氟乙烯板),设置搅拌速度为100 r/min。然后加入一定量的PMS和CuFe2O4,开始计时。在一定间隔时间内取样,用0.45 μm滤膜过滤,在1.5 mL滤液中加入0.1 mL乙醇,摇匀,然后在HPLC中测定四环素浓度。四环素降解率:
R=(1-C/C0)×100%
(1)
式中,R—四环素降解率,%;C—t时刻四环素的浓度,mg/L;C0—四环素的初始浓度,mg/L。
1.4 分析方法
1.4.1 催化剂表征
采用X射线粉末衍射仪测定样品的晶相结构。测试条件为:辐射源为CuKα1,波长0.154 nm,衍射角2θ扫描范围为20~80°,扫描步长为0.01°,温度25 ℃,电压40 kV。采用扫描电镜分析催化剂表面形貌,操作电压为20 kV。
1.4.2 四环素检测
废水中四环素采用HPLC检测,先用UV对水样在200~800 nm范围内进行扫描确定四环素的最大吸收波长为359 nm,并以此作为HPLC检测的吸收波长。测试条件为:色谱柱为VP-ODS C18 (4.6 mm×250 mm,5 μm);紫外检测器,波长为359 nm;流动相为乙腈/0.01 mol/L草酸水溶液(31∶69);流速为1 mL/min;温度为室温;进样量为10μL。
1.4.3 反应出水生物毒性测定
依照国家标准(GBT 15441—1995水质急性毒性的测定 发光细菌法)测定[18]。每个样品做3个重复和3个空白。
Inhibition (%) = (1-L/L0) ×100%
(2)
式中,Inhibition—四环素降解出水对发光菌发光强度的抑制率,%;L—发光菌在降解t时刻时出水中的发光强度,mV;C0—发光菌在降解0时刻时出水中的发光强度,mV。
2 结果与讨论
2.1 催化剂的表征
在非均相催化反应中,吸附、反应、解吸等一系列反应过程通常发生在固体催化剂的表面。因此,对于非均相催化氧化反应来说,固体催化剂的组成和结构对催化剂的活性有很重要的影响。通过SEM-EDS检测了催化剂的表面特征和主要构成元素,结果如图1所示。
由图1a可以看出,合成的褐色粉末物为片状团聚体。随机选择其中一个面做能谱分析颗粒物的各元素及比例,其结果如图1b所示。由图1b EDS元素分析表可知,颗粒中的主要金属元素为铜、铁,而且两种元素的物质量比例分别为9.72%和19.06%,即Fe∶Cu约为2,说明合成的褐色颗粒物主要成分可能为CuFe2O4。
为了进一步确定所制备的褐色颗粒的晶型结构,采用XRD分析了颗粒物的特征,其结果如图2所示。由图2可知,颗粒物具有很高的结晶度,模式与CuFe2O4(JCPDS,No.34-0425)标准模式匹配良好[19],即2θ在18.32°、29.91°、34.72°、35.86°、43.77°和 53.92°的衍射峰值分别为尖晶石CuFe2O4的(101)、(112)、(103)、(211)、(220)和(312)的反射。
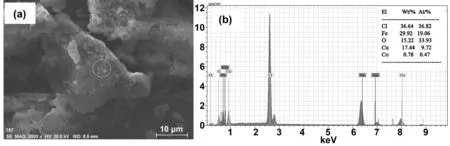
图1 CuFe2O4的扫描电镜图(a)和能谱图(b)Fig 1 SEM and EDS of CuFe2O4

图2 CuFe2O4的XRD分析Fig 2 XRD of CuFe2O4
2.2 CuFe2O4的催化性能与使用寿命性
为了了解CuFe2O4活化PMS降解TC的性能,当TC初始浓度为50 mg/L,初始pH为6时,考察了单独PMS、CuFe2O4和CuFe2O4/PMS条件下TC的降解情况,其中单独PMS和CuFe2O4/PMS体系中PMS的用量为2 mmol/L,在CuFe2O4和CuFe2O4/PMS体系中CuFe2O4的投加量均为0.3 g/L,其结果如图3所示。由图3可知,单独的PMS无法使得TC降解;单独的CuFe2O4使得TC降解率也只有11%,说明TC在CuFe2O4上的吸附很少,或者说CuFe2O4对TC的吸附力很弱。而在CuFe2O4/PMS体系中,30 min内TC降解率高达93%。在CuFe2O4/PMS氧化体系中,CuFe2O4对PMS具有很强的催化活性,活化PMS产生大量的,进一步氧化TC,从而提高了TC的去除率。Qin等在考察CuFe2O4活化PMS降解多氯联苯时出现了相同的现象[19]。

图3 不同条件下TC的降解情况Fig 3 Degradation of TC in different systems
为了进一步了解CuFe2O4在CuFe2O4/PMS氧化体系中的使用性能,在TC初始浓度为50 mg/L,初始pH为6,PMS为2 mmol/L时,探讨了4次循环使用CuFe2O4时TC的降解情况,结果如图4所示。从图4可看出,重复使用CuFe2O44次的过程中,TC的降解率仍然能保持很高,分别为93%、95%、94%和94%,说明CuFe2O4在CuFe2O4/PMS氧化体系中,仍然能维持高的催化活性。

图4 循环使用CuFe2O4过程中TC降解情况Fig 4 Degradation of orange II during the circle use of CuFe2O4
2.3 活性物种的鉴定
为了更好地阐明CuFe2O4/PMS氧化体系中存在的主要活性物种,在反应体系中加入抑制剂,如叔丁醇(TBA)、乙醇(EtOH)和叠代钠(NaN3)[20-21],考察TC的降解情况。叔丁醇与·OH的反应速率很快,其速率为3.8×108~7.6×108M-1/s,但与反应速率较慢,其反应速率仅4×105~9.1×105M-1/s[7,10,20,22-23];乙醇因α-氢的存在,能与·OH/快速反应,其反应速率分别为1.2×109~2.8×109M-1/s和1.6×107~7.7×107M-1/s[7,20,24];NaN3也常常被用于抑制1O2[7,20]。因此,在TC初始浓度为50 mg/L,PMS用量为2 mmol/L,CuFe2O4的投加量均为0.3 g/L,自由基抑制剂叔丁醇和乙醇加入量分别为50 mmol/L,NaN3加入量为3 mmol/L时,从而间接证明CuFe2O4/PMS氧化体系中是否有·OH、·OH/和1O2等活性物种,其结果如图5所示。
由图5可知,在无自由基抑制剂的情况下,TC在30 min后降解率达到93%;而加入叔丁醇后,其降解率明显受到抑制,30 min后的降解率仅仅达到85%,说明反应体系中存在·OH且为TC的氧化降解做出了较大的贡献。而加入乙醇后TC降解率也受到影响,30 min后TC的降解率为76%,明显小于叔丁醇存在时TC的降解率。这说明在CuFe2O4/PMS氧化体系中不仅存在·OH氧化,而且存在氧化。相对于无抑制剂的情况,在CuFe2O4/PMS氧化体系引入NaN3的情况下,30 min后TC的降解率略微有所下降,为89%,间接说明CuFe2O4/PMS氧化体系中存在1O2氧化。
为了进一步证实CuFe2O4/PMS氧化体系中存在·OH和,以DMPO作为自旋捕获剂,在DMPO初始浓度为100 mmol/L,PMS用量为2 mmol/L,CuFe2O4的投加量均为0.3 g/L的条件下进行EPR实验,检测DMPO-OH和DMPO-SO4的电子自旋共振强度来判别反应体系中是否存·OH和[24-25],结果如图6a所示。由图6a可见,相对强度为1∶2∶2∶1,其精细分裂参数为αN=14.9 G,αH=14.9 G的四线光谱被检测到,这是DMPO-OH在电子顺磁共振图谱中的特征,说明在CuFe2O4/PMS氧化体系中存在·OH[24]。DMPO-SO4的特征图谱为相对强度为αN=13.8 G,αH=10.1 G,αN=1.4 G和αH=0.8 G,在EPR图谱中也被检测到,说明在CuFe2O4/PMS氧化体系中也存在[24]。为了更直观地说明反应体系中1O2的存在,在CuFe2O4/PMS氧化体系中加入4-oxo-TEMP作为1O2的捕获剂,其实验条件为4-oxo-TEMP初始浓度为10 mmol/L,PMS用量为2 mmol/L,CuFe2O4的投加量均为0.3 g/L,在EPR中分析结果如图6b所示。由图6b可以观察到EPR信号为相对强度为1∶1∶1,其精细分裂参数为αN=16.9 G的三线谱,这是由于4-oxo-TEMP与1O2反应生成的一氧化氮产生的独特EPR信号[26]。
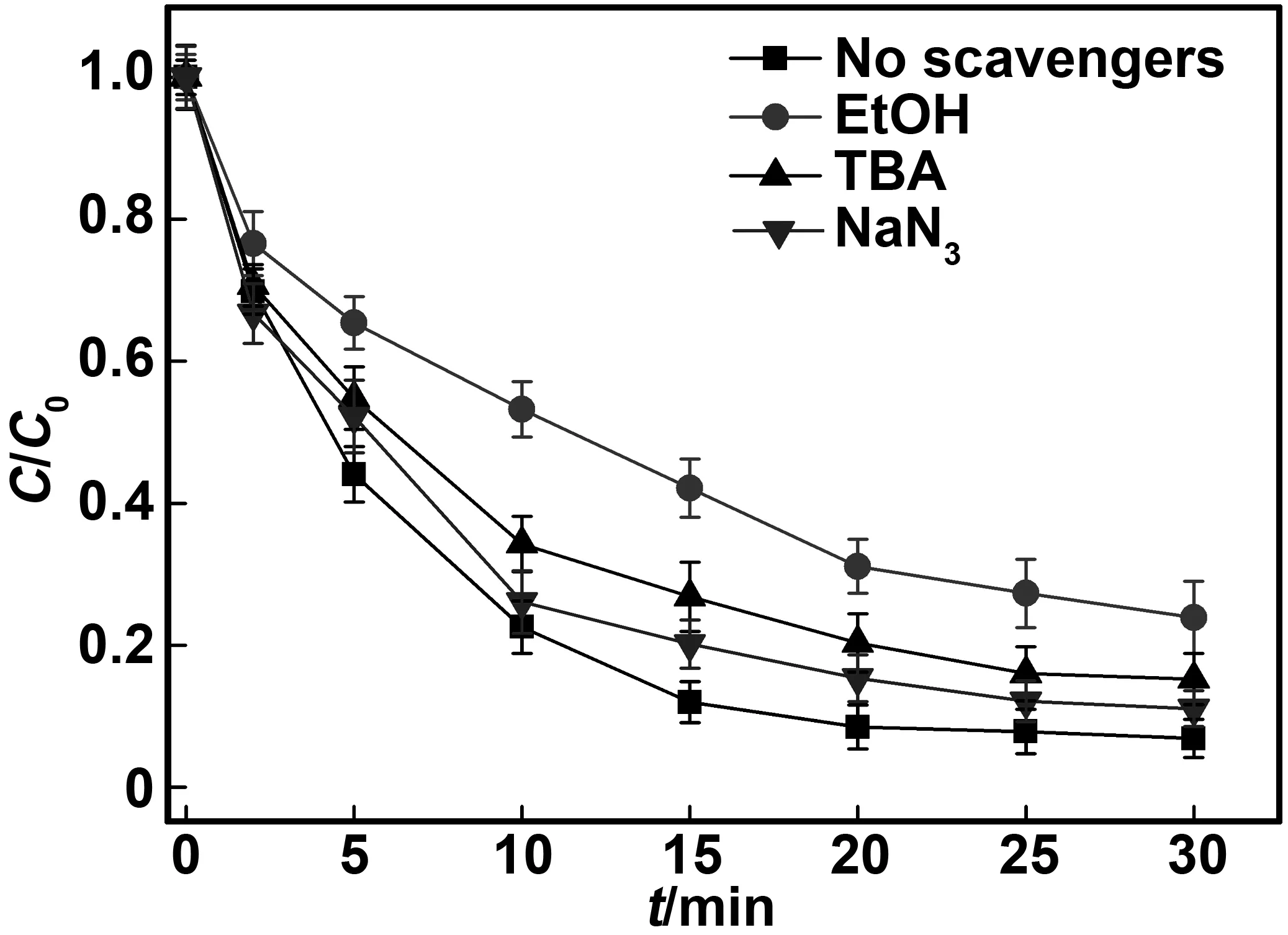
图5 不同抑制剂对四环素降解的影响Fig 5 Effect of different radical scavengers on the TC degradation
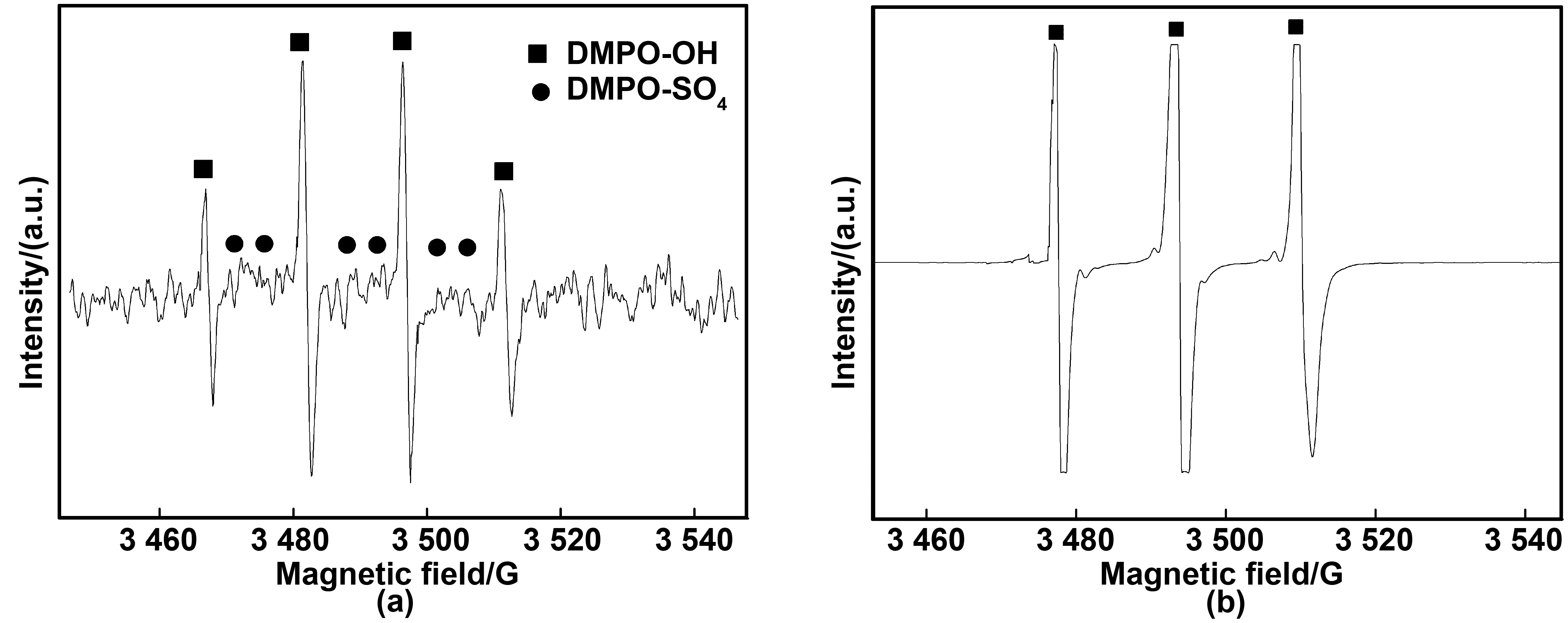
图6 CuFe2O4/PMS体系下DMPO-OH,DMPO-SO4 (a)和TEMP-1O2(b)的EPR图谱Fig 6 EPR Spectra of DMPO-OH,DMPO-SO4 and TEMP-1O2 formed in CuFe2O4/PMS system
2.4 TC降解出水的生物毒性变化
众所周知,有机污染物的降解并不意味着它被完全矿化为CO2、H2O等小分子物质,仍然有部分污染物转化为了中间产物。为了考察这些中间产物的生物毒性,当TC初始浓度为50 mg/L,PMS投加量为2 mmol/L,CuFe2O4投加量为0.3 g/L,反应液初始pH为6时,通过检测明亮发光菌发光强度实验考察了在TC降解过程中出水的生物毒性变化情况;同时,为了排除催化剂和氧化剂对毒性实验结果的影响,以超纯水代替TC溶液了解在不同降解时间节点出水的生物毒性变化,其结果如图7所示。从图7可以看出,在没有TC存在的情况下,出水的生物毒性随着反应时间的延长而逐渐降低,而且其对发光菌的抑制率一直很低,在初始时刻最高,仅为10%,随着CuFe2O4活化PMS反应时间的增长,出水对发光菌抑制率下降到约2%。这是因为反应液中的PMS被分解了,所以出水的生物毒性降低了,也说明催化剂和氧化剂的残留对探讨TC降解出水的生物毒性影响很小。
同时,从图7中还可知,在TC降解过程中的生物毒性先升高,然后逐渐降低。在降解反应进行到25 min之前,TC废水的降解出水对发光菌的抑制率随降解反应时间的增加而增加,并在25 min时,发光菌的抑制率达到最大值,为93%;当降解反应时间超过25 min,随着降解反应时间的增加,TC废水的降解出水对发光菌的抑制率逐渐降低,在降解反应时间达到120 min时,TC废水的降解出水对发光菌的抑制率降低到4%。这些现象说明在TC降解过程中出现了生物毒性比TC更高的中间产物,但经过延长降解时间,这些较强生物毒性的中间产物进一步被降解。

图7 TC降解过程中生物毒性变化Fig 7 Changes of biological toxicity during TC degradation process
2.5 操作条件对TC降解效果的影响
反应液初始pH值可以显著影响有机污染物的形态、反应体系中生成自由基的种类和催化剂的表面电荷,从而影响有机污染物的降解情况。因此,当TC初始浓度为50 mg/L,PMS投加量为2 mmol/L,CuFe2O4投加量为0.3 g/L时,在反应液初始pH为2~10的范围内考察了初始pH对TC降解效果的影响,其结果如图8(a)所示。由图8(a)可知,在初始pH为2~10的范围内TC均有较为明显的降解效果,但当初始pH大于6,TC的降解速率随反应液初始pH的升高而逐渐降低。这可能是因为碱性条件下,反应体系中的OH-与反应生成了SO4-、HSO4-和O2等无氧化活性的中间产物质[10],而这些中间产物的产生降低了活性物种的浓度;另一方面,反应体系中大量的OH-与反应还可生成·OH,虽然·OH的氧化能力也很强,但是其氧化能力却低于[27],从而大大地降低了自由基接触氧化有机污染物的机率。由此,进一步降低了CuFe2O4/PMS体系的氧化降解有机污染物的能力,导致了污染物TC的降解速率的降低。
当TC初始浓度为50 mg/L,溶液初始pH为6,CuFe2O4投加量为0.3 g/L的条件下,考察了不同PMS投加量对TC的降解情况的影响,其结果如图8(b)所示。由图8(b)可知,随着PMS投加量的增大,TC降解速率也随之增大。基于硫酸根自由基的高级氧化技术的反应机理,CuFe2O4/PMS体系对有机污染物的降解能力是基于具有强氧化性的的数量[11],而来源于PMS的分解。数量随PMS投加量的增加而增加,由此TC降解速率随之而增加。
图8(c)展示了CuFe2O4投加量对TC降解速率的影响。当CuFe2O4投加量从0.1增加到0.3 g/L时,TC降解率由46%增加到93%。这是因为CuFe2O4投加量的增加为PMS分解产生增加了活性位点,使得产率的增加[11],进一步氧化降解TC,提高了TC的降解速率。当CuFe2O4投加量达到0.3 g/L后继续增加CuFe2O4投加量,可是作为氧化剂的PMS投加量是恒定,部分增加的活性位点没有发挥其催化作用,那么产率也是恒定的。故CuFe2O4投加量达到0.3 g/L后继续增加CuFe2O4投加量,TC的降解速率也不会显著提高。

图8 操作条件对降解效果的影响:初始pH (a),PMS投加量 (b),CuFe2O4投加量 (c)Fig 8 Effect of operating parameters on TC degradation:initial pH (a);PMS addition (b);CuFe2O4 addition (c)
3 结 论
采用水热合成法制得的催化剂,通过SEM-EDS和XRD技术分析确定催化剂的主要成分为CuFe2O4,考察了CuFe2O4活化PMS降解TC的催化效能。结果表明,在非均相反应体系中CuFe2O4展现出较高的催化活性,在30 min内能使TC降解率达到93%。CuFe2O4经4次重复使用后TC降解率均可保持在93%以上,说明制备的CuFe2O4催化性质稳定,具有良好的循环使用性。抑制剂的引入和EPR技术检测说明CuFe2O4/PMS氧化体系中存在·OH、和1O2。
通过单因素实验分析可知,TC的降解率随CuFe2O4和PMS投加量的增加而增加;废液初始pH小于6时,随过pH值的增加而TC的降解率约为93%,废液初始pH大于6后,随过pH值的增加TC的降解率逐渐降低。TC降解出水的生物毒性随降解时间的延长而先升高后降低,降解时间达到120 min时,出水的生物毒性几乎可以忽略。

