改良的大鼠鼠尾增生性瘢痕动物模型制备方法
徐祥文 邝依敏 黄昕 高雅姗 李海洲 顾舒晨 昝涛
增生性瘢痕的形成机制尚不清楚,仅通过研究临床增生性瘢痕标本无法探究其发生发展中的病理改变。因此,建立可靠的动物模型是探究增生性瘢痕形成机制的必要步骤。目前应用较多的增生性瘢痕动物模型主要以兔耳增生性瘢痕模型[1]、免疫缺陷移植小鼠[2]、猪增生性瘢痕模型[3]、小鼠皮肤伤口牵张[4]与药物诱导模型[5]等为主,但由于创面结构及免疫微环境的差异、增生性瘢痕外观与模型建立的不稳定等因素,限制了动物模型的广泛应用及增生性瘢痕的研究进展。
近期,Zhou等[6]提出通过在大鼠鼠尾建立矩形创面,并待其充分再上皮化后对鼠尾施加机械牵张力的方法来建立增生性瘢痕的动物模型。由于鼠尾结构中无肉膜结构,该模型创面愈合及瘢痕形成过程与人增生性瘢痕高度相似,且瘢痕的大体形态与组织学变化表现为瘢痕厚度的增加、胶原排列的紊乱及增生性瘢痕相关蛋白的上调。然而,在鼠尾的不同节段其肌肉与肌腱分布不同,导致弯曲所需的牵张力不同。因此,本文通过比较距鼠尾根部3 cm处与5 cm处的创面牵张力,分析不同张力牵张下的增生性瘢痕大体外观与组织学特征改变,并通过张力相关蛋白的检测明确鼠尾增生性瘢痕的建立与张力环境的关系,为该模型在增生性瘢痕研究中的应用奠定基础。
1 材料和方法
1.1 实验动物与材料
6周龄雄性SD大鼠20只,体质量200~250 g(本院实验动物中心提供)。根据创面距鼠尾根部的距离随机分为A组(距尾端3 cm)和B组(距尾端5 cm),每组10只。
Masson染色试剂盒(北京索莱宝科技有限公司),兔抗人α-SMA 单克隆一抗、兔抗人FAK单克隆一抗、P-FAK单克隆一抗、兔抗人YAP单克隆一抗(Abcam,USA),DAB(Vector Laboratories,USA)。
1.2 实验方法
大鼠腹腔麻醉后,使用亚甲蓝在大鼠鼠尾相应位置(3 cm、5 cm)处标记6 mm的矩形创面,切开标记部位的全层皮肤。压迫止血后采用无菌纱布包扎,2 d后拆除纱布(此时伤口无渗出),16 d时待创面再上皮化后安装鼠尾牵拉装置。牵拉装置为直径2 cm的不锈钢环,将鼠尾创面固定于不锈钢环上进行牵拉(图1),并于牵拉28 d后切取瘢痕组织。取材组织一份采用4%多聚甲醛固定包埋,石蜡切片(5 μm厚);另一份冻存,用于组织蛋白提取。
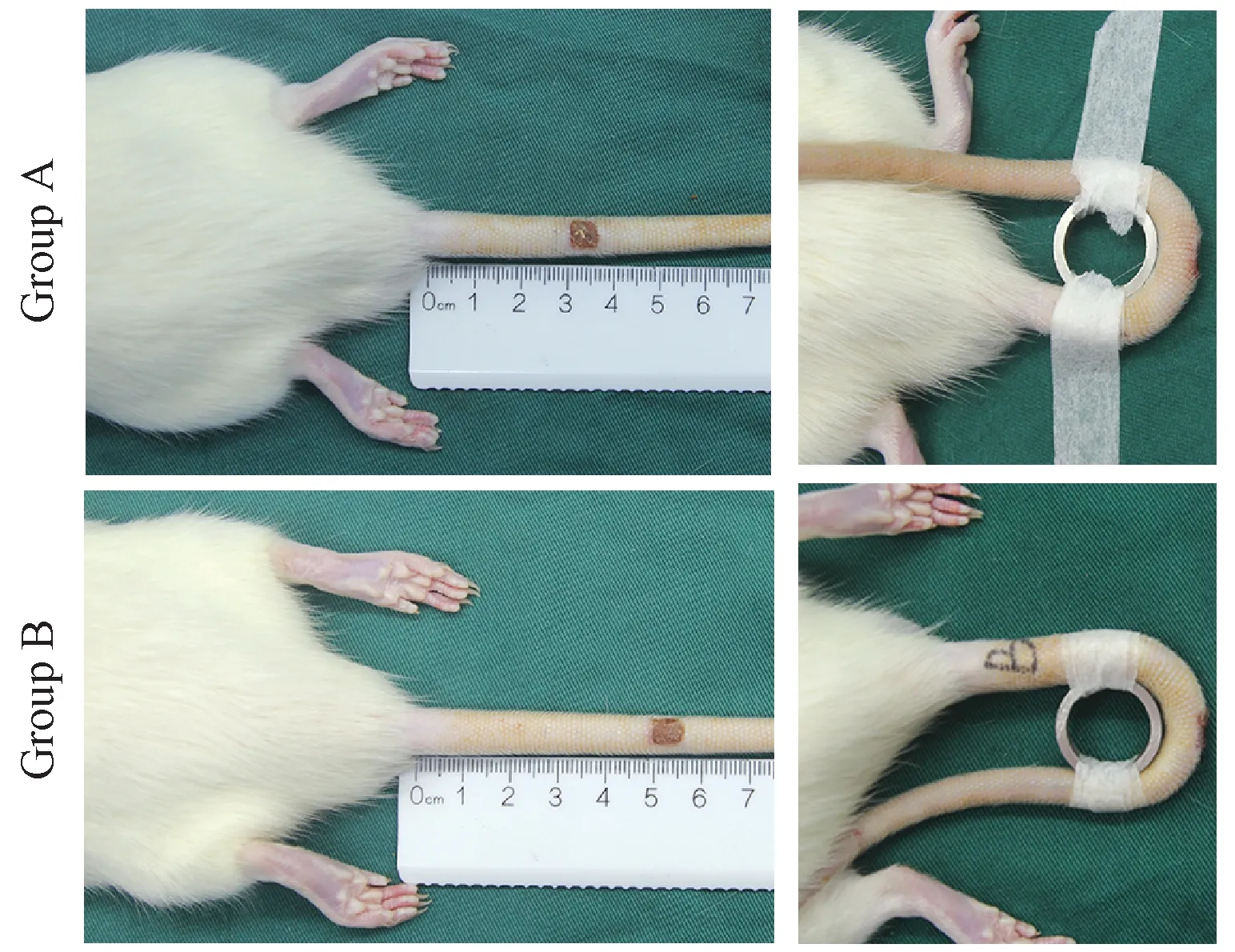
图1 大鼠鼠尾创面建立位置及牵拉外观
1.3 牵张力幅度变化测量
术后16 d创面再上皮化后安装鼠尾牵拉装置,并进行创面牵张前的纵向长度(L1)与创面牵张后的纵向长度(L2)的测量。牵张力幅度变化的计算公式如下:
1.4 大体观察
于牵拉后7 d、14 d、21 d、28 d对大体瘢痕组织进行拍照,并利用ImageJ软件(National Institutes of Health,Bethesda,USA)进行分析并测量瘢痕厚度。
1.5 组织学观察与免疫组化
石蜡切片后行Masson染色,利用ImageJ软件进行胶原体积分数(Collagen volume Fraction)测量。
按照免疫组化标准流程进行脱蜡与水化,并加入兔抗人α-SMA 单克隆一抗(1∶500),4 ℃孵育过夜。加入山羊抗兔IgG-HRP室温孵育1 h后,DAB显色。
1.6 张力相关蛋白检测
1.6.1Western blot
将冻存的一份瘢痕组织进行研磨后冰上裂解30 min,离心取上清后进行BCA法蛋白定量。等量蛋白经电泳后转移到PVDF膜上,5%脱脂奶粉固定后加入兔抗人FAK单克隆一抗、P-FAK单克隆一抗(1∶1 000),4 ℃孵育过夜。二抗室温孵育1 h后行ECL显影。利用ImageJ分析灰度值,比较蛋白表达量。
1.6.2免疫荧光法
将石蜡切片按照免疫荧光染色流程进行脱蜡、水化与破膜,并加入兔抗人YAP单克隆一抗(1∶200),4 ℃孵育过夜。加入山羊抗兔IgG-HRP 室温孵育1 h,DAPI染核后中性树脂封片。荧光显微镜下观察阳性细胞数目。
1.7 统计学分析
2 结果
2.1 创面所受牵张力变化
在大鼠鼠尾创面再上皮化后,使用外径为2 cm的不锈钢环进行牵张。A组、B组创面所受牵拉力分别增加了(22.78%±2.452%)和(15.46%±2.193%),两组具有统计学差异(P<0.05)(图2)。
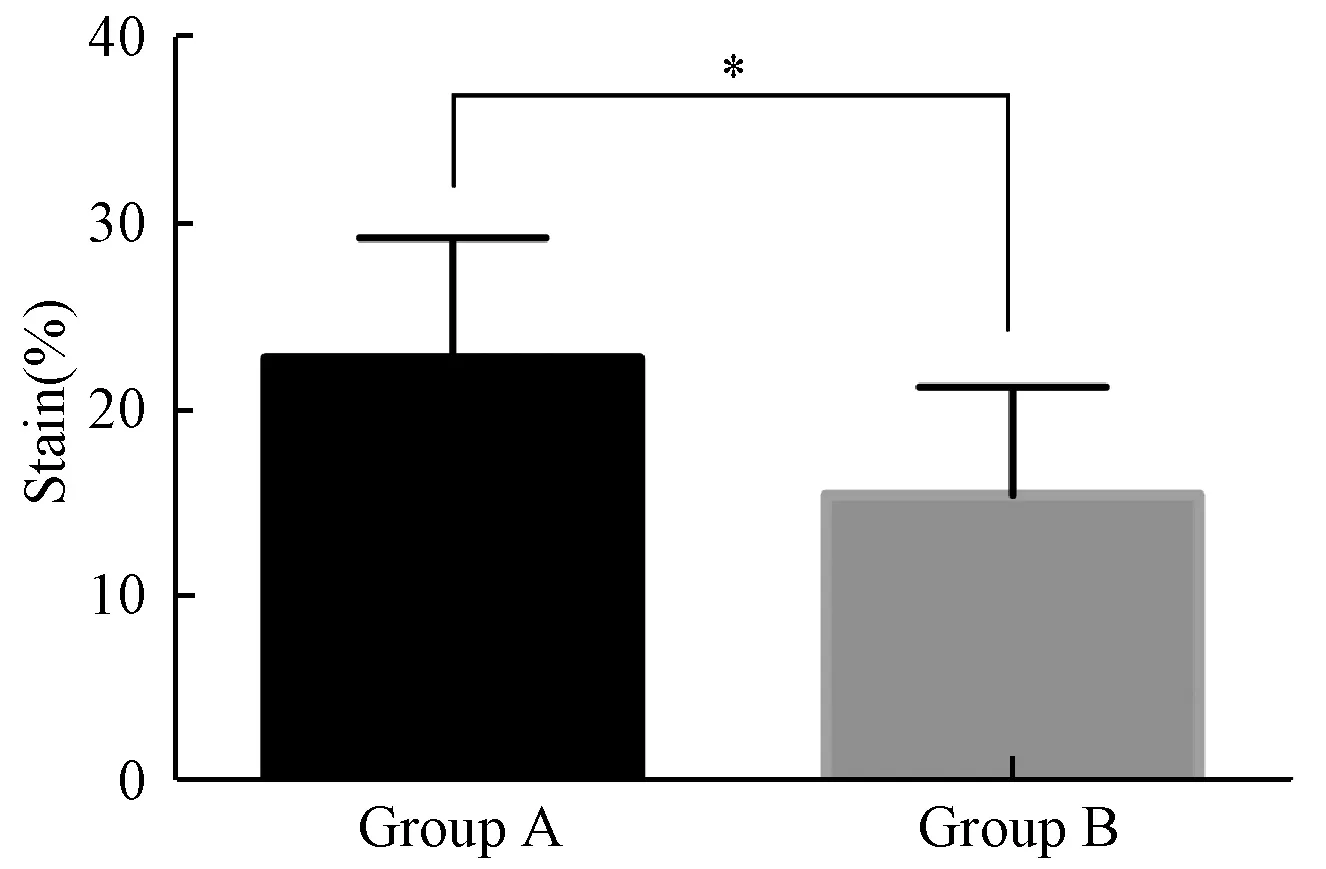
图2 牵张力测量结果(*: P<0.05)
2.2 瘢痕大体外观
牵拉7 d、14 d后,A组与B组大鼠鼠尾可见部分瘢痕色泽红润,质地较硬,然而两组均未见明显瘢痕厚度变化。牵拉28 d后,A组可见明显的与人增生性瘢痕相似的组织外观,且A组瘢痕隆起高度较B组增高了(51.97%±6.992%),两组瘢痕厚度差异显著(P<0.05)(图3)。
2.3 组织学Massoon染色、α-SMA蛋白表达比较
牵拉28 d后,两组瘢痕组织均可见表皮网钉结构减少,皮肤附件和毛发消失。Masson染色可见A组胶原束粗大,且呈漩涡样紊乱排列;B组也可见部分粗大胶原束,且随张力牵张方向呈平行排列。两组胶原体积分数分别为(37.34%±2.780%)和(25.18%±1.070%),差异显著(P<0.01)(图4 A、4B)。
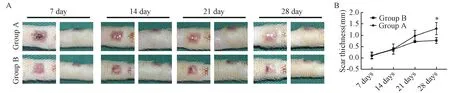
A:大体观察;B:瘢痕厚度(*: P<0.05)A: General observation; B: Scar thickness (*: P<0.05)
免疫组化染色结果显示,A组可见α-SMA蛋白在全层均高度表达,B组可见α-SMA蛋白主要在浅层真皮内高度表达,在深层真皮区表达较低。A组α-SMA表达较B组高(24.06%±3.675%),两组蛋白表达差异具有统计学意义(P<0.05)(图4C、4D)。
2.4 张力相关蛋白表达差异
Western blot结果显示, A组P-FAK/FAK表达较B组高(25.00%±2.447%),两者差异具有统计学意义(P<0.05)。免疫荧光结果显示,大鼠鼠尾增生性瘢痕的YAP蛋白主要表达于真皮层中。B组YAP蛋白多数表达于细胞质中,少数激活的YAP蛋白表达于细胞核中;A组、B组的YAP蛋白细胞核内阳性表达率分别为(38.01%±2.101%)和(21.27%±2.684%),A组激活的YAP蛋白在细胞核内的表达水平显著高于B组(P<0.001)(图5)。
3 讨论
张力是形成增生性瘢痕的重要因素之一。在既往张力诱导的增生性瘢痕动物模型中,缺乏对不同张力影响模型建立的探讨。大鼠鼠尾解剖与功能学的研究发现,鼠尾肌肉与肌腱极大地影响了鼠尾的弯曲与活动[7],根据尾椎骨排序将鼠尾肌束分为4组(Co5~10、Co11~16、Co17~22、Co23~28),其中Co5~10的鼠尾肌肉长度与重量均显著高于其他组[8],提示该段在鼠尾活动中提供较大的支持力以维持自身稳定不易弯曲。我们将A、B 两组创面建立于不易弯曲的Co5~10,以保证两组创面在位置、组织结构基本相同的情况下,比较不同外在牵张力对大鼠鼠尾增生性瘢痕形成的影响。

A:Masson染色结果;B:胶原体积分数;C:免疫组化α-SMA染色结果;D:α-SMA 阳性染色比例A: Results of Masson staining; B: Collagen volume fraction; C: Expression of α-SMA by immunohistochemical staining; D: Positive staining ratio of α-SMA
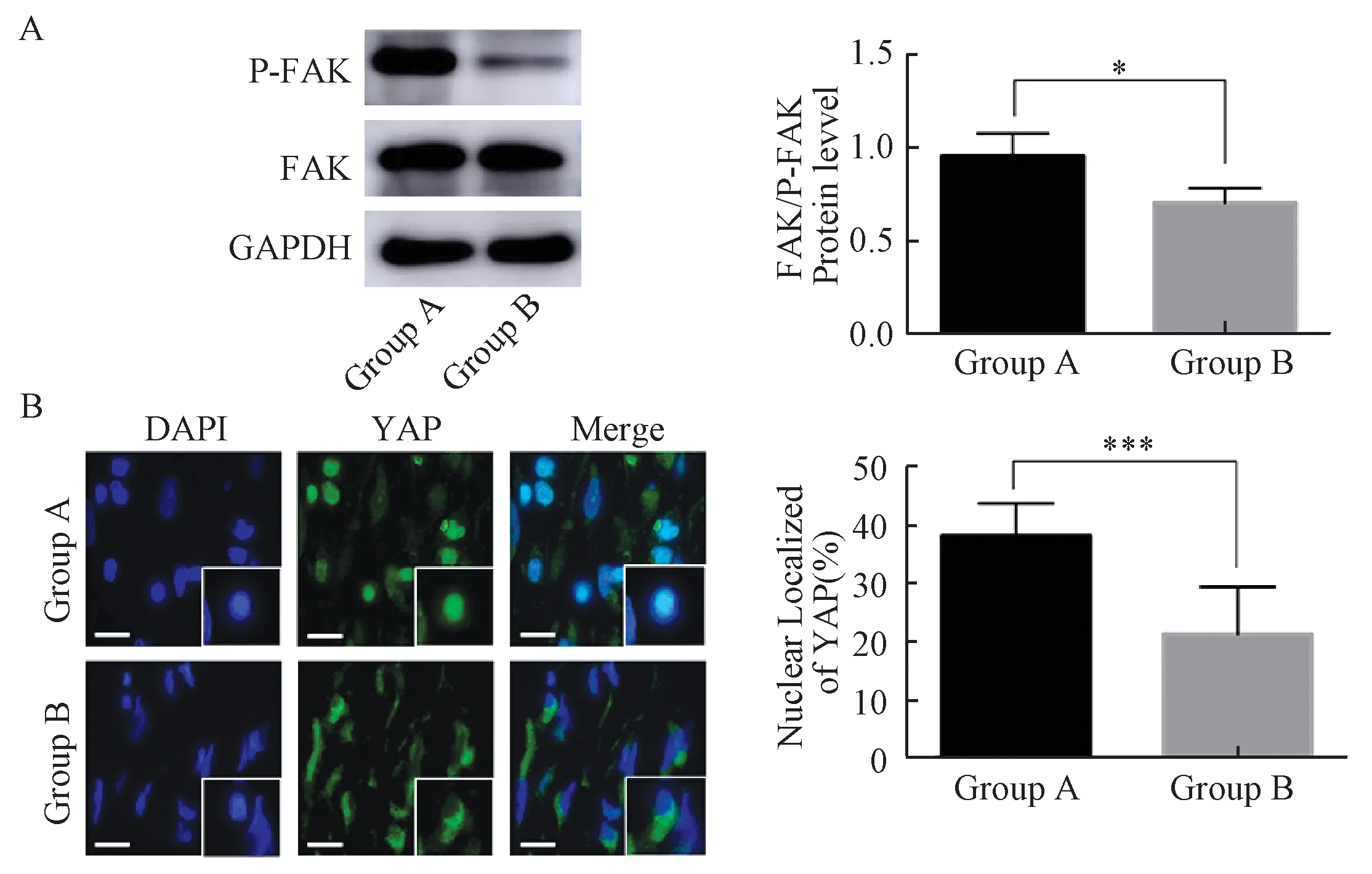
A:FAK 蛋白磷酸化及定量分析;B:YAP蛋白表达及细胞核内阳性表达比例A: Phosphorylation of FAK protein and the quantification of P-FAK/FAK; B: Expression of YAP protein and the quantification of nuclear localization of YAP
局部机械张力被认为是病理性瘢痕形成最重要的因素[9]。增生性瘢痕的好发部位一般为张力较大的区域,如前胸区、肩部等,也说明局部张力可能参与增生性瘢痕的形成[10],通过减少创面张力可缓解增生性瘢痕的发展[11]。既往体内研究证实,创面愈合过程中承受张力越大,其纤维化程度越高[12]。体外研究中使用不同牵张力可引起正常成纤维细胞向增生性瘢痕成纤维细胞转化,并且发现瘢痕相关蛋白的表达水平与牵张力大小呈反比[13],提示合适的外在张力可能影响增生性瘢痕的形成。有关机械信号转导的研究证实,张力引起的局部黏着斑激酶(Focal adhesion kinase,FAK)的活化以及转录共激活因子相关蛋白(Yes-associated protein,YAP)核异位,与纤维化密切相关[14]。FAK是一种位于细胞质的酪氨酸激酶,接受外界张力信号的输入与细胞内张力信号的输出,其下游介导细胞的增殖与迁移功能,既往在恶性肿瘤的侵袭与转移中广泛报道[15]。而YAP是Hippo信号通路下游关键的细胞内张力信号转导因子,通过细胞外基质张力的调控可促使YAP蛋白的活化与核异位,进而影响细胞的增殖与迁移[16]。
本研究通过计算牵张力,初步证实A组创面承受的牵张力幅度变化大于B 组,持续牵张28 d后发现A组瘢痕明显高于B组,且A组胶原分泌较多、排列紊乱、α-SMA表达等均高于B组,提示A组增生性瘢痕更接近人增生性瘢痕。通过检测两组瘢痕中张力相关蛋白FAK磷酸化与YAP细胞核异位,推测A组增生性瘢痕形成与高张力环境密切相关。上述结果表明,在距鼠尾3 cm处的高牵张力可能更加适合大鼠鼠尾增生性瘢痕的形成。
综上所述,我们初步证实了大鼠鼠尾距尾部3 cm处的张力较大,于该处建立创面进行牵拉可获得更接近于人增生性瘢痕的动物模型,为增生性瘢痕的研究提供了良好的基础。

