山西大同大学校园主要林木根系ECMF和DSE分布调查
李 朕,高聪辉,吴 娜,赵雅名
(山西大同大学生命科学学院,山西大同037009)
自然界超过80%的植物都能够与菌根真菌形成互利共生结构,称为菌根[1]。在农林生态系统中,菌根真菌能够与农作物、园艺作物、林木以及牧草等植物形成共生,对农林牧业发展十分重要。该类真菌主要生活在植物的活根中,能增强植物根系对水分和某些矿物质的吸收,促进植物产生生长素、细胞分裂素、抗生素等代谢产物,促进植物生长,从而提高宿主植物在多种逆境下的生存能力。同时,宿主植物为菌根真菌提供了良好的生长环境和赖以生存的有机营养。此外,菌根真菌对于环境的适应性极强,在各种陆地环境、水生态环境,甚至严重污染的生态环境中的分布均有报道[2]。
外生菌根真菌(ectomycorrhizal fungi,ECMF)菌丝能够在植物根系表面形成致密的菌套(图1 A),于根系细胞壁间生成哈蒂氏网。据报道已知可生成外生菌根的真菌约有34 科近百个属,中国约有28 科63 属,估计有千余种。近些年发现的深色有隔内生真菌(dark separated endophytes,DSE)有与ECMF 相似的生长特性,被部分学者认为是菌根的新类别。DSE也是一类与植物根系互利共生的内生真菌,在根系内形成微菌核和有隔的菌丝(图1 B),能帮助植物在多种逆境中生存,并能够抑制多种病害的侵染。
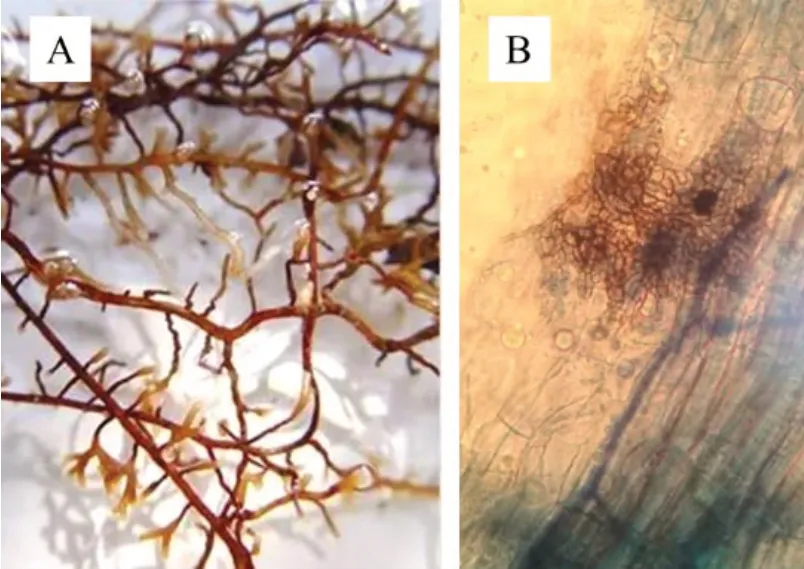
图1 ECMF侵染的根尖(A)和DSE微菌核(B)
ECMF 和DSE 能够通过直接和间接的方式帮助宿主植物在绝大多数生境中定植和生长。菌根真菌能够通过改善宿主植物水分状况,改善营养元素的吸收状况,以及调节抗氧化物质、渗透调节物质的合成等,帮助宿主植物在多种逆境中生存繁殖[3]。ECMF 的外生菌丝能够扩大植物对水分和营养元素的吸收面积,促进其对干旱、盐碱等的耐性[4]。其次,ECMF 能够在根系表面形成致密的菌套,在根系皮层细胞外形成哈蒂氏网,对病原菌、有毒有害物质入侵形成了两层物理屏障。此外,ECMF 和DSE 的分泌物,既能够改善土壤环境,又能够对一些病原菌形成拮抗作用,提高宿主的抗病性。在各种胁迫环境中,均能够观察到菌根真菌的分布,尤其在生态严重破坏环境中,如森林火灾、火山喷发后的生态环境中,菌根真菌对其生态的恢复至关重要[5]。
此外,菌根真菌能够对所处生态环境中的微生物、植物以及动物群落多样性产生影响。庞大的菌根网络可以为土壤提供约相当于凋落物40%的C,这些有机质成为土壤微生物的主要C 源,直接影响土壤中微生物的构成和数量[6]。ECMF 和DSE 分泌物能够抑制病原菌,影响微生物群落的构成。其次,菌根真菌促进植物的生长,通过植物间接影响根际微生物的多样性。菌根真菌对植物病原真菌和线虫有明显的抑制作用。菌根真菌也对土壤团聚体的形成和稳定起着重要的作用,可以促成灰土的生成。菌根真菌的类型和数量可以指示生态系统中自然或人为活动引起的变化,在生态系统保护、恢复或重建过程中起着重要作用。
植物的定植、生长,以及土壤微生物、植被和昆虫的群落多样性与菌根真菌密切相关。通过对大同大学校园植物菌根真菌侵染状况进行调查,对植被和土壤健康状况进行评估,对于校园植被维护和种植具有极大的意义。且该研究对校园ECMF和DSE真菌分离、鉴定和利用提供了参考。
1 材料与试验方法
1.1 样地选择
在大同大学校园内选取了4个样地,分别为明达楼北侧花园(S1)、博雅楼南侧花园(S2)、图书馆南侧绿地(S3)和医学院北侧花园(S4)。
1.2 试验材料
试验材料为大同大学校园内主要林木根系,主要选择了5 种林木,分别为丁香(Syringa oblateLindl)、国槐(Sophora japonicaLinn.)、圆柏(Sabina chinensisAnt.)、新疆杨(Populus bolleanaLauche)和云杉(Picea asperaMast.)。
1.3 样品采集
在每个样地中,对于5种林木,分别随机选取3棵健康植株。分4 个方向,在离主根大约半米远,尽量不破坏主根,去除表层5 cm 腐殖质层,采集15 ~35 cm深处的根系。将同一地点、同一棵植物根系样品分别混合,作为一个样品,装入采样袋用于菌根真菌侵染率的测定。
1.4 实验方法
根系处理方法如图2。根系处理好之后,选取直径小于2 mm的根系剪成大约1 cm长的小段。每个样品随机选取50 个根段,压片后在光学显微镜下观察,按照放大十字交叉法统计并计算ECMF和DSE侵染率。
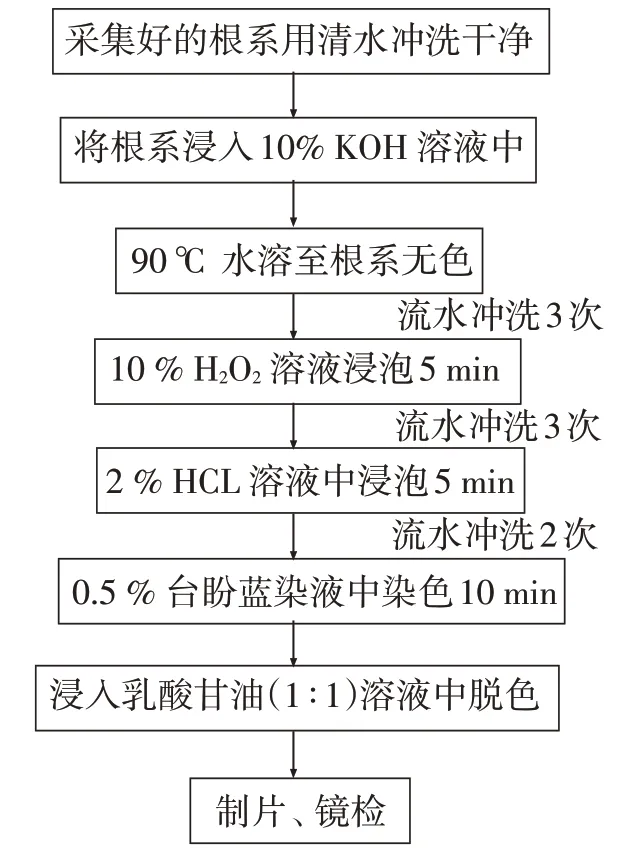
图2 根系处理方法
1.5 数据处理
实验最终结果为各组的平均值±标准差,利用Excel 2016中的t-test功能对不同处理组间进行差异显著性分析,STDEV.P函数对其进行误差分析。
2 实验结果
2.1 ECMF分布状况
结果表明,ECMF 侵染率最高出现在S1、S4 样地的丁香和S3 样地的新疆杨,均在80%以上。最低出现在S2样地的国槐,为12.3%。4个样地间,新疆杨根系ECMF 侵染率波动最大(S3 样地侵染率86.7%和S2 样地侵染率25.1%),达到61.1%。4 个样地间,云杉根系ECMF侵染率波动最小。方差分析结果表明,ECMF 侵染率在样地间、物种间的差异均显著,而二者间交互作用不明显。见图3。
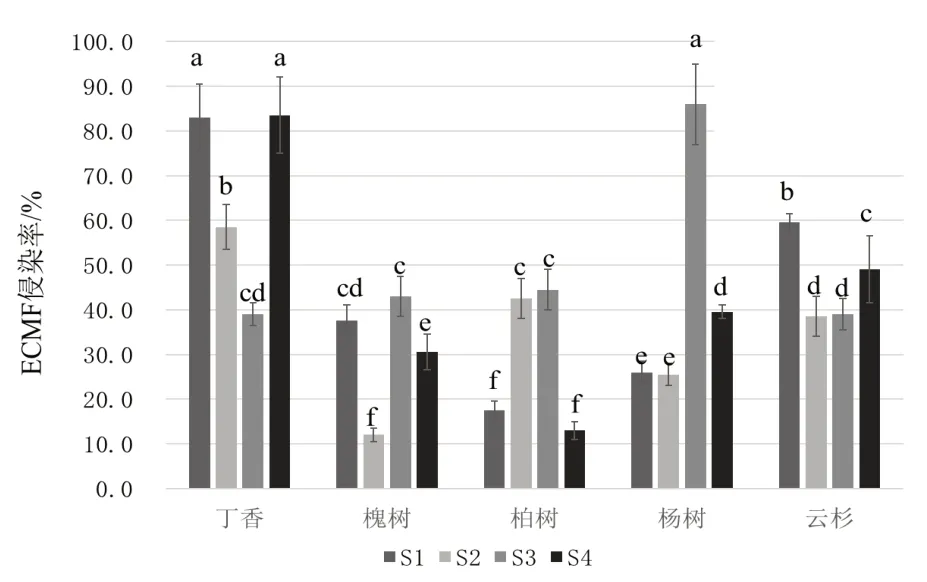
图3 4个样地、5种植被间ECMF侵染率
2.1.1 ECMF在物种间的差异
忽略样地间差异,对不同植被根系ECMF 侵染率进行统计,结果如图4。5 种植物根系ECMF侵染率为丁香>云杉>新疆杨>国槐>圆柏,且丁香根系ECMF 侵染率最高,为66.7%,显著高于其它4 种植物。新疆杨与云杉、国槐与圆柏之间侵染率无显著差异,但新疆杨与云杉显著高于国槐与圆柏。方差分析结果表明,ECMF 侵染率在物种间的差异显著。
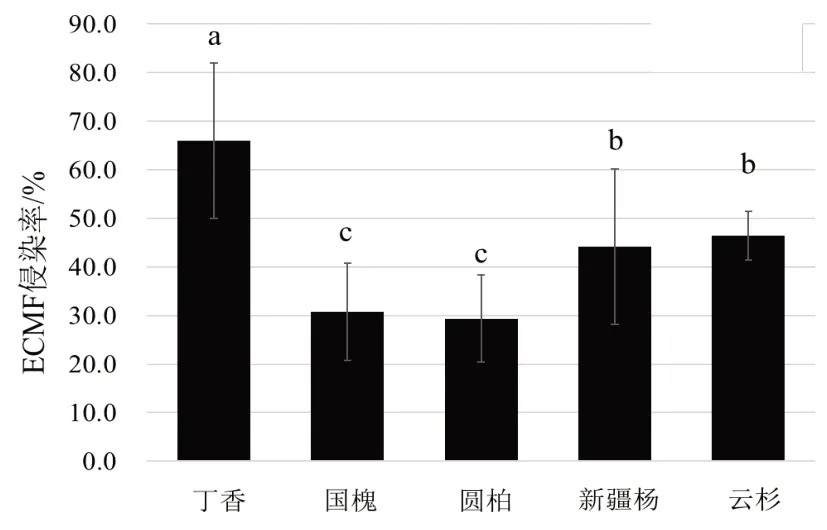
图4 不同植被间根系ECMF侵染状况
2.1.2 ECMF在样地间的差异
忽略物种间差异,对不同样地制备根系ECMF侵染率进行统计,结果如图5。忽略植被物种的影响,样地间ECMF侵染率不存在显著差异。
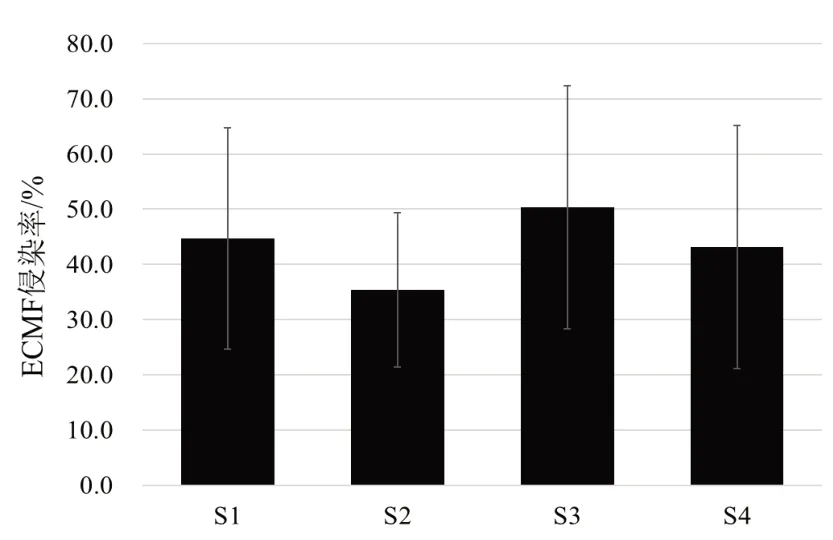
图5 不同样地间ECMF侵染率
2.2 DSE分布状况
DSE 侵染率最高出现在S1 和S2 样地的国槐根系,为4.4%和3.4%,均显著高于其它样地和其它植被。而4 个样地云杉根系中均未观察到DSE。4 个样地间,国槐根系DSE 侵染率波动最大,从S2 样地的4.4%到S4 样地的0%。DSE 侵染水平均较低,最高为4.4%,比ECMF 的最低值12.3%也低很多,这是由于2 种真菌不同的生活特性导致的。方差分析表明,DSE 侵染率在样地间、物种间的差异均显著,而二者间交互作用不明显。
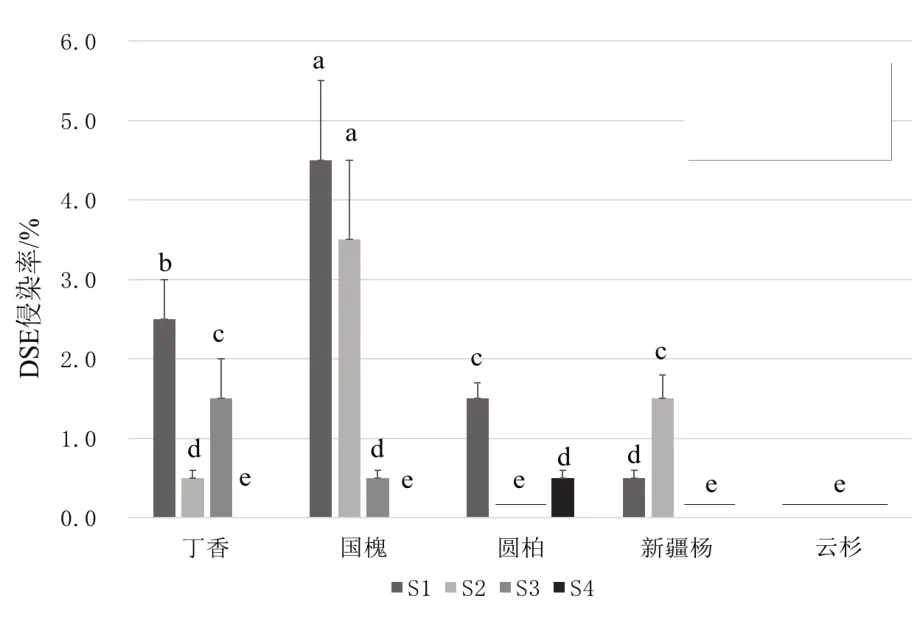
图6 4个样地、5种植被间DSE侵染率
2.2.1 DSE在物种间的差异
忽略样地间差异,对不同植被根系DSE侵染率进行统计,结果如图7。5 种植物根系DSE 侵染率为国槐>丁香>新疆杨=圆柏>云杉,国槐根系DSE侵染率最高,为2.1%,显著高于其它4种植物。圆柏与新疆杨间DSE侵染率没有显著差异,云杉侵染率为0%。方差分析表明,DSE 侵染率在物种间的差异显著。
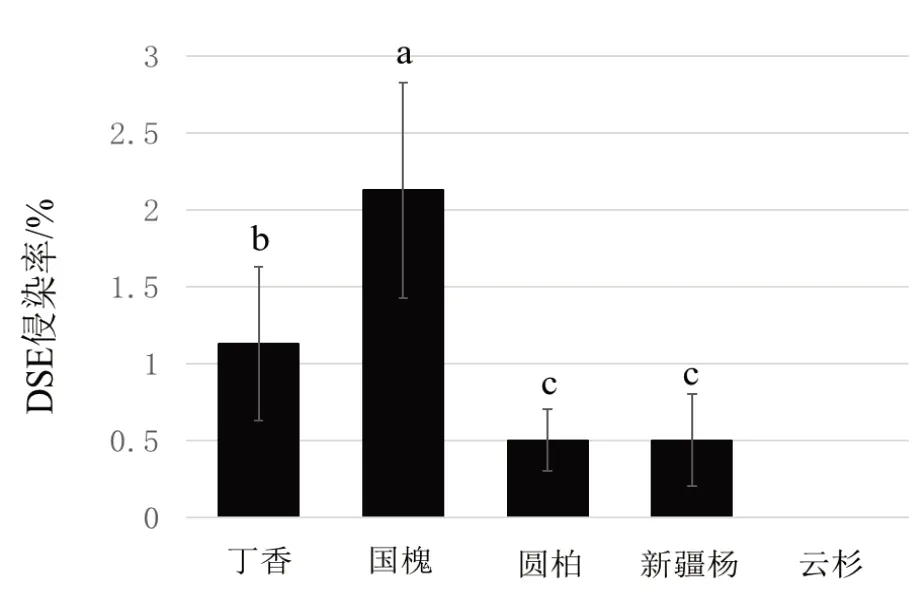
图7 不同物种间DSE侵染率
2.2.2 ECMF在样地间的差异
忽略物种间差异,对不同样地制备根系ECMF侵染率进行统计,结果如图6。结果表明,忽略植被物种的影响,样地间ECMF侵染率不存在显著差异。
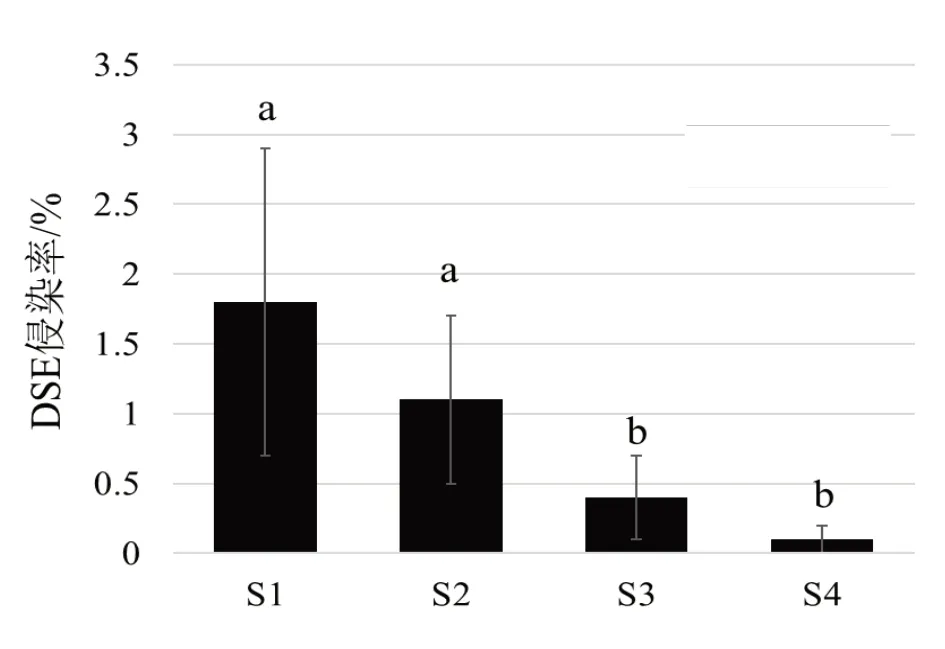
图8 不同样地间DSE侵染率
3 分析与讨论
研究发现ECMF和DSE侵染在不同物种间存在较大差异。可以形成外生菌根的宿主植物主要有柏科、松科、杨柳科、桦木科等34 科百余属植物。乔灌木以及一些草本植物主要生成AMF,乔木观赏植物如落叶松、云杉等主要形成ECMF 和AMF,不同植物ECMF形态有较大差异[7]。
我们还发现,忽略样地及植被的差异,ECMF侵染率比DSE要高得多,这可能与菌丝侵染林木根系的方式有关。ECMF是以菌丝在根系表面形成致密的菌套,同时在根系皮层细胞外形成哈蒂氏网,代替根毛摄取营养并供给植物。而DSE 菌丝要侵入根部皮层细胞,形成微菌核结构,有明显的隔膜。微菌核是由细胞壁加厚的膨大的细胞紧密堆积形成,形状大小不一。ECMF 菌丝不伸入植物皮层细胞内部,侵染植物根系较容易。
不同地区的侵染率也存在较大差异,这可能与土壤理化性质有关。杨韧等在研究陕北不同地区根际真菌的资源与分布以及与土壤理化性质关系中发现,菌根侵染率和油松根部真菌资源分布受不同土壤理化性质的影响,其中ECMF和DSE侵染水平与多数土壤理化性质显著相关[8]。方燕等研究丛枝菌根真菌时也发现土壤有机质和速效氮对菌根侵染率的影响呈正效应[9]。因此土壤理化性质是影响侵染率的重要因素之一。褚洪龙等研究表明不同样区的真菌群落多样性和土壤酶活存在差异,土壤含水量与真菌群落多样性和土壤酶活密切相关[10]。总之,自然条件下土壤中各种营养元素与有机质含量是影响菌丝侵染状况的重要因素,菌根真菌对植被侵染的强弱受土壤各种理化性质的限制,从而导致4个样地间侵染率存在明显差异。
本研究对于山西大同大学校园植被的维护和种植具有指导意义。同时,该研究对校园ECMF和DSE真菌分离、鉴定和利用提供了研究基础。

