助剂空间分离的TiO2空心结构及其光催化性能研究
霍海玲,张 健,尚建鹏
(山西大同大学化学与环境工程学院,山西大同037009)
光催化反应是利用太阳能的重要途径。通过该反应,将太阳能转化为化学能,可将能源储存在化学键之中,解决能源及环境问题[1-2]。半导体TiO2材料因其廉价环保,性质稳定而被广泛用作光催化反应中的催化剂[3-4],但此催化剂的催化效率常常不高,一个重要的原因即为,在吸收太阳能后,光生电子-空穴的复合现象严重,分离效率差,导致可参与光催化反应的电子和空穴大大减少[5-6]。
为解决这一问题,研究者们做了大量的工作,不同材料间“结”的构建即为一种常见的方法。Sun[7]等人构建了TiO2层和MoS2层的异质结壳层结构,增强了壳内电子和空穴的分离。Guan[8]等制备了n-Bi-VO4@p-Bi2O3空心壳层结构,通过在壳内构建p-n结,有效地提高了电子-空穴分离效率。但是“结”在形成的界面处,通常会引入大量的电子和空穴的复合中心,抑制电子和空穴的良好分离。而采用助催化剂分别对电子和空穴进行捕获(氧化助剂趋向于捕获空穴,而还原助剂趋向于捕获电子),可在不形成界面复合的情况下促进电子和空穴的分离[9]。Colón[10]等合成了还原助剂Pt 和氧化助剂MnOx负载的TiO2与二维C3N4材料,将其用于光催化产氢反应中,展示出了良好的催化活性。然而氧化助剂和还原助剂的随机负载在一定程度上仍不能很好地避免电子-空穴的复合问题。Li[11]等人将还原助剂Pt 和氧化助剂MnOx分别负载于TiO2空心球的内外表面,得到了活性很好的催化剂。
文章参考Li Ang 等人的工作,将还原助剂Au和氧化助剂PbO2分别负载于TiO2壳层的内外表面,形成助剂空间分离的TiO2空心结构催化剂,并以苯甲醇选择性光氧化制取苯甲醛为探针反应,评价其光催化活性。该材料的合成,拓宽了助剂改性催化剂过程中,还原助剂和氧化助剂的选择范围。
1 实验方法
1.1 试剂与仪器
正硅酸乙酯(98.0%)、十一烷(99.0%)(天津市化学试剂一厂),氯金酸(99.9%,西格玛奥德里奇责任有限公司),钛酸四丁酯(99.9%,中国医药集团总公司),硝酸铅(99.0%)、苯甲醇(98.0%)、苯甲醛(98.5%)、甲苯(99.5%)、氨水(25%)(天津市江天化工有限责任公司),聚乙烯吡咯烷酮、水溶性羟丙基纤维素(98.0%,TCI,东京化成工业株式会社),十六烷基三甲基溴化铵(99.0%)、无水乙醇(色谱纯)(天津市光复精细化工研究所)。实验用水为优普超纯水系统所制得的高纯去离子水。
场发射透射电子显微镜(JEM-2100F,日本电子公司),物理吸附仪(TRISTAR 3000,美国麦克公司),荧光光谱仪(F-4600,日本日立公司)。
1.2 光催化剂的制备
1.2.1 目标催化剂的制备
本实验采用以LBL 方法为基础的硬模板法实现,以SiO2为硬模板,具体步骤如下:
1)含Au 前驱体的SiO2硬模板的合成:将30 mL 0.2 g/mL 的氯金酸溶液加入5 mL 去离子水中,与20 mL 乙醇混合均匀。再加入0.4 mL 氨水调节pH,然后分4 次加入含正硅酸乙酯的乙醇溶液(4 × 10-2mol/ L),每次1 mL,间隔30 min。最后一次加完后,搅拌6 h,即可得含有Au 前驱体的SiO2纳米球模板,记为Au-SiO2。
2)TiO2包覆Au-SiO2:将上步反应所得Au-SiO2分散于20 mL乙醇中,加入0.1 g 水溶性羟丙基纤维素和0.1 mL 去离子水,搅拌均匀后,将5 mL 钛酸四丁酯的乙醇溶液(2.84 mol/L)以0.75 mL/min 的速度注入其中,85 ℃搅拌回流100 min,经离心分离后,即可得Au-SiO2@TiO2。
3)SiO2保护层包覆Au-SiO2@TiO2:若无此SiO2保护层,则在下一步焙烧中TiO2壳层极易破碎,无法形成空心结构。为包覆保护层,首先将上步所得Au-SiO2@TiO2分散于 20 mL 乙醇中,加入 0.14 g 聚乙烯吡咯烷酮。搅拌12 h后,离心分离所得产物再分散于20 mL乙醇中。加入5 mL去离子水、0.1 mL正硅酸乙酯、0.4 mL 氨水。再搅拌6 h 后,即可得Au-SiO2@TiO2@SiO2。
4)TiO2晶化、Au颗粒的还原、模板蚀刻:无定形的TiO2需在800 ℃条件下经2 h 的焙烧以形成晶体结构(升温速率:2 ℃/min)。将焙烧过的催化剂在5%H2-95%N2的气体气氛中于500 ℃继续焙烧2 h,以形成Au 纳米颗粒。再将焙烧后的催化剂分散于20 mL 去离子水中,加入1 mL NaOH 溶液(1.67 mol/L),70 ℃反应8 h,蚀刻掉保护层与内部模板SiO2,可形成Au@TiO2空心球结构。
5)PbO2在空心球外表面的选择性负载:该负载是利用光沉积的方式实现的。将Au@TiO2结构的催化剂放于40 mL 0.5 mol/L的Pb(NO3)2与0.5 mol/L NaIO3溶液中,紫外光照。TiO2壳层被激发出电子和空穴,电子被内表面上Au 颗粒吸引,进而被NaIO3反应消耗掉,外表面附近形成空穴富集的正电荷层,Pb(NO3)2提供的Pb2+在遇到正电荷时,会被氧化为PbO2。这样,空间上定向位于TiO2外表面的正电荷层最终形成了定向负载于Au@TiO2空心球外表面的PbO2层。最终得到助剂空间分离的Au@TiO2@PbO2空心结构,简写为ATP HSs。
1.2.2 对比催化剂的制备
第1 种对比催化剂为纯TiO2空心球,记为THSs。其合成过程与1.2.1 中所述的ATP HSs 的合成方法类似,不同点在于第1 步合成SiO2模板时不加氯金酸,以及将第5步去掉,其他方法完全相同。
第2 种对比催化剂为异种助剂没有空间分离的、随机分布于TiO2空心球内外表面的结构。其过程是以T HSs 为基底,使用浸渍法合成的。具体来说,直接将100 mg T HSs浸渍于40 mL去离子水中,加入30 mL 0.2 g/mL的氯金酸,超声分散后搅拌5 h,所得产物干燥后,置于5%H2-95%N2的气流中,在500 ℃条件下还原2 h。此后,将还原后的粉末放于40 mL 0.5 mol/L的Pb(NO3)2与0.5 mol/L的NaIO3溶液中,并给予紫外光照。由于Au 的分布不再具有空间聚集性,产生的电子和空穴在内外表面均有分布,所氧化出的PbO2粉末也会在空心结构内外表面均有分布。此种结构记为T/A/P HSs。
1.3 光催化苯甲醇氧化制取苯甲醛测试
光催化苯甲醇选择性氧化制取苯甲醛的反应采用自制双层带夹套石英反应器,向其中加入30 mg催化剂、5 mL甲苯、50 mL苯甲醇和40 mL十一烷,通入O2,置于300 W 氙灯下采用紫外光照射。反应过程中通冷却水进行冷却。反应产物通过气相色谱进行检测。
2 结果与讨论
2.1 催化剂的表征
2.1.1 目标催化剂的TEM表征
为确认ATP HSs 的结构,实验结合TEM、EDS线扫和面扫技术对催化剂进行了表征,结果如图1。
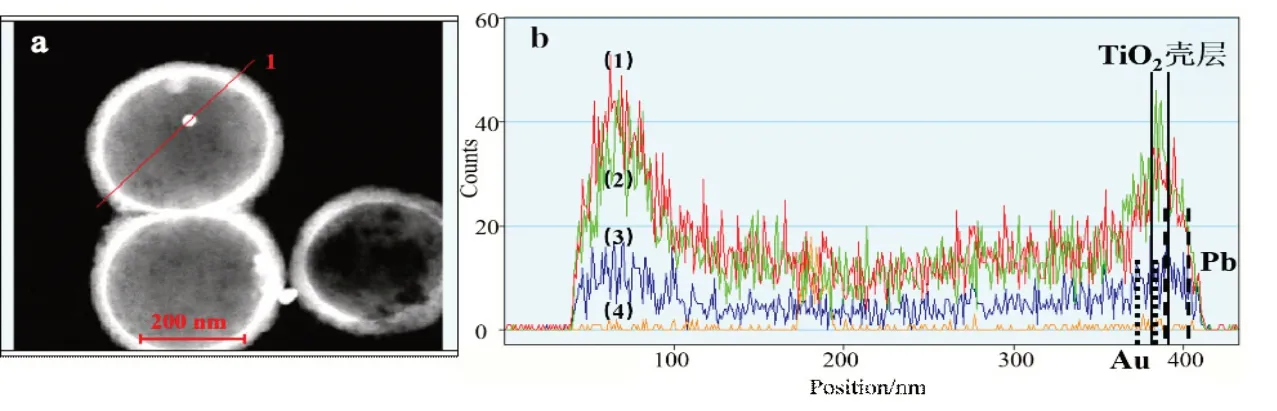
图1 目标催化剂ATP HSs的表征结果
从目标催化剂的暗场TEM可以看出,壳层与中间结构对比强烈,明显展示出了催化剂的空心结构。同时,球形空心结构内部,均匀分布着一些小颗粒,空心球外侧为粗糙的结构。进一步对球形颗粒按照图1a中直线所示的路径,进行了线扫分析,结果如图1b。沿线扫路径方向,曲线明显呈现两端凸起、中间凹陷的走势,表明所得结构为典型的空心壳层结构,凸起部位为壳层部分,凹陷部位为空心部位。对图1b 中右侧凸起部位进一步分析可以看到:曲线(2)最高峰左右的位置对应为TiO2壳层,见图中双实线所示区域;曲线(3)最高峰位置,见图中双长虚线所示,在TiO2壳层的外侧,表明PbO2在壳层外侧负载;曲线(4)最高峰位置,见图中双短虚线所示,在TiO2壳层的内侧,表明Au在壳层内侧负载。从而证明了球形催化剂内部小颗粒为Au颗粒,外部粗糙结构为PbO2,目标催化剂为Au 颗粒在内、PbO2在外负载的TiO2空心结构。
进一步对目标催化剂按图2a 中方框区域,进行EDS 面扫测试,所得元素的信号分布如图2b~d所示,对比图2c 和2d,可以看出,Pb 元素信号的分布范围比Ti 元素信号更大,说明PbO2位于TiO2层的外侧。
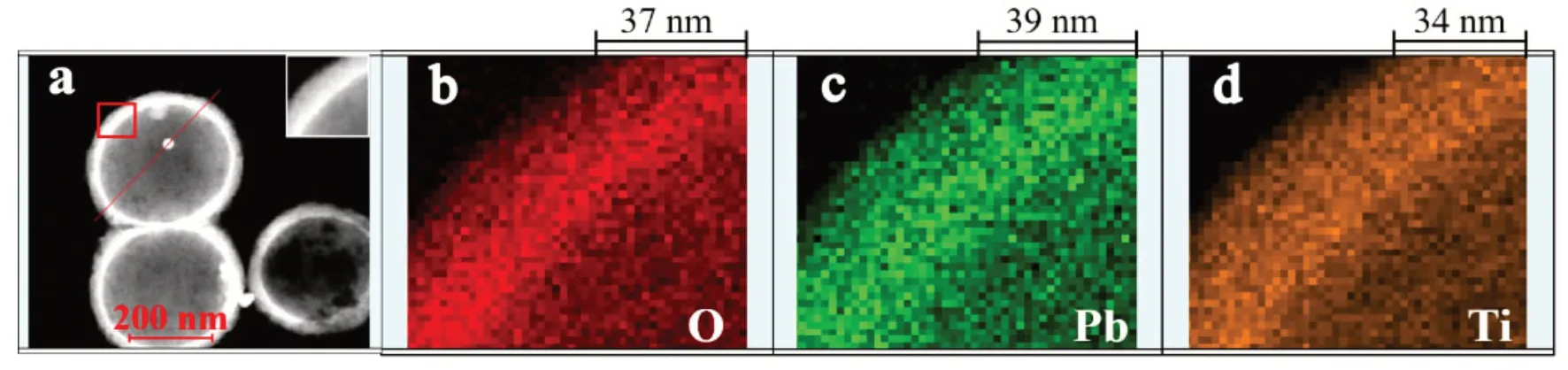
图2 目标催化剂ATP HSs的暗场TEM图像及面扫区域图
2.1.2 目标催化剂的BET表征
为表征目标催化剂ATP HSs的表面性质,对其进行了N2物理吸附的测试,结果如图3。可以看出,ATP HSs 的比表面积高达302 m2/g。大比表面积为反应底物提供了充分的吸附位点,也为助催化剂的负载提供了大量的位点,十分有利于表面反应效率的提升。孔结构的分析结果显示,平均孔径为5.3 nm,且在等温吸脱附线上出现了明显的回滞环,说明催化剂为介孔材料,且介孔的尺寸远大于反应底物、中间产物、反应产物等化学物质的尺寸,因此对化学物质的跨壳运输不会产生明显的阻碍作用,有利于光催化反应的进行。

图3 目标催化剂ATP HSs的N2物理吸附结果
2.2 催化剂的载流子复合情况
为显示不同催化剂的载流子分离效率,对目标催化剂ATP HSs与对比催化剂T HSs、T/A/P HSs进行了荧光光谱的表征,结果如图4。
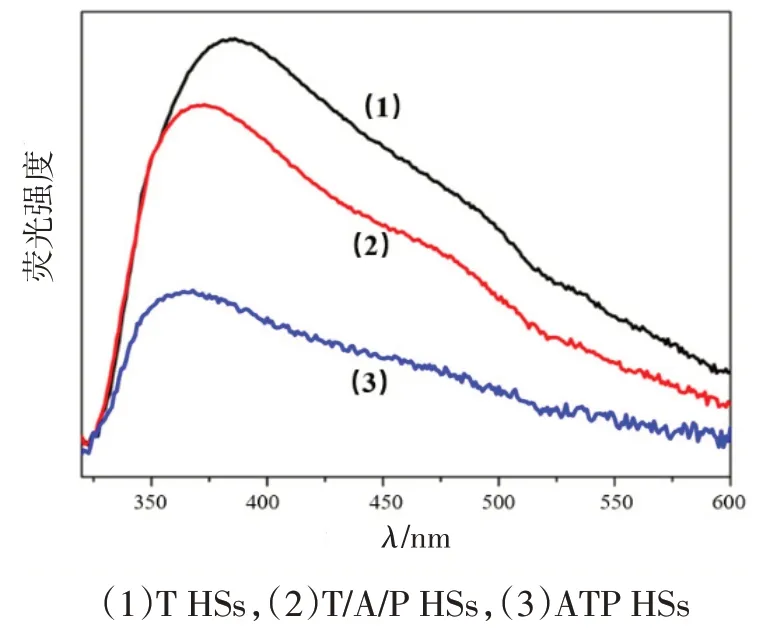
图4 不同催化剂的荧光光谱曲线
由荧光光谱原理可知,荧光强度越高,说明电子和空穴复合现象越严重,则其分离效率越低。在负载了助催化剂形成T/A/P HSs 结构后,荧光强度有了一定的减弱,电子-空穴的复合得到了一定的抑制。这是因为不同的助剂可以分别捕获电子和空穴,可以在一定程度上减弱载流子的复合。但是,由于助剂的随机散乱分布,载流子在被捕获的过程中会随机移动,在此过程中容易相遇,发生复合现象。而对于ATP HSs结构的催化剂,荧光强度最弱。由于不同助剂在空间上分离开来,可引导电子和空穴分别向不同方向整体移动,从而大大降低了其相遇概率,提高了其分离效率。
2.3 光催化苯甲醇选择性氧化活性测试
将目标催化剂ATP HSs与各对比催化剂T HSs、T/A/P HSs 用于苯甲醇选择性氧化制取苯甲醛的测试反应中,所得结果如图5。可以看出,反应14 h后,在没有催化剂存在的情况下(图5a),苯甲醛的产率很低,仅约为50μmol / gcat。当使用目标催化剂,但不用光源进行照射时(图5b),苯甲醛的产率同样非常低,表明光能的驱动是此反应进行的必要条件,即此反应确为光催化反应。在光照情况下,可以发现,当T HSs 催化剂加入时(图5c),苯甲醛的产率有一定的提升,约为400μmol / gcat,说明T HSs 催化剂对反应的进行有着一定的作用。而当使用T/A/P HSs 结构的催化剂时(图5d),反应效率有了近一步的提高,苯甲醛的产率升至700μmol /gcat,表明助剂的引入可提高催化剂的活性。最后,当使用目标催化剂ATP HSs时(图5e),苯甲醛的产率最高,可达1 000μmol /gcat,表明还原助剂和氧化助剂的空间分离,可以更大程度地提高催化剂的活性。结合荧光测试结果可知,电子和空穴分离效率的提高可大大促进催化剂的活性,提高反应效率。
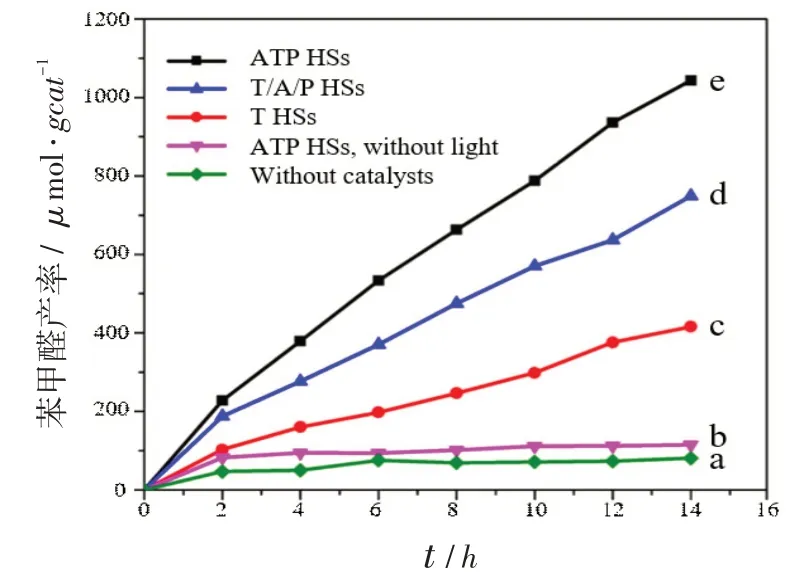
图5 不同条件下苯甲醇氧化制取苯甲醛的结果
3 结论
本实验设计、合成了一种还原助剂Au 和氧化助剂PbO2空间分离的TiO2空心结构催化剂,可使光生电子和空穴分别向着TiO2壳层的内外两个方向迁移,进而提高了电子和空穴的分离效率,促进了催化剂活性的提高;同时该催化剂的空心结构,以及其壳层的介孔结构,使得该催化剂的比表面积增大,可为反应底物的吸附和助剂的负载提供丰富的活性位点。综合作用下,该助剂空间分离的空心结构催化剂展示出了良好的活性。该研究可为其他半导体催化剂活性的改进提供一种思路。

