SHP-2shRNA联合苦参碱对宫颈癌细胞增殖的影响
魏林珍,奉容花,王海琳,
SHP-2是蛋白酪氨酸磷酸酶(protein tyrosine phosphatase, PTPase)家族中的一员,与细胞的生长、增殖、分化及蛋白的磷酸化与去磷酸化的平衡等活动密切相关[1-2]。当机体因某些因素导致体内蛋白的磷酸化与去磷酸化不平衡时,会导致肿瘤恶性的发生。目前,已有研究[3]表明SHP-2与宫颈癌发生密切相关;Tao et al[4]研究证实HPV感染的宫颈癌患者组织中SHP-2高表达。故SHP-2作为肿瘤学靶标已引起了学者对抑制剂作为癌症潜在治疗剂的兴趣。RNA干扰(RNA interference)利用小发夹RNA切割形成的shRNA,其通过慢病毒载体来诱导序列特异的目的基因稳定持久的沉默而发挥效应[5]。苦参是由豆科植物苦参的干燥根中所提取的中药成分,近年来研究中,苦参碱抑制增殖抗肿瘤机制受到极大关注[6]。该研究探讨SHP-2的慢病毒shRNA表达载体与苦参碱联合抗宫颈癌细胞增殖的作用,为后续的研究宫颈癌SHP-2靶向基因与苦参碱联合治疗提供实验依据。
1 材料与方法
1.1 实验材料载体pHBLV-U6-Scramble-ZsGreen-Puro(上海汉恒生物,Hanbio);T4连接酶(加拿大,Fermentas);凝胶回收试剂盒(美国,Axygen);大肠杆菌菌株DH5α(美国,Invitrogen);限制性内切酶EcoRI和BamHI(Fermentas);琼脂糖、DNA ladder(加拿大,Fermentas);琼脂粉(上海生工);包装细胞293T细胞株(美国,The Global Bioresource Center);胎牛血清、胰蛋白酶、DMEM(美国,Invitrogen);质粒DNA大抽提取试剂盒(德国,Qiagen);LipofiterTM(上海汉恒生物,Hanbio);0.45 μm滤器(美国,Millpore公司);苦参碱[(宝鸡市方晟生物开发有限公司(纯度98%)]。
1.2 方法
1.2.1靶向SHP-2基因的寡核苷酸设计 SHP-2基因靶向shRNA干扰序列设计与合成根据GenBank中SHP-2的基因序列(Accession Number; NM 129844.5)和shRNA序列表达载体pHBLV-U6-Scramble-ZsGreen-Puro的要求设计3段RNA干扰序列和1段阴性对照序列,依次命名为SHP-2 shRNA1、SHP-2 shRNA2、SHP-2 shRNA3和NS。而后依据以上4段序列分别设计合成4对寡核苷酸序列(表1)。4 对寡核苷酸序列经退火后均可在5′端含EcoRI酶切位点,3′端含BamHⅠ酶切位点。
1.2.2慢病毒表达载体pHBLV-U6-Scramble-ZsGreen-Puro的构建、扩增和鉴定 将pHBLV-U6-Scramble-ZsGreen-Puro载体用EcoRI和BamHI进行双酶切,酶切产物回收后与合成的寡核苷酸退火产物按照比例混合,然后依照 T4 DNA 连接酶试剂盒说明书,4 ℃连接过夜。连接产物加入DH5α感受态细菌中转化,Amp筛选培养,挑取单菌落扩大培养,提取质粒DNA后进行DNA测序。测序正确后分别命名为pHBLV-SHP-2 shRNA1、pHBLV-SHP-2 shRNA2、pHBLV-SHP-2 shRNA3、阴性对照。
1.2.3慢病毒的包装 将慢病毒重组质粒和包装质粒按照 LipofiterTM转染试剂说明书转染细胞,简述如下:制备慢病毒穿梭质粒及其辅助包装原件载体质粒,进行无内毒素高纯度抽提后转染293T细胞,转染6 h后更换培养基,培养48 h和72 h后,收集富含慢病毒颗粒的细胞上清液过滤病毒上清液,浓缩之后得到高滴度的慢病毒浓缩液。
1.2.4重组慢病毒的滴度测定 应用稀释计数法测定各组病毒的滴度。第1天,将对数期生长状态好的293T细胞进行消化,稀释计数后至500×104/ml, 加入96孔板,并保持100 μl/孔,每个孔有6个复孔。放入37 ℃、5% CO2培养箱中培养。第2天,在EP管中做3倍梯度稀释,连续6个稀释度。用荧光显微镜观察实验结果,在含10%~30%孔的荧光细胞计算病毒滴度。滴度(TU/ml)=细胞数×百分比×MOI(1)×病毒稀释倍数×103。
1.2.5细胞培养 人宫颈癌Hela细胞由兰州大学基础医学研究院提供。复苏冻存的Hela细胞,培养于DMEM 培养基(含10% FBS ),加入1%青霉素和1%链霉素。放入 25 cm2培养瓶,37 ℃、5% CO2培养箱中培养。每1~2 d换液1 次,待细胞85%~90%融合成单层后以0.25%胰酶消化传代。
1.2.6感染Hela细胞检测重组慢病毒干扰效率 取对数生长期的Hela细胞按 1×105/ml 接种于6孔板中,次日待Hela生长至90%左右融合时,加入浓缩的慢病毒10 μl的同时加入 polybrene(终浓度为7 μg/ml)以提高病毒感染效率。24 h后更换为含puromycin 1 μg/ml的完全培养基以筛选细胞,同时以正常细胞株作为对照,puromycin处理48 h,观察细胞的死亡情况,选取能够杀死全部细胞的最低浓度。本实验中能够杀死Hela空细胞的最低puromycin浓度为1 μg/ml。待传代后的细胞在大皿中长至60%,以摸索到的puromycin浓度处理48 h,48 h后Hela细胞的融合率不到80%~90%,换新鲜的puromycin的培养基继续处理。筛完2次puromycin的细胞长满后按1 ∶3的比例传代,待传代后的细胞长满,用于收样做后续检验。
1.2.7RT-PCR测定SHP-2 mRNA 有效干扰慢病毒载体TRIzol法提取慢病毒感染的Hela 细胞总RNA,逆转录试剂盒逆转录cDNA,实时荧光定量PCR 检测Hela细胞内SHP-2 mRNA表达水平,内参为GAPDH。反应条件:95 ℃预变性15 min,95 ℃、5 s,64 ℃退火30 s,40个循环。引物序列由上海生工生物公司合成;SHP-2 上游引物:5'-CCGGACAGGGACGTTCATT-3';下游引物:5'-TGCTTCTGTCTGGACCATCC- 3';hGADPH 上游引物:5'-CGCTCTCTGCTCCTCCTGTT-3';下游引物:5'-CCATGGTGTCTGAGCGATGT'。
1.2.8CCK8法检测感染后细胞生长活性 实验分组如下:空白对照组、 苦参碱(1 mg/ml)组、SHP-2 shRNA组、 SHP-2 shRNA+苦参碱(1 mg/ml)组。取后对数生长的感染的宫颈癌细胞,用胰酶消化,以1×104/孔接种于96孔板,每个时间点设5个复孔, 生长24 h后吸净培养孔内原培养液, 各组分别加入试剂, 继续孵育24、48、96 h。弃去培养基, 加入100 μl新鲜培养基冲洗后,再加入10 μl CCK8试剂, 避光孵育2 h, 计算每孔细胞的OD值,连续检测96 h,绘制细胞生长曲线。
1.2.9Western blot法检测SHP-2蛋白的表达 分别提取各组细胞总蛋白,经95 ℃、10 min 变性处理的样品进行 SDS-PAGE 电泳,采用半干法进行转膜;5%(W/V)的脱脂奶粉溶液封闭,分别加入SHP-2 小鼠单克隆抗体(1 ∶2 000),GAPDH小鼠单克隆抗体(1 ∶1 000),4 ℃过夜;次日加入 HRP 标记山羊抗小鼠Ig G,用37 ℃摇床孵育 2 h;ECL 化学底物发光法显影,Image Lab 4.0软件进行图像灰度分析,计算 SHP-2 蛋白相对表达量用其与GADPH的灰度比值表示。
2 结果
2.1 慢病毒表达载体慢病毒表达载体pHBLV-U6-Scramble-ZsGreen-Puro载体酶切后重组合成的pHBLV-SHP-2 shRNA的DNA测序结果将重组阳性克隆菌液送上海铂尚生物技术有限公司测序,测序结果显示所构建的慢病毒表达载体均含有所设计的目的片段,其序列与设计的靶向 SHP-2寡核苷酸序列与阴性对照序列完全一致,表明目的片段已正确插入pHBLV慢病毒载体,重组慢病毒载体构建成功。见图1。
2.2 重组慢病毒的包装三质粒慢病毒共同转染293T细胞后,细胞出现了融合现象,用荧光显微镜下观察,重组质粒细胞出现较强的绿色荧光(图2),并计算病毒原液滴度 :病毒滴度(TU/ml)= 荧光细胞个数×1 000/每病毒原液量(μl)。转染效率高,病毒包装成功。
2.3 慢病毒载体转染HeLa细胞及qRT- PCR干扰效率筛选病毒感染细胞后经puromycin筛选后,细胞生长状态良好,形态学无明显变化,且能稳定表达绿色荧光(图3)。各组慢病毒感染Hela细胞48 h后,细胞生长状态良好,转染效率较高。Real-time PCR检测结果显示:hGAPDH和SHP2溶解曲线较好,证明RNA抽提和QPCR过程无问题。两组shRNA干扰后,SHP2在Hela细胞中的表达量较空白载体组显著降低(图4), SHP-2 shRNA2的沉默效果最佳(下调效率约达到94%),因此选其干扰效果较好的载体行后续实验。
2.4 慢病毒载体转染后Hela生长率SHP-2 shRNA2稳定转入Hela细胞,培养24、48和72 h后,CCK8法检测96 孔板各孔的光密度值,计算细胞的增殖抑制率分别:(6.13±1.12) % 、(15.16±1.44) % 和(19.16±1.98)%;与对照组相比,在处理后的第48 h开始出现差异(P<0.05)。实验同时显示苦参碱对人宫颈癌细胞株 Hela的生长抑制呈时间依赖模式。
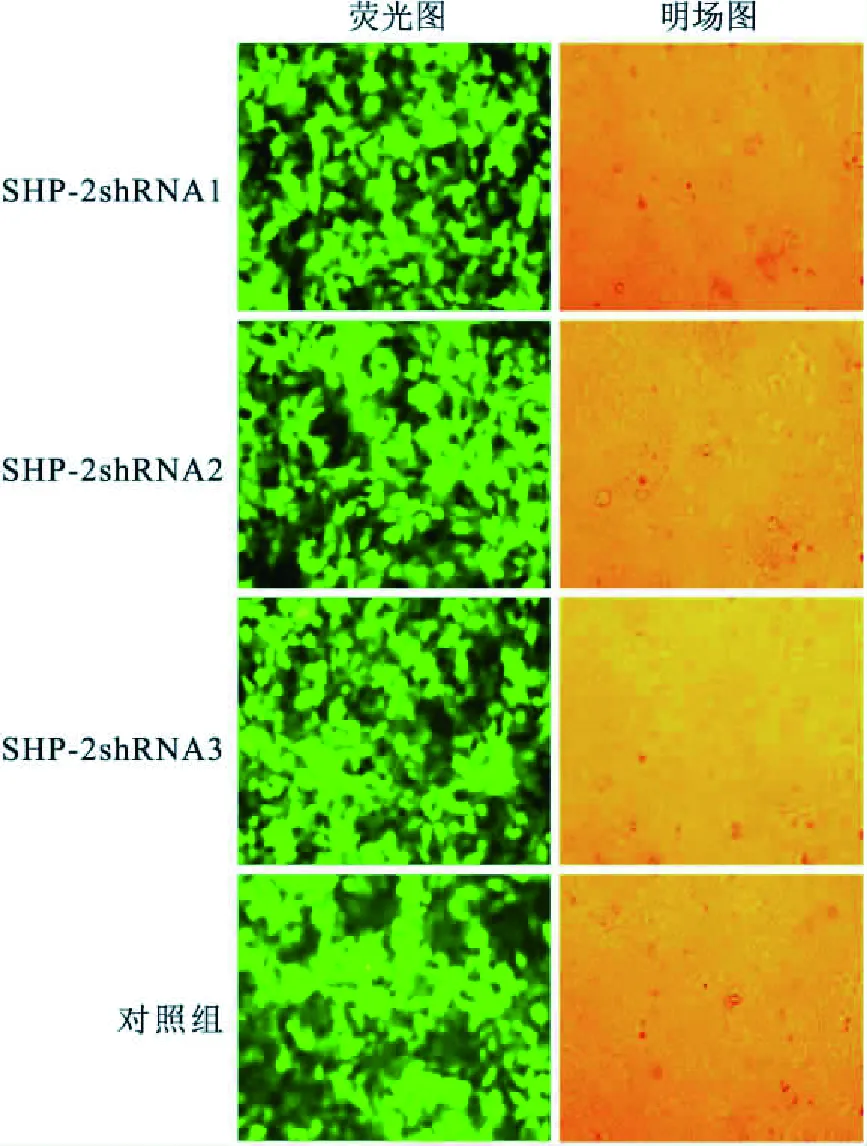
图2 包装有重组慢病毒SHP-2shRNA的293T细胞 ×100
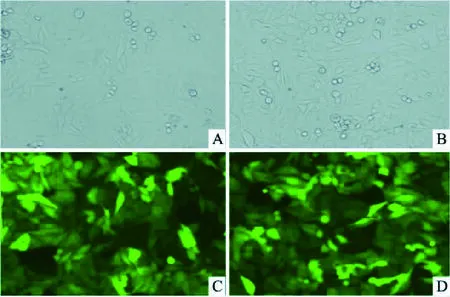
图3 重组病毒以MOI=10感染HeLa细胞后的感染效果 ×100A、B:光学显微镜;C、D:荧光显微镜;A、C:对照组; B、D:SHP-2 shRNA
进一步采用shRNA质粒使宫颈癌HeLa细胞SHP-2基因沉默,同时加入苦参碱(0.5 mg/ml),检查两者联合对宫颈癌细胞的增殖。结果表明联合用药后增殖抑制率均明显低于单药应用组(表2)。推测可能沉默SHP2基因的表达联合苦参碱可能会协同抑制 Hela细胞的增殖。
表2 不同浓度苦参碱对Hela细胞增殖抑制率的影响
与对照组比较:*P<0.05
2.5 SHP2 shRNA2稳转Hela 细胞内SHP2 蛋白水平表达结果显示:SHP2 蛋白水平表达较空载质粒对照组显著降低,表达水平分别为对照组(1.15±0.435),SHP2沉默组(0.58±0.132)(P<0.05)。见图5。
3 讨论
当前研究[7]表明,肿瘤细胞依赖于肿瘤微环境。肿瘤微环境能促进肿瘤细胞生长,破坏免疫监视。肿瘤细胞与肿瘤微环境中的支持细胞通过多种信号通路进行交流。这些信号通路不仅涉及蛋白激酶的调节,而且涉及蛋白磷酸酶的失调。由蛋白酪氨酸激酶和蛋白酪氨酸磷酸酶相互协调维持的酪氨酸磷酸化的稳定,对于广泛的细胞过程至关重要。异常的酪氨酸磷酸化与许多人类疾病(包括癌症)的发病机制相关[8],这表明蛋白酪氨酸磷酸酶可能是癌症治疗的创新分子靶标。
SHP-2 属于蛋白酪氨酸磷酸酶家族成员之一, 其与多种疾病包括肿瘤的发生和发展密切相关[9]。其N末端含有两个Src同源结构域2(Src homology 2,SH2), C末端含有其催化结构域。其遍及于各种细胞的细胞质中,处于非活性状态,而当与细胞膜上的底物结合后活化而发挥生物学作用。尽管现阶段SHP-2在信号通路中的精确作用和下游靶点还不是很清楚,但它对细胞运动既可起到正反馈调节作用也可以起到负反馈调节作用。虽然SHP-2与多种肿瘤的发生有密切相关[10-12],但是SHP-2 在宫颈癌的致病、转移、耐药等多个环节的具体作用机制不尽相同,有待深入研究。
病毒载体是一种以HIV为基础发展而来的复制缺陷型逆转录病毒载体[13], 与质粒介导的 RNAi相比,它具有转染效率高、转移基因片段容量较大等优势,最大的优点是能够将遗传物质整合到宿主的基因组, 并使其长时间在宿主细胞稳定表达,是携带干扰RNA的理想载体[14]。
近年来研究表明苦参碱对多种肿瘤细胞都具有抑制增殖和诱导凋亡的作用[15],本课题前期研究结果显示苦参碱作用后宫颈癌HeLa细胞后,随着HeLa凋亡增加SHP-2表达增加,提示SHP-2与宫颈癌HeLa细胞增殖凋亡有一定的相关性。本课题组利用前期研究工作,设计了3 个SHP-2基因的干扰靶点, 分别将其连接在表达puromycin 和Amp的慢病毒载体pHBLV-U6-Scramble-ZsGreen-Puro上,进一步包装病毒从而得到SHP-2 shRNA慢病毒载体。用Real-time PCR结果筛选出慢病毒感染HeLa细胞后干扰效率较高的病毒载体,采用Western blot验证细胞内SHP-2的表达水平显著降低。本研究通过SHP-2沉默后苦参碱对细胞凋亡明显增加,提示 SHP-2基因沉默与苦参碱对宫颈癌的生长凋亡有一定的影响。SHP-2基因对宫颈癌生长凋亡、转移的具体机制及模型动物的基因治疗需要在后续研究工作中进一步探讨和研究。
——一道江苏高考题的奥秘解读和拓展

