胰腺癌细胞ezrin基因转录调控区及其gRNA靶位点鉴定
代基强,野庆松,白圣凯,张青峰,高书颖
0 引 言
胰腺癌是常见的胰腺肿瘤,约90%为起源于腺管上皮的导管腺癌,其恶性程度很高,诊断和治疗困难,5年生存率低于1%。胰腺癌蛋白表达谱的生物信息学分析数据显示,在98种表达上调蛋白的相互作用网络中,Ezrin为连接度最高两种蛋白之一[1-2]。Ezrin蛋白在胰腺癌的形态、非锚定依赖性生长、运动以及侵袭转移过程中发挥重要作用,其过表达预示着胰腺癌的不良预后,有望成为胰腺癌的预后指标[3-4]。胰腺导管腺癌细胞Ezrin的敲低,降低克隆生长、自我更新、细胞迁移、体外肿瘤干细胞发生率和体内肿瘤的发生,针对Ezrin蛋白表达的干预有可能成为控制胰腺癌侵袭转移的一个新的治疗靶点[5]。然而,有关胰腺癌细胞ezrin基因转录调控区及其调控机制的研究未见报道。本研究拟鉴定胰腺癌Panc-1细胞ezrin基因转录调控区;设计ezrin转录调控区gRNA靶位点,检测转染携带gRNA序列的基因编辑重组质粒对靶位点的切割作用以及对胰腺癌细胞增殖能力的影响,为进一步研究胰腺癌细胞ezrin基因的转录调控机制奠定基础。
1 材料与方法
1.1 质粒、细胞及主要试剂胰腺癌Panc-1细胞购自中国科学院上海细胞库;基因编辑骨架质粒pSpCas9(BB)-2A-GFP(Addgene plasmid ID:48138,简称pX458)和pSpCas9(BB)-2A-Puro(Addgene plasmid ID:48139,简称pX459)由Addgene提供;质粒pGL3-basic、pGL3-promoter和pRL-TK购自Promega公司;感受态细菌DH5α由本实验室保存;质粒抽提及PCR纯化回收试剂盒购自Axygen公司;双荧光荧光素报告基因检测系统购自Promega公司;LipofectamineTM2000转染试剂购自Invitrogen公司;Guide-it mutation detection kit购自Clontech公司;BbsI核酸内切酶购自NEB公司;pMD18-T载体、T4 DNA连接酶、PCR Mix、Premix WST-1 细胞增殖检测试剂盒购自Takara公司;胎牛血清、DMEM培养基和Opti-MEM培养基购自Gibco公司;引物合成和测序由Lifetech公司完成;携带ezrin基因上游片段的报告基因表达载体由本实验室构建[6]。
1.2细胞培养及报告基因表达载体瞬时转染人胰腺癌Panc-1细胞在含10%灭活胎牛血清的DMEM培养基中贴壁生长,用含0.25%胰蛋白酶和0.02% EDTA的消化液消化细胞,进行传代培养。质粒转染前1d,将处于对数生长的细胞接种至96孔细胞培养板中,细胞融合度为60%~80%时,采用LipofectamineTM2000对细胞进行瞬时转染,具体转染步骤参照转染试剂说明书进行。将表达萤火虫荧光素酶的报告基因质粒分别与表达海肾荧光素酶的内参照质粒pRL-TK按100∶1混合,即1 μg∶0.01 μg。96孔细胞培养板中每孔的质粒转染量为200 ng。每组样品设置3个平行孔,实验重复3次。
1.3双荧光素酶活性检测细胞转染报告基因表达载体48 h后,收集细胞裂解液,参照双荧光素酶报告基因分析系统操作手册进行荧光素酶活性检测,在多功能酶标仪上读取荧光值,计算各组转染细胞的相对荧光素酶活性,即:萤火虫荧光素酶/海肾荧光素酶,以此代表启动子的转录活性。
1.4基因编辑gRNA靶位点预测利用在线软件http://www.e-crisp.org/E-CRISP/预测ezrin转录调控区(-1297/-1186)两侧的gRNA靶位点,gRNA-L:5′-ACTTGCATCTGCGAGGGGAG-3′,gRNA-R:5′-GGTCCCGGGACCCGCCCCGC-3′,Cas9核酸内切酶切割位点NGG分别位于gRNA-L上游和gRNA-R下游。
1.5基因编辑重组质粒的构建合成gRNA-L和gRNA-R序列对应的互补寡核苷酸链,在每对互补序列的正向寡核苷酸链的5′端添加CACC,反向寡核苷酸链的5′端添加AAAC,使其退火后形成的末端与BbsⅠ酶切后形成的黏性末端互补。将gRNA-L序列对应的杂交双链DNA与质粒pX459连接,gRNA-R序列对应的杂交双链DNA与质粒pX458连接,连接产物转化大肠埃希菌DH5a感受态细胞,在氨苄青霉素抗性平板上筛选阳性克隆,测序鉴定重组质粒。
1.6重组质粒转染及gRNA靶位点鉴定将胰腺癌Panc-1细胞接种于96孔细胞培养板,当细胞汇合率为60%~80%时,共转染基因编辑重组质粒,转染步骤参照LipofectamineTM2000转染试剂说明进行。转染质粒24 h后,在荧光显微镜下观察细胞绿色荧光并拍照。
重组质粒转染Panc-1细胞48 h后,不经嘌呤霉素抗性筛选直接收取细胞,直接提取细胞基因组DNA,扩增目的片段。PCR引物位于gRNA-L靶位点上游和gRNA-R靶位点下游,序列如下,PCR-F:5′-CACAAACGTGCCACTTAACCA-3′;PCR-R:5′-AACCGTCAAGCCTTTGAGAAA-3′。将PCR扩增产物与pMD18-T载体连接,转化大肠埃希菌DH5a感受态细胞,在氨苄青霉素抗性平板上筛选阳性克隆。随机取8个克隆进行菌落PCR和亚克隆测序鉴定。
1.7细胞增殖能力检测基因编辑重组质粒转染Panc-1细胞48 h后,向培养基中加入终浓度为5 μg/mL的嘌呤霉素进行初步筛选,72 h后,更换为正常培养基。取处于对数生长期的转染细胞与对照细胞,制备密度为2.2×104/mL的细胞悬液,接种至96孔细胞培养板(100 μL/孔),于37 ℃、5% CO2的培养箱中培养72 h。期间每隔12小时更换为含Premix WST-1试剂的培养基(Premix WST-1∶培养基=1∶10),继续孵育培养4 h,通过酶标仪检测各孔在440 nm波长下的吸光度(A)值,以时间(t)为横坐标,以A值为纵坐标绘制细胞增殖曲线。每组样品设置3个平行孔,实验重复3次。

2 结 果
2.1ezrin基因-1297/-1186片段具有转录调控作用ezrin基因上游片段的荧光素酶报告基因检测显示质粒pGL3-promoter携带SV40启动子,pGL3-P(SV40)-hE(-1297/-1186)同时携带SV40启动子和ezrin基因-1297/-1186片段,pGL3-hE(-87/+134)携带ezrin基因-87/+134片段作为报告基因启动子,pGL3-P(hE)-hE(-1297/-1186)同时携带ezrin基因-87/+134片段和-1297/-1186片段,pGL3-Basic不含启动子。胰腺癌Panc-1细胞中,当ezrin基因-1297/-1186片段与SV40启动子或ezrin启动子同时存在时,相对荧光素酶活性显著增加,-1297/-1186片段对启动子具有转录增强调控作用,为ezrin基因转录调控区。见图1。
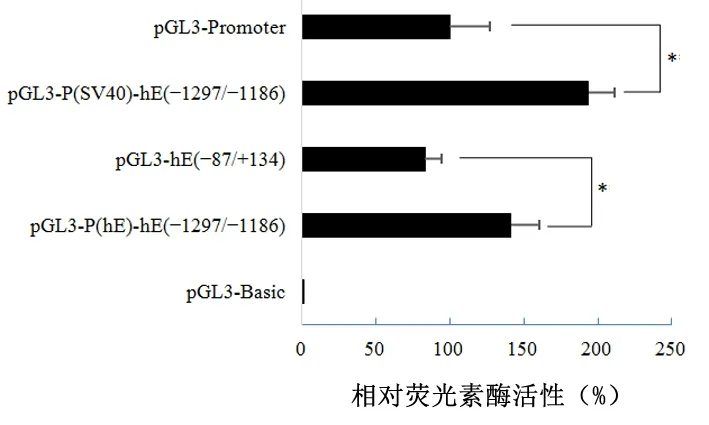
*P<0.01
图 1 Panc-1细胞中ezrin基因-1297/-1186片段的转录调控作用
Figure1Transcriptionalregulationofezrin-1297/-1186fragmentinPanc-1cells
2.2ezrin转录调控区基因编辑重组质粒的构建重组质粒测序结果显示,gRNA-L序列和gRNA-R序列分别与载体pX459和pX458定向连接,携带ezrin转录调控区gRNA靶位点序列的基因编辑重组质粒构建成功,分别命名为pX459-sgRNA-L和pX458-sgRNA-R。见图2。
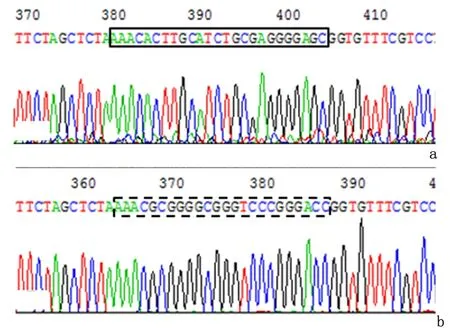
a:pX459-sgRNA-L,实框内为gRNA-L序列;b:pX458-sgRNA-R,虚框内为gRNA-R序列
图 2ezrin转录调控区基因编辑重组质粒的测序鉴定
Figure2Sequencingidentificationofgeneeditingrecombinantplasmidforezrintranscriptionalregulatoryregion
2.3基因编辑重组质粒共转染Panc-1细胞重组质粒pX459-sgRNA-L和pX458-sgRNA-R共转染Panc-1细胞24 h后,在荧光显微镜下观察到部分细胞显示绿色荧光,见图3。结果表明携带绿色荧光标记的质粒pX458-sgRNA-R成功进入Panc-1细胞,与之有着相似结构的pX459-sgRNA-L提示转染成功,但需要进一步鉴定。

a:荧光成像;b:相差成像
图 3 镜下观察共转染重组质粒的Panc-1细胞( ×100)
Figure3MicroscopicobservationofPanc-1cellsco-transfectedwithrecombinantplasmids(×100)
2.4ezrin转录调控区gRNA靶位点鉴定共转染基因编辑重组质粒的Panc-1细胞基因组DNA亚克隆PCR产物电泳结果见图4。克隆CL-2和CL-3的PCR产物介于750 bp和500 bp之间,与ezrin转录调控区靶向敲除的预计扩增结果一致;克隆CL-1、CL-4~CL-8的PCR产物接近750 bp,与未突变基因组DNA的预计扩增结果一致。转染重组质粒后,由于未进行嘌呤霉素抗性筛选,会同时存在缺失和未缺失DNA的细胞。缺失DNA片否位于ezrin转录调控区gRNA-L和gRNA-R靶位点之间,需要进一步测序鉴定。
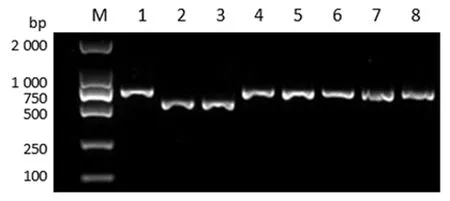
M:Marker;1-8:克隆CL-1~CL-8
图 4 Panc-1转染细胞基因组DNA的亚克隆PCR电泳检测
Figure4SubclonalPCRelectrophoresisdetectionofgenomicDNAintransfectedPanc-1cells
亚克隆测序的序列比对分析结果显示EZR为未缺失转录调控区的对照序列,在检测8个克隆中,CL-2和CL-3缺失片段位于gRNA-L和gRNA-R靶位点之间,为ezrin转录调控区;其余6个克隆未出现缺失突变,见图5。CL-3和CL-6的部分测序结果显示gRNA-L和gRNA-R靶位点之间序列的定向敲除,说明质粒pX459-sgRNA-L和pX458-sgRNA-R转染成功,所表达的导向RNA和核酸内切酶Cas9能够识别并切割目标序列。序列比对分析中,在gRNA位点以外的个别碱基不同可能源于PCR引入的突变或SNP。见图6。由此可见,本研究预测的ezrin转录调控区gRNA位点,可作为基因编辑靶点,实现胰腺癌Panc-1细胞ezrin转录调控区的靶向敲除。
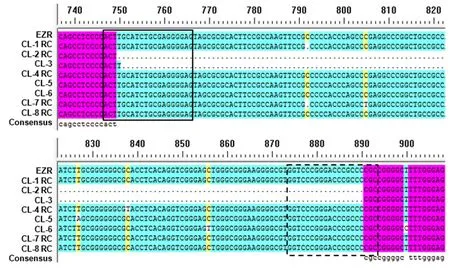
实框内为gRNA-L序列;虚框内为gRNA-R序列
图 5 Panc-1转染细胞基因组DNA的亚克隆序列比对分析
Figure5SubclonesequencealignmentofgenomicDNAintransfectedPanc-1cells
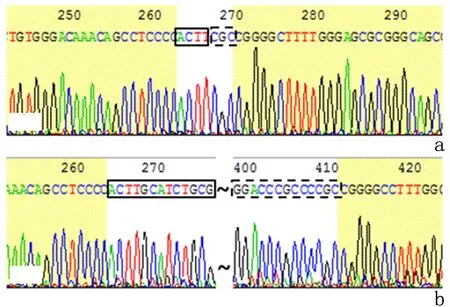
a:克隆CL-3测序图;b:克隆CL-6测序图实框和虚框内分别为残存的gRNA-L和gRNA-R序列
图 6 Panc-1转染细胞的基因组DNA亚克隆测序图
Figure6SubclonesequencingprofileofgenomicDNAintransfectedPanc-1cells
2.5共转染基因编辑重组质粒抑制Panc-1细胞增殖细胞增殖实验结果显示,与Panc-1细胞相比,共转染重组质粒经嘌呤霉素初步筛选的细胞,其增殖速率在细胞培养24、36、48、60和 72 h 时均显著降低(P<0.01)。可见,转染基因编辑重组质粒可抑制Panc-1细胞增殖,这种抑制作用有可能与ezrin转录调控区的缺失有关。见图7。
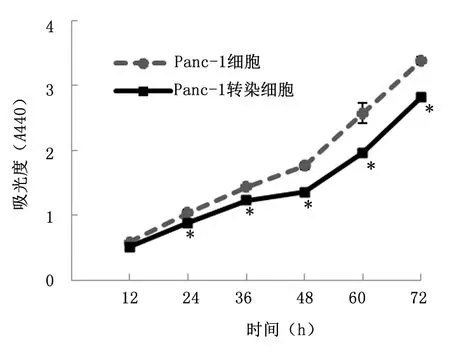
与Panc-1 细胞比较,*P<0.01
图 7 转染重组质粒抑制Panc-1细胞的增殖
Figure7ProliferationofPanc-1cellswasinhibitedbyrecombinantplasmidstransfected
3 讨 论
ezrin基因又称VILⅡ,其编码产物Ezrin蛋白在胰腺癌、胃癌、鼻咽癌等多种肿瘤中存在异常表达现象,其表达上调与肿瘤细胞的移动侵袭相关,被认为是肿瘤相关基因[3,7-8]。前期研究中,我们发现ezrin基因编码区上游序列可能对于Ezrin蛋白在肿瘤细胞中的高表达起重要调控作用[6,9]。在人食管癌细胞中,靶向ezrin增强子及其关键区的基因编辑载体,能够实现目标序列的定向敲除,敲除ezrin增强子的食管癌细胞Ezrin蛋白表达下调,细胞增殖和迁移能力受到抑制[10-11]。在前期工作基础上,本研究采用双荧光素酶报告基因检测系统,鉴定胰腺癌Panc-1细胞的ezrin转录调控区,发现ezrin基因-1297/-1186片段具有转录增强作用,这与食管癌细胞的检测结果相一致[6],说明在不同肿瘤细胞中,ezrin基因可能有相似的转录调控特性。双荧光素酶报告基因检测系统对于检测独立DNA片段的转录调控活性具有方便快捷的优势,然而在细胞内,DNA片段受其所在位置上下游序列的影响,其转录调控活性有可能与报告基因的检测结果存在偏差。近年来,逐渐发展完善的基因编辑技术,可以实现细胞内目标序列的定向缺失,为研究DNA片段的转录调控活性提供了更为有效可信的方法[12-14]。
本研究所用的基因编辑载体质粒属于规律成簇的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9,CRISPR/Cas9)系统,质粒转染细胞后,表达Cas9核酸内切酶和向导RNA(guide RNA,gRNA),由Cas9和gRNA组成复合物,利用gRNA与gRNA靶位点(目标DNA)的碱基互补配对,实现Cas9对目标DNA双链切割,在细胞的重组修复机制下,造成DNA缺失或插入突变[15-18]。gRNA靶位点的正确选择是保证Cas9在特定位点切割DNA的关键,采用在线软件预测的gRNA靶位点,是否能够被正确识别切割需要经过鉴定[19]。本研究设计的gRNA靶位点位于ezrin转录调控区两侧,为了便于观察转染效率和筛选细胞,将gRNA-L和gRNA-R靶位点序列分别构建至携带嘌呤霉素抗性筛选标记的基因编辑载体质粒pX459和携带绿色荧光标记pX458。从转染后的绿色荧光细胞数量可以看出,转染效率较高,因此未经嘌呤霉素筛选,直接对细胞基因组DNA进行亚克隆测序,鉴定gRNA位点的靶向切割情况。Panc-1细胞染色体数目为63,包括3个独特标记的染色体和1个小环状染色体,基因型结构复杂,筛选到纯合缺失突变体的难度较大,本研究仅对转染细胞进行嘌呤霉素初步筛选,了解转染基因编辑重组质粒是否影响细胞的增殖,后期将筛选鉴定缺失ezrin转录调控区的胰腺癌单克隆细胞株,检测ezrin转录调控区的缺失对ezrin基因表达及细胞克隆形成、凋亡、细胞周期、侵袭和移动等的影响[20]。
研究显示,ezrin基因表达上调与肿瘤患者预后不良相关,ezrin可能是一个有价值的预后生物标记物和潜在的治疗靶点[4,8,21-22]。实验中常采用RNA干扰的方法,作用于基因的转录产物mRNA,下调ezrin基因表达[8,23-24]。由于RNA干扰技术存在转染率低、基因表达抑制作用弱、持续时间短等局限性,阻碍其应用于临床治疗。不同于以往干扰ezrinmRNA下调基因表达的策略,本研究尝试敲除位于ezrin基因编码区上游的转录调控区DNA序列,从抑制基因转录的角度干预基因表达,所采用基因编辑技术作为一种实用性强的工具在肿瘤研究领域和临床肿瘤治疗方面的表现巨大潜力。因此,ezrin基因转录调控区gRNA靶位点的鉴定有望为基因编辑靶向治疗胰腺癌提供新思路及备选靶点。
综上所述,本研究鉴定了胰腺癌Panc-1细胞ezrin转录调控区,确定其上游gRNA-L和下游gRNA-R序列可作为基因编辑靶位点,实现ezrin转录调控区的靶向敲除,为进一步研究胰腺癌细胞ezrin基因的转录调控机制奠定基础。

