转化生长因子β1在泡状棘球蚴感染所致肝纤维化中的作用机制
玉苏甫卡迪尔·麦麦提尼加提,艾麦提·牙森,张瑞青,吐尔干艾力·阿吉,邵英梅,温 浩
0 引 言
泡状棘球蚴病是由泡状棘球绦虫(Echinococcus multilocularis,E.m)寄生于人体而引起的一种肿瘤样生长特性的人畜共患病[1]。肝作为泡球蚴感染的主要靶器官,在整个感染过程中受损最大。泡球蚴感染宿主后,能够使肝细胞发生变性、坏死及钙化等损伤[2],其中典型的病理特征是肝纤维化[3]。转化生长因子β(transfer growth factor-β, TGF-β)是一组具有多种生物学功能的调节因子,在体内的许多病理生理过程起重要调节作用。目前发现 TGF-β至少有5种异构体,其中TGF-β1是活化肝星状细胞 (hepatic stellate cells, HSCs)作用最强的因子,目前被认为重要的肝纤维化始动因子之一[4]。肌成纤维细胞是肝纤维化过程中的主要细胞类型,然而α-平滑肌肌动蛋白 (a-smooth muscle actin, α-SMA)是成纤维细胞内表达丰富的分泌性蛋白[5]。近几年来,关于TGF-β1和α-SMA在感染性疾病所致肝纤维化过程中的作用成了众多课题组研究的热点。
本研究经门静脉注射原头节混悬液,参考文献[6]方法建立泡状棘球蚴感染小鼠模型,观察不同时间点泡状棘球蚴感染小鼠肝病理学改变及检测TGF-β1和α-SMA在感染小鼠肝组织的动态表达情况,探讨TGF-β1在泡球蚴感染所致肝纤维化中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物人工腹腔感染多房棘球蚴的长爪沙鼠,雄性,18周龄,1只,购自于新疆医科大学实验动物中心。SPF级雌性C57BL/6小鼠,8~10周龄, 45只,体重(18±2)g ,购自于新疆医科大学实验动物中心,实验动物合格证号:SYXK (新)2018-0003。所有小鼠饲养于温度:19~21℃,湿度:50%~60%,12 h明暗交替环境下饲养。自由饮食、饮水。
1.1.2主要仪器和试剂仪器:组织自动包埋机(LeicaEG1160)及石蜡组织切片机(Leica2245)均来自德国Leica公司。光学显微镜(CX3IRBSF)为日本OLYMPUS公司产品,图像采集系统 (Ex-wave-HAD)为日本SONY公司产品。试剂: 兔抗小鼠TGF-β1单克隆抗体、兔抗小鼠α-SMA多克隆抗体、HRP标记亲和纯化的山羊抗兔IgG(H+L)二抗购自美国Abcam公司;抗抗体稀释液、山羊血清封闭液、DAB显色液、PBS、柠檬酸盐抗原修复液、4%多聚甲醛、中性树胶均购自北京中山金桥生物技术有限公司;天狼星红染色试剂盒购自南京森贝咖生物科技有限公司;糖原PAS染色试剂盒购自北京索莱宝生物科技有限公司。
1.2实验方法
1.2.1 泡球蚴原头节混悬液的制备将长爪沙鼠处死,在无菌环境下开腹,直视下取出腹腔中的棘球蚴组织(选取较为透亮,成簇的泡球蚴组织),用PBS缓冲液冲洗3次后,将组织剪碎,研磨,过筛,再用PBS缓冲液反复漂洗至混悬液呈乳白色,配成浓度为20%的原头节混悬液,用于小鼠接种。
1.2.2泡状棘球蚴感染小鼠模型的建立45只C57BL/6小鼠采用随机数字表法分为模型组(30只)和对照组(15只)。2组小鼠分别用4%水合氯醛溶液腹腔注射0.1 mL/10 g,待完全麻醉后乙醇消毒上腹部皮肤,打开腹腔,直视下找出小鼠门静脉,模型组注入配好的原头节混悬液(按4000 个/只计算),对照组注入等量的等渗盐水,局部止血3 min,用细线间断缝合关腹。小型电热毯传热复苏,饲养于清洁屏障(SPF级)环境。
1.2.3标本采取分别于造模后1、2、4、8、12周处死模型组6只,对照组3只小鼠,采取肝组织;将上述组织标本置于4%的多聚甲醛溶液固定24~48 h后,常规脱水,经石蜡包埋后,切厚约4 μm薄片备用。
1.2.4HE染色将薄片放入60 ℃烤箱烤烘40 min后常规脱蜡,放入蒸馏水浸洗2次×3 min,随后浸泡苏木素溶液1.5 min,立即蒸馏水冲洗至泛色,用盐酸乙醇分化2 s,再放入蒸馏冲洗水40 s后浸泡伊红溶液1 min,蒸馏水反复冲洗至泛色,常规脱水,透明并晾干,中性树胶封片后光学显微镜下观察组织病理形态学改变。
1.2.5天狼猩红染色将薄片常规脱蜡后滴加天狼星红染色液置于室温1 h;流水冲洗至去除切片表面染液,滴加Mayer苏木精染色液约50 μL/张染细胞核8 min,蒸馏水冲洗10 min;常规脱水,透明,中性树胶封固,在显微镜下观察并采图。
1.2.6糖原(periodic acid-schiff, PAS)染色将薄片常规脱蜡后放入蒸馏水浸洗2次×3 min,置于氧化剂中室温放置6 min。自来水冲洗1次,再用蒸馏水冲洗2次。滴加Schiff溶液后置于室温,浸染15 min。自来水冲洗1次×10 min。样本置于苏木精染色液中,染细胞核90 s后,放入酸性分化液3 s。自来水冲洗10 min后,放入双蒸水冲洗至其返蓝。常规脱水,透明,晾干,封固,显微镜下观察并采图。
1.2.7免疫组化染色将薄片常规脱蜡,用蒸馏水冲洗2次×2 min,泡在枸橼酸抗原修复液高温(90~100 ℃)修复15 min,自然冷却至室温。先后用蒸馏水和PBS缓冲液冲洗1次×5 min,然后3%H2O2溶液室温孵育10 min,PBS缓冲液冲洗 2次×5 min,滴加山羊血清室温封闭30 min,后滴加一抗 (TGF-β1和α-SMA工作液浓度分别为1∶80和1∶500)4 ℃冰箱孵育过夜。次日复温至室温后PBS液洗3次×5 min,滴加适量二抗稀释液,室温孵育90 min后,再用PBS缓冲溶液冲洗3次×5 min。滴加DAB显色液于光学显微镜下观察显色。苏木精复染10 s,反复冲洗,泡盐酸乙醇分化2~3 s,浸泡蒸馏水反蓝。最后常规脱水,透明,自然晾干后封固。
2 结 果
2.1 病理组织学观察
2.1.1 HE染色结果显示对照组小鼠肝组织结构正常,肝小叶结构完整,肝细胞边界清楚,排列整齐,未见炎性细胞侵润及脂肪变性。模型组小鼠在不同时间点肝组织形态及结构发生不同程度的变化,泡球蚴感染后1周可见大小及形态不一的多个原头蚴,并其周围炎性细胞的集聚。造模后2周显示,原头蚴数目逐渐减少,其周围炎性带范围变大,肝细胞开始出现脂肪变。4 周时炎细胞浸润和肝细胞脂肪变性增加,可见肉芽肿和增生的纤维结缔组织。8周后出现大量结构完整的肉芽肿及密集的纤维结缔组织,开始出现胆管增生。至12周,肉芽肿数量增加的同时可见完整的泡球蚴囊壁结构,见图1。
造模后1周时原头蚴数量最多,随着时间的推移逐渐被肉芽肿组织取代或形成囊泡,至12周后几乎消失。肉芽肿组织第2周开始出现,数目逐渐增加。炎性灶第1周就开始出现在原头蚴周围,2周和4周时范围逐步扩大,到12周时数目未见明显变化,见图2。
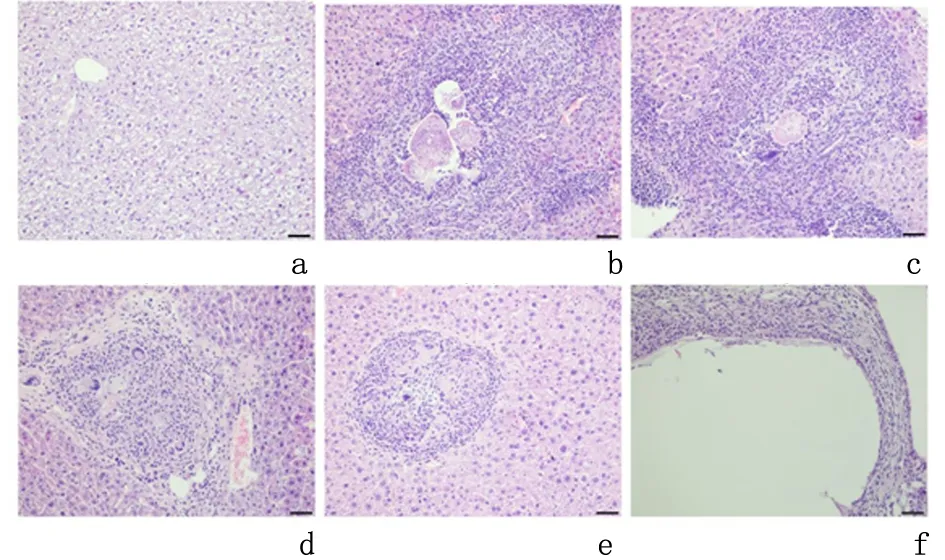
a:对照组; b-f:分别为模型组感染后1、2、4、8、12周
图 1 镜下观察不同时间点肝组织的变化(HE ×200)
Figure1Changesindifferenttimepointsoflivertissues(HE×200)
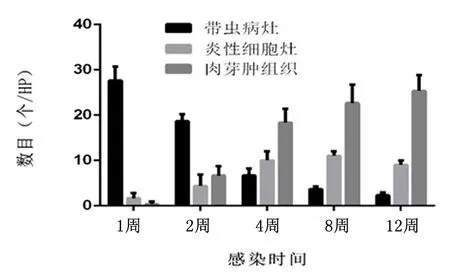
图 2 病灶的分类及数目
Figure2Classificationandnumberoflesions
2.1.2天狼猩红染色结果染色结果显示胶原在对照组肝组织中胆管及血管周围少量出现;模型组中,感染后前2周胶原主要沉积在原头蚴周围,分布疏散,颜色较浅。4周开始沉积逐渐增加并紧密,染色变深;到12周,胶原沉积范围较前局限,分布密集而颜色深,提示随着时间纤维化程度越严重,见图3。
2.1.3PAS染色结果结果显示对照组肝组织糖原含量丰富,分布均匀,染色均一。模型组中,感染后1周糖原主要集聚在原头蚴周围,集中分布,颜色深。2周和4周时原头蚴周围的糖原阳性染色区较1周明显减少,染色变浅。随后,随着肉芽肿范围的增加,糖原阳性区域越来越减少,染色变淡,肉芽肿组织内几乎不显示,见图4。
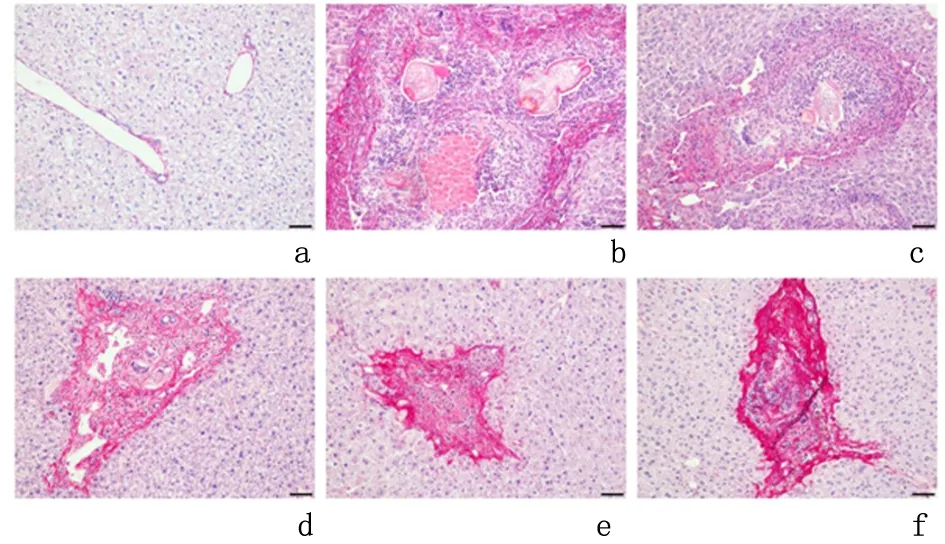
a:对照组; b-f:分别为模型组感染后1、2、4、8、12周
图 3 镜下观察不同时间点胶原沉积的情况(天狼星红染色 ×200)
Figure3Collagendepositionconditionsindifferenttimepoints(Siriusredstaining×200)
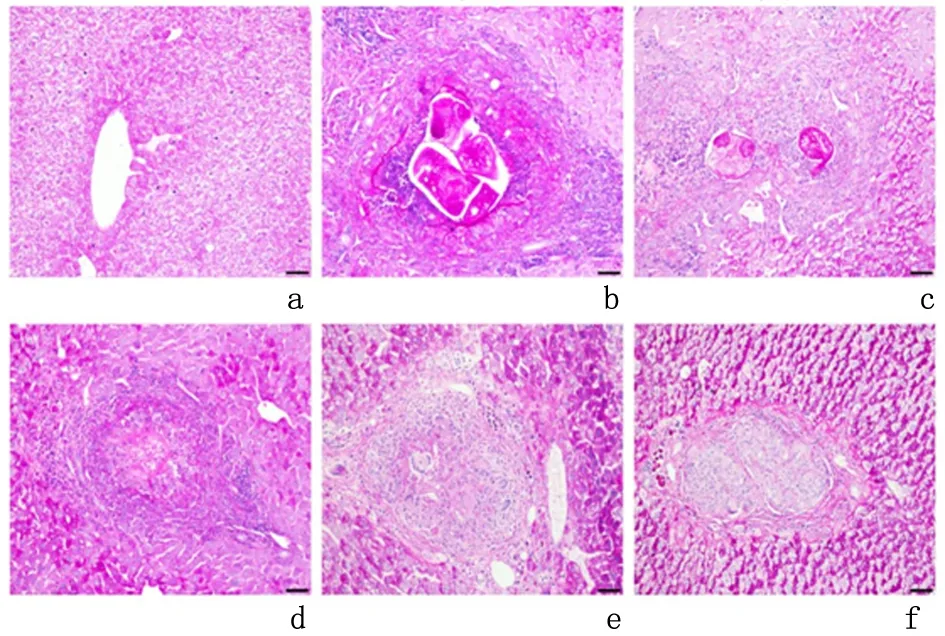
a:对照组; b-f:分别为模型组感染后1、2、4、8、12周
图 4 镜下观察不同时间点肝组织内糖原表达情况(PAS染色 ×200)
Figure4Glycogenexpressionconditionsindifferenttimepointsoflivertissues(PASstaining×200)
2.2免疫组化染色
2.2.1 α-SMA表达情况α-SMA在对照组肝组织的阳性表达主要见于胆管及血管周围;模型组小鼠肝中的阳性区多在原头蚴周围肉芽肿以及纤维组织增生区域,周围新生胆管和血管壁也可见阳性表达,见图5。感染后不同时间点α-SMA的表达量随时间逐渐增加,见表1。
2.2.2TGF-β1表达情况结果显示TGF-β1在对照组小鼠肝组织的肝窦区呈极低水平表达。模型组小鼠肝组织TGF-β1的表达部位主要在肝窦区、肉芽肿组织周围和泡球蚴生发层的增生区。造模后随着感染时间的增加,小鼠TGF-β1表达水平逐渐增强,见图6。泡球蚴感染后2周内TGF-β1的表达量很低,4 周后有少量表达,12 周时达到最高水平,见表1。
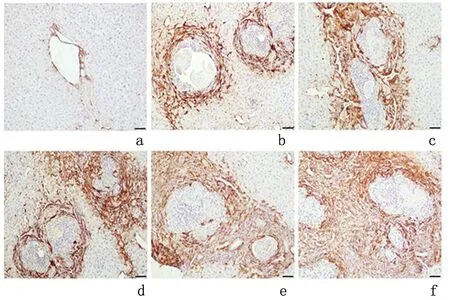
a:对照组; b-f:分别为模型组感染后1、2、4、8、12周
图 5 镜下观察不同时间点α-SMA的表达情况(免疫组化染色 ×200)
Figure5Expressionofα-SMAindifferenttimepointsoflivertissues(IHC×200)
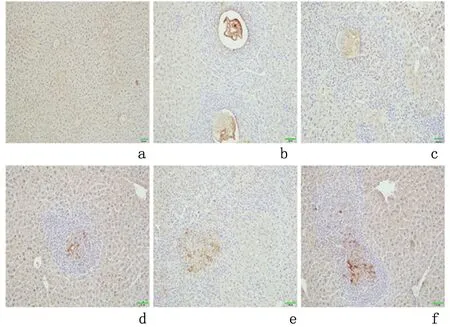
a:对照组; b-f:分别为模型组感染后1、2、4、8、12周
图 6 不同时间点TGF-β1的表达情况(免疫组化染色 ×200)
Figure6ExpressionofTGF-β1indifferenttimepointsoflivertissues(IHC×200)

指标对照组模型组1周2周4周8周12周TGF-β10.29±0.111.02±0.171.83±0.212.03±0.892.99±1.724.10±2.14α-SMA0.61±0.183.35±0.744.92±1.057.03±1.2111.05±1.7116.80±2.09
3 讨 论
泡型包虫病的病理特征主要是导致纤维化和坏死[7],它的临床表现与寄生虫生长和宿主免疫应答都密切相关。此研究建立泡状棘球蚴感染的动物模型用直接门静脉注射原头蚴混悬液的方法,这与人类泡型包虫自然感染途径高度相似[2]。因而,建立此模型不仅有利于进一步接近自然感染模式来研究肝脏免疫环境,而且能够有效显示泡球蚴感染不同时间点肝脏的病理变化,为研究泡球蚴感染所致肝损伤及修复提供了良好的动物模型。
寄生虫与宿主之间的相互作用表现于机体本身的细胞免疫和免疫耐受的平衡。当寄生虫导致机体肝脏损伤时,在肝细胞坏死及炎症的刺激下机体能够分泌多种细胞因子来对付外来损害而实现自我保护。我们的实验结果显示:泡球蚴接种后4周小鼠肝脏出现结节状白色斑块,12周后肝组织肉眼能够可见明显泡球蚴病灶。HE染色及PAS染色提示:泡球蚴感染后1周可见多个糖原丰富的原头蚴;2周后肝细胞开始出现脂肪变性,原头蚴逐渐被炎性细胞和肉芽肿包裹,糖原含量随着下降;对照组肝组织糖原含量丰富,分布均匀,染色均一,但在模型组中,随着感染时间糖原阳性区域越来越减少,染色变淡。到12周时肉芽肿数量和范围增加的同时可见完整的泡球蚴生发层结构,而糖原在肉芽肿组织内几乎不显示;这表明感染早期侵犯于肝脏内的泡球蚴原头蚴占优势,并刺激宿主肝脏后在机体免疫的作用下逐渐被炎症细胞包裹,最后被肉芽肿组织取代,只少部分原头蚴终成为病灶。肝脏作为机体代谢的主要“阵地”,对糖原的存储,分布和调节起重要作用,糖类进人肝细胞后经葡萄糖激酶被磷酸化为6-磷酸-葡萄糖,进一步通过糖原合成酶的合成作用转化为糖原而贮存,当机体需要时,便可分解成葡萄糖,转化为能量。然而,当肝脏受损而肝细胞发生弥漫性损害时,肝糖原合成障碍及贮存减少[8]。多房棘球蚴病通过直接侵蚀、机械压迫和毒性损害等方式对宿主肝脏造成损害,从感染宿主开始到在肝脏内形成囊泡、炎性反应带,使病灶处肝细胞发生变性、坏死及钙化,甚至能够导致弥漫性的纤维化[2,9]。
肝星状细胞在泡球蚴感染所致肝纤维化过程中起着重要的作用,它的活化受TGF-β/Smad通路,MAPK通路等多种信号通路的调控[10-15]。研究表明在泡球蚴感染过程中,在虫卵抗原刺激下宿主产生 TGF-β1等各种细胞因子,刺激宿主肝星状细胞活化、增殖、转化成肌成纤维细胞,促进肝纤维化的发生及发展[16]。TGF-β1目前被认为重要的肝纤维化始动因子之一。有关研究证实机体在正常状态下,肝细胞内不会表达TGF-β1;当肝细胞受到损害时肝细胞TGF-β1的表达上调[17-18]。Vuitton等[19]发现TGF-β1在 AE 病人肝组织泡球蚴浸润带出现阳性表达。本实验通过免疫组织化学方法检测不同时间点 TGF-β1在小鼠肝组织中的表达。结果显示:TGF-β1的表达部位主要在肝窦区、肉芽肿组织周围和泡球蚴生发层的增生区,而且随着感染时间的增加其表达逐渐增强;这与泡型包虫病的临床特征是一致的。此外,当宿主受外界因子刺激时肝星状细胞会被激活并最终分化为肌成纤维细胞。α-SMA是肌成纤维细胞内表达丰富的分泌性蛋白,也是肝星状细胞活化的标志物[20]。本研究结果提示:接种后不同时间点α-SMA的表达随着感染时间逐渐升高,并与对照组相比有显著性差异;这与TGF-β1的表达结果相似。上述研究结果证实泡球蚴感染所致肝纤维化可能与TGF-β1激活肝星状细胞相关。
综上所述,本研究结果中泡球蚴感染的不同时间点小鼠肝组织纤维化程度与TGF-β1及α-SMA等相关因子的表达趋势一致,并与此前国内外相关研究的结果符合。因此我们认为TGF-ß1可能通过活化肝星状细胞并促使其转化成纤维细胞,后者通过分泌 a-SMA蛋白,进而促进胶原蛋白沉积并导致纤维化。然而,调控TGF-β1的表达可能影响泡球蚴所致肝纤维化,可为今后泡型包虫病肝纤维化治疗和临床药物的开发提供良好的理论依据和新的思路。

