ADAMTS9-AS1-SEMA3G通路对胰腺癌组织中免疫细胞的影响
马佳康,任凯凯,蔺小艳,侯明宇,周 博,马 军
0 引 言
胰腺癌是最致命和最具侵袭性的癌症之一,5年生存率极低[1-2]。尽管外科治疗手段越来越多,但大约70%的患者在术后6~12个月内仍会出现早期复发[3]。因此,我们需要进一步探索其发病机制,找到更有效的诊断标记和治疗靶点。长链非编码RNA(Long noncoding RNAs,lncRNA)为超过200个核苷酸序列组成的非编码RNA[4]。在多种肿瘤中都存在着IncRNA的异常表达,其功能与癌症生物学的许多方面有关,如分化、凋亡、印记、细胞周期[5-6]。近来发现lncRNA在免疫调节方面发挥越来越重要的作用[7]。本研究旨在研究胰腺癌中影响免疫浸润相关的lncRNA-mRNA调控通路。
1 资料与方法
1.1 数据下载和表达矩阵构建从TCGA数据库下载胰腺癌转录组测序数据以及相关临床数据,构建完整的基因表达矩阵和临床信息矩阵。从GEO数据库下载GSE86436探针芯片表达矩阵信息,对GSE98269数据集利用平台文件GPL13825[Arraystar Human LncRNA microarray V2.0 (Agilent-033010 Feature Number version)],根据探针序列利用 BLAST软件进行重注释,进而构建完整的基因表达矩阵。
1.2差异分析以及生存分析对构建好TCGA胰腺癌的lncRNA表达矩阵利用R软件edgeR包,以|log2FC| >1,P<0.05为标准对其进行差异分析,对GSE86436利用R软件limma包按照|log2FC| >1,P<0.05进行差异分析。对两者获得差异基因取交集后,结合TCGA的生存信息利用R语言survival包以及survminer包中的surv_cutpoint函数选择最佳的cutoff值进行生存分析,筛选出共同差异且和生存相关的lncRNA。
1.3lncRNA与临床信息关联性分析将ADAMTS9-AS1表达量与TCGA胰腺癌样本临床信息(病理分级、stage分期、T分期、N分期)进行相关性分析,鉴定出ADAMTS9-AS1表达所影响的临床特征,由于M分期大部分为MX分期(无法确定有远处转移)未行进一步研究。
1.4lncRNA相关靶基因筛选将TCGA胰腺癌差异mRNA与各样本病理分级信息相关联,鉴定出所有和病理分级相关的差异mRNA,将此部分mRNA和ADAMTS9-AS1进行相关性分析,鉴定出|r|>0.4以及P<0.05的mRNA。利用IMMPORT(https://www.immport.org/shared/home)数据库下载免疫相关基因列表,筛选出上述靶基因中免疫相关的基因。
1.5SEMA3G和 ADAMTS9-AS1免疫浸润相关分析利用 TIMER数据库(https://cistrome.shinyapps.io/timer/)下载TCGA样本中免疫细胞(B细胞、CD4_T细胞、CD8_T细胞、中性粒细胞、巨噬细胞和树突状细胞)浸润水平矩阵,将SEMA3G和ADAMTS9-AS1表达信息与该矩阵行相关性分析,分析 SEMA3G和ADAMTS9-AS1对胰腺癌中免疫细胞浸润程度的相关性。
1.6ADAMTS9-AS1相关GO以及KEGG富集分析将ADAMTS9-AS1相关性较高的差异基因(靶基因)利用clusterProfiler包进行GO富集以及KEGG富集分析,根据P<0.05筛选出相关的条目和 KEGG通路。
1.7基因集富集分析(Gene Set Enrichment Analysis, GSEA)分析利用GSEA工具v3.0(http://www.broadistitute.org/gsea),选择基因集c2.cp.kegg.v6.2.symbols进行单基因GSEA。通过排列检验(1000次排列检验)以FDR<0.05为标准筛选富集结果。
1.8统计学分析采用R语言进行数据分析。相关性分析采用Pearson相关系数。以P≤0.05为差异有统计学意义。
2 结 果
2.1 ADAMTS9-AS1的筛选ADAMTS9-AS1高表达的胰腺癌患者较低表达患者有更高的生存率(P=0.010),见图1。ADAMTS9-AS1在TCGA的差异情况为log2FC=-1.70,P=0.017;GSE86436为log2FC=-1.78,P=0.006。
2.2GO以及KEGG富集分析筛选出ADAMTS9-AS1相关性较强的差异mRNA,进行GO以及KEGG富集分析,GO富集结果共筛选到356条目,结果与免疫相关,如白细胞-细胞黏附、肿瘤坏死因子超家族细胞因子产生的调控、白细胞增殖的负性调控、肿瘤坏死因子超家族细胞因子产生、免疫系统过程负性调节、白细胞-细胞黏附的调节、巨噬细胞集落刺激因子的反应、巨噬细胞集落刺激因子刺激的细胞反应、白细胞迁移以吞噬作用的调节等。KEGG结果共筛选到9个通路,分别为金黄色葡萄球菌感染、细胞周期、补体和凝血级联、卵母细胞减数分裂、孕酮介导的卵母细胞成熟、破骨细胞分化、类风湿关节炎、百日咳以及人T细胞白血病病毒1感染。见图2。
2.3ADAMTS9-AS1免疫浸润分析通过将ADAMTS9-AS1的表达数据和TIMER数据库中TCGA免疫浸润数据进行相关性分析,发现ADAMTS9-AS1的表达与免疫细胞浸润呈正相关。其中,与B细胞浸润(r=0.311)、CD4_T细胞浸润(r=0.303)、CD8_T细胞浸润(r=0.455)、中性粒细胞浸润(r=0.391)、巨噬细胞浸润(r=0.477)、树突状细胞浸润(r=0.366)呈正相关(P<0.05)。见图3。

图 1 ADAMTS9-AS1生存曲线
Figure1SurvivalcurveofADAMTS9-AS1
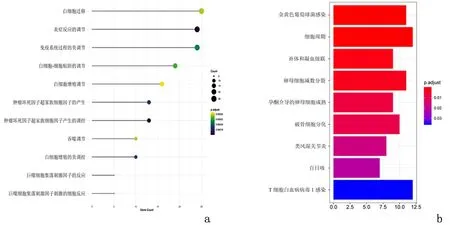
a:GO分析; b:KEGG分析
图 2 ADAMTS9-AS1相关的GO以及KEGG图
Figure2GOandKEGGdiagramsrelatedtoADAMTS9-AS1

图 3 ADAMTS9-AS1表达与免疫细胞浸润程度相关性分析
Figure3AnalysisofthecorrelationbetweenADAMTS9-AS1expressionandthelevelofimmunecellinfiltration
2.4ADAMTS9-AS1与病理分级密切相关ADAMTS9-AS1的表达量在病理分级(G1+G2vsG3+G4)中差异有统计学意义(P<0.012),在stage分期(I、II、III)、T分期(T1+T2vsT3+T4)、N分期(N0vsN1)中差异无统计学意义(P>0.05)。
2.5筛选得到免疫相关基因SEMA3G为ADAMTS9-AS1的靶基因将差异mRNA与临床病理分级进行相关性分析,筛选出与56个相关差异基因,与ADAMTS9-AS1进行共表达分析,筛选得到18个基因与ADAMTS9-AS1明显相关。对照IMMPORT数据库中2498个肿瘤免疫相关基因,发现SEMA3G为免疫相关基因并且与ADAMTS9-AS1相关性最高(r=0.657,P<0.05)。
2.6SEMA3G免疫浸润分析对SEMA3G进行免疫浸润分析后发现其表达与免疫细胞浸润呈正相关,其中,与B细胞浸润(r=0.309)、CD4_T细胞浸润(r=0.431)、CD8_T细胞浸润(r=0.270)、中性粒细胞浸润(r=0.312)、巨噬细胞浸润(r=0.374)、树突状细胞浸润(r=0.217)呈正相关(P<0.05)。
2.7ADAMTS9-AS1的GSEA分析通过对ADAMTS9-AS1进行单基因GSEA富集分析,结果显示 ADAMTS9-AS1与柠檬酸盐循环、脂肪酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、溶酶体、过氧化物酶体、丙酸盐代谢、蛋白酶体、丙酮酸盐代谢、核糖体、缬氨酸-亮氨酸和异亮氨酸降解通路相关。
3 讨 论
胰腺癌作为侵袭性最强的肿瘤之一,大部分患者在发现时已是晚期,不能行根治性手术,患者生存率极低[8]。近年来,随着检查点抑制剂免疫治疗的突破,肿瘤免疫治疗已从辅助治疗转变为一种重要的治疗方式,因此全面了解癌症患者的免疫浸润情况,对个体选择正确的免疫治疗策略尤为重要[9]。
本研究通过对TCGA以及GEO数据库联合分析,筛选到与预后相关的差异lncRNA ADAMTS9-AS1。为了进一步了解该lncRNA的功能,本研究进行了GO及KEGG富集分析,富集结果显示该基因与免疫明显相关,并通过TIMER数据库[10]验证了该lncRNA与胰腺癌中B细胞、CD4_T细胞、CD8_T细胞、中性粒细胞、巨噬细胞和树突状细胞的浸润呈明显正相关,与CD8_T细胞、巨噬细胞的相关性更为显著。临床相关性分析显示该lncRNA与肿瘤分级呈负相关关系,由此可见胰腺癌中该lncRNA表达越高,肿瘤中免疫浸润越多,肿瘤分级越低,患者预后越好,与KA等在乳腺癌中的研究相一致[11]。为鉴定出lncRNA的靶基因,本研究利用IMMPOT数据库[12]筛选出与肿瘤分级以及免疫明显相关的差异基因SEMA3G[13],且该基因与ADAMTS9-AS1有明显的正向相关性。进一步通过TIMER数据库验证了SEMA3G与胰腺癌内免疫细胞浸润水平同样呈正相关关系,因此预测ADAMTS9-AS1-SEMA3G通路在免疫细胞调控中起着重要作用。除此之外,通过GSEA发现了ADAMTS9-AS1也可能参与肿瘤相关代谢过程,但有待进一步研究。
既往研究表明ADAMTS9-AS1在膀胱癌中差异表达且通过调控下游的miRNA影响病人的预后[14-15]。研究发现ADAMTS9-AS1在结肠癌中下调表达并且同样影响患者的总生存率,并通过RT-qPCR再次验证了其在癌和癌旁中的差异情况。有研究证实过表达SEMA3G后人胰腺癌细胞系的增殖、侵袭和迁移能力降低,与本研究中SEMA3G在胰腺癌的负调控作用相一致[16]。Tang等[17]发现SEMA3G在类风湿的免疫调节中起重要作用,虽然该研究未涉及肿瘤,但体现出该基因重要的免疫调节作用。ADAMTS9-AS1在多种肿瘤中起重要作用,SEMA3G在胰腺癌中也起到抑癌基因的重要作用,但目前还没有关于两者在胰腺癌肿瘤免疫方面的相关研究[18-19]。
本研究检测到ADAMTS9-AS1和SEMA3G在胰腺癌中下调,预测该通路与B细胞、CD4_T细胞、CD8_T细胞、中性粒细胞、巨噬细胞和树突状细胞的浸润水平增加有关,初步探讨了其与胰腺癌肿瘤免疫浸润以及胰腺癌患者预后的关系,为其在肿瘤免疫学中的潜在作用及其作为肿瘤生物标志物提供了依据。

