卵巢癌组织miR-204、BDNF表达变化及其临床意义
杨东,杨宇,白云波,张同庆,张为远
1 首都医科大学附属北京世纪坛医院,北京100038;2 首都医科大学附属北京妇产医院
卵巢癌是女性第七大常见癌症,也是癌症死亡的第八大常见原因。近年来,卵巢癌的发病率明显升高并呈年轻化趋势[1]。卵巢癌早期症状隐匿,约70%患者就诊时已进展为晚期,错过了最佳手术时机,预后较差,5年生存率不足45%[2]。目前,卵巢癌发病的确切分子机制尚不清楚。因此,探索与卵巢癌发生、发展相关的分子对其诊断和治疗具有重要意义。微小RNA(miRNA)是一类内源性非编码小分子RNA,可与靶基因mRNA结合,通过翻译水平抑制或断裂靶基因mRNA而调节基因的表达。miR-204是miRNA家族成员之一,可结合下游靶基因mRNA的3′非翻译区(UTR),通过改变靶基因mRNA的稳定性,影响靶基因表达,继而参与生长发育、代谢、衰老等生物学过程[3]。有研究表明,miR-204在黑色素瘤[4]、脑胶质瘤[5]等肿瘤组织中存在异常表达现象;miR-204可通过促进细胞凋亡和抑制上皮间质转化(EMT)、化疗耐药等机制,发挥肿瘤抑制作用[6]。脑源性神经营养因子(BDNF)是一种广泛分布于神经系统的神经营养因子,属于神经生长因子蛋白家族成员,该蛋白与其同源受体的结合能够调节应激反应、情绪障碍等生物学过程[7]。有研究发现,BDNF异常高表达能够通过激活磷脂酰肌醇-3激酶信号通路,促进肿瘤细胞恶性增殖、浸润和迁移[8]。但miR-204、BDNF表达变化与卵巢癌发生、发展关系的报道相对较少。为此,本研究观察了卵巢癌组织miR-204、BDNF表达变化,并探讨二者在卵巢癌发生、发展中的作用。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年5月~2016年5月首都医科大学附属北京世纪坛医院收治的卵巢癌患者89例。所有患者经术后组织病理检查明确诊断。纳入标准:①符合卵巢癌诊断;②初诊;③接受卵巢癌全面分期手术或肿瘤细胞减灭术;④术前未接受任何抗肿瘤治疗;⑤临床病理资料和随访资料完整。排除标准:①合并其他器官或系统恶性肿瘤者;②合并急慢性感染性疾病者;③合并心、肝、肾等重要脏器严重功能不全者;④合并神经、精神疾病,不能配合治疗或完成随访者。患者年龄29~72(54.1±6.4)岁;病理类型:黏液性癌37例,浆液性癌52例;组织分化程度:高中分化56例,低未分化33例;临床分期:Ⅰ期13例,Ⅱ期22例,Ⅲ期42例,Ⅳ期12例;有淋巴结或腹膜转移39例,无淋巴结或腹膜转移50例;血清CA125水平:≤35 μg/mL 41例,>35 μg/mL 48例;腹水量:≤100 mL 45例,>100 mL 44例。同期随机选择因子宫良性病变行子宫及附件切除手术且经术后组织病理检查证实卵巢正常患者20例,年龄28~73(53.6±6.7)岁,子宫肌瘤12例、子宫腺肌症8例。本研究经首都医科大学附属北京世纪坛医院医学伦理委员会批准,患者或其家属知情同意。
1.2 miR-204、BDNF表达检测 采用RT-qPCR法。手术获取的卵巢癌组织和正常卵巢组织,立即置于冻存管内,液氮转运至-80 ℃冰箱保存,待组织成批。取冻存组织约50 mg,采用TRIzol法提取组织总RNA,经紫外分光光度计鉴定,OD260/OD280为1.8~2.0,可用于后续实验。按PrimeScriptTMRT Reagent Kit with gDNA Eraser说明将总RNA逆转录为cDNA。逆转录条件:37 ℃ 15 min,84 ℃ 5 s。以cDNA为模板,按SYBR®Premix Ex TaqTM说明进行PCR扩增。所有引物由上海生工生物工程股份有限公司设计合成。引物序列:miR-204上游引物5′-GCCAGATCTGGAAGAAGATGGTGGTTAGT-3′、下游引物5′-GGCGAATTCACAGTTGCCTACAGTATTCA-3′,内参GAPDH上游引物5′-ATTCCACCCATGGCAAATTC-3′,下游引物5′-TGGGATTTCCATTGATGACAAG-3′;BDNF上游引物5′-GGCTTGACATCATTGGCTGAC-3′、下游引物5′-CATTGGGCCGAACTTTCTGGT-3′,内参β-actin上游引物5′-AGAGCTACGAGCTGCCTGAC-3′、下游引物5′-AGCACTGTGTTGGCGTACAG-3′。PCR反应体系均为20 μL:cDNA模板1 μL,上下游引物各1 μL,Master Mix 10 μL,DEPC水7 μL(miR-204);cDNA模板2 μL,TaqDNA聚合酶0.1 μL,上下游引物各1 μL,2×SYBR Premix Ex Taq 1 μL,dNTPs 0.4 μL,ddH2O 14.5 μL(BDNF)。PCR反应条件:95 ℃ 15 min,94 ℃ 30 s、55 ℃ 15 s、70 ℃ 30 s共40个循环(miR-204);95 ℃ 5 min,95 ℃ 15 s、60 ℃ 60 s、72 ℃ 10 s共40个循环(BDNF)。以GAPDH、β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。
1.3 随访 卵巢癌患者术后采用门诊、电话等形式定期随访,每3个月随访1次,随访截至2019年5月,终点事件为患者死亡,统计患者生存情况,计算3年总体生存率。
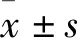
2 结果
2.1 卵巢癌组织与正常卵巢组织miR-204、BDNF表达比较 卵巢癌组织与正常卵巢组织miR-204相对表达量分别为0.213±0.031、0.645±0.083,BDNF相对表达量分别为0.572±0.087、0.321±0.081。卵巢癌组织miR-204相对表达量低于正常卵巢组织,BDNF相对表达量高于正常卵巢组织(t分别为38.904、11.799,P均<0.01)。
2.2 卵巢癌组织miR-204表达与BDNF表达的关系 Pearson线性相关分析显示,卵巢癌组织miR-204相对表达量与BDNF相对表达量呈负相关关系(r=-0.603,P<0.01)。
2.3 卵巢癌组织miR-204、BDNF表达与患者临床病理特征的关系 卵巢癌组织miR-204、BDNF相对表达量均与组织分化程度、临床分期有关(P均<0.05),与年龄、病理类型、淋巴结或腹膜转移、血清CA125水平及腹水量无关(P均>0.05)。见表1。

表1 卵巢癌组织miR-204、BDNF表达与患者临床病理特征的关系
2.4 卵巢癌组织miR-204、BDNF表达与患者预后的关系 至随访截至时间,所有患者随访1~36个月、中位随访时间26个月,死亡38例,无失访病例。
以卵巢癌组织miR-204相对表达量的均数0.213为临界值,将患者分为miR-204高表达者44例、低表达者45例。miR-204高表达者3年总体生存率为68.1%(30/44),miR-204低表达者为46.6%(21/45),miR-204低表达者3年总体生存率低于miR-204高表达者(χ2=3.901,P<0.05)。见图1。
以卵巢癌组织BDNF相对表达量的均数0.572为临界值,将患者分为BDNF高表达者43例、低表达者46例。BDNF高表达者3年总体生存率为41.9%(18/43),BDNF低表达者为71.7%(33/46),BDNF高表达者3年总体生存率低于BDNF低表达者(χ2=4.690,P<0.05)。见图2。

图1 卵巢癌组织不同miR-204表达者预后的生存曲线

图2 卵巢癌组织不同BDNF表达者预后的生存曲线
3 讨论
卵巢癌是一种临床常见的女性生殖系统恶性肿瘤,每年全球新发病例约22.5万例、死亡病例约14万例[9]。卵巢癌主要以手术治疗为主,辅以放疗、化疗和免疫治疗等。但大部分患者就诊时已进展至中晚期,即使经过手术、放疗、化疗等规范治疗,肿瘤复发或转移的概率仍然较高,患者5年生存率较低[10]。目前,卵巢癌发生、发展确切的分子机制尚不完全清楚。近年随着高通量测序等技术的不断发展,人们逐渐认识到卵巢癌的发生、发展涉及多种分子机制,如癌基因激活、抑癌基因失活及基因表达转录后调控异常等。因此,深入探索与卵巢癌发生、发展相关的分子对其诊断和治疗具有重要意义。
miRNA是一类长度为20~25个核苷酸的非编码RNA分子,由RNA聚合酶Ⅱ或Ⅲ转录后形成具有茎-环结构的miRNA前体,再进一步经核糖核酸酶Ⅲ Dicer识别、剪切形成成熟miRNA并构成RNA诱导的沉默复合物,通过碱基配对的方式结合靶基因mRNA的3′UTR,通过改变靶基因mRNA的稳定性,影响靶基因表达。有研究发现,miRNA在肺癌[11]、肝癌[12]等肿瘤组织中存在异常表达现象,其异常表达与肿瘤细胞的无限增殖、凋亡抑制等恶性生物学行为密切相关。miR-204是miRNA家族成员之一,定位于人染色体9q21.12,在乳腺癌、肺癌等肿瘤组织中存在表达下调现象。有研究发现,miR-204通过结合并抑制叉头盒A1基因的信使RNA表达,从而抑制细胞增殖、迁移;在肿瘤组织中miR-204表达下调,其表达下调可促进肿瘤细胞增殖、迁移,继而引起肿瘤恶性进展[13]。由此推测,miR-204可能在卵巢癌中发挥同样的调控作用。但目前相关报道较少。本研究结果发现,卵巢癌组织miR-204相对表达量明显低于正常卵巢组织,证实在卵巢癌组织中miR-204低表达,其原因可能与长链非编码RNA(LncRNA)转移相关的肺腺癌转录本1(MALAT1)对miR-204的表达调控有关。有研究表明,LncRNA MALAT1能够作为分子海绵结合并抑制miR-204的表达与活性,当肿瘤发生时LncRNA MALAT1表达增加,可导致miR-204表达降低,引起miR-204下游的转录因子表达增加,如SMAD4等,从而促进肿瘤细胞的恶性增殖[14]。本研究结果发现,卵巢癌组织miR-204相对表达量与组织分化程度、临床分期有关,与年龄、病理类型、淋巴结或腹膜转移、血清CA125水平及腹水量无关。结果提示,miR-204低表达与卵巢癌的恶性进展有关,其机制可能与miR-204能够抑制EMT的关键转录因子Snail1表达有关。miR-204表达降低可导致Snail1表达上调,继而引起下游E钙黏素等上皮细胞表型蛋白表达降低和波形蛋白等间质细胞表型蛋白表达升高,从而促进肿瘤恶性进展[15]。本研究进一步分析了不同miR-204表达者3年总体生存率的差异,结果发现,miR-204低表达者3年总体生存率明显低于miR-204高表达者,表明卵巢癌组织miR-204低表达与患者预后不良有关。因此,miR-204有可能成为评估卵巢癌患者预后的生物标志物。
BDNF基因定位于人染色体11p14.1,其编码蛋白在哺乳动物中枢神经系统中广泛表达,通过结合神经元细胞表面的酪氨酸激酶受体,即原肌球蛋白受体激酶B(TrkB),激活下游信号通路,发挥维持神经元存活并促进新的神经元和突触生长及促进肌肉再生等生物学作用。近年研究表明,BDNF/TrkB信号通路在乳腺癌、肺癌等恶性肿瘤的发生、发展中发挥重要的调控作用,即BDNF/TrkB信号通路的过度活化能够促进肿瘤细胞的增殖、浸润和迁移等恶性生物学行为。本研究结果发现,卵巢癌组织BDNF相对表达量明显高于正常卵巢组织,证实在卵巢癌组织中BDNF高表达,其原因可能与抑制其表达的miRNA表达下调有关。有研究发现,miR-1、miR-10b、miR-191等通过与BDNF 3′UTR中相应的位点结合,直接抑制BDNF信使RNA的稳定性,降低BDNF表达;但在肿瘤发生时miR-1、miR-10b、miR-191等表达降低,导致BDNF/TrkB信号通路的过度活化,从而促进肿瘤组织BDNF高表达[16,17]。本研究结果发现,卵巢癌组织BDNF相对表达量与组织分化程度、临床分期有关,与年龄、病理类型、淋巴结或腹膜转移、血清CA125水平及腹水量无关。结果提示,BDNF高表达与卵巢癌的恶性进展有关,其机制可能是BDNF过表达通过诱导Ca2+依赖性酪氨酸激酶的402位点酪氨酸磷酸化,诱发Ca2+流动,从而介导相应的信号通路激活,继而促进肿瘤恶性进展。同时,BDNF过表达还可通过激活下游磷脂酰肌醇-3激酶信号通路,促进肿瘤细胞恶性增殖[18]。有研究发现,BDNF过表达与膀胱癌、神经母细胞瘤、乳腺癌等患者预后不良有关[19]。本研究中,BDNF高表达者3年总体生存率低于BDNF低表达者,表明卵巢癌组织BDNF高表达与患者预后不良有关。因此,BDNF有可能成为评估卵巢癌患者预后的生物标志物。
本研究结果还发现,卵巢癌组织miR-204相对表达量与BDNF相对表达量呈负相关关系,表明miR-204与BDNF可能存在一定的调控关系。有研究报道,在乳腺癌中miR-204能够结合BDNF信使RNA,进而促进BDNF信使RNA的降解,而敲除miR-204表达后,BDNF表达升高,从而促进肿瘤恶性进展[20]。但二者在卵巢癌中具体的调控关系尚不清楚,有待于进一步研究。
综上所述,卵巢癌组织miR-204低表达、BDNF高表达,二者表达变化与临床分期、组织分化程度和患者预后有关。miR-204、BDNF有可能成为卵巢癌分子诊断、靶向治疗和预后评估的生物标志物。

