外周血MHR与冠状动脉粥样硬化易损斑块的关系
李莉,李阳,樊泽元,季汉华
民航总医院 北京大学民航临床医学院,北京100123
近年来,随着社会经济的发展,国民生活方式和饮食结构发生明显改变,加之人口老龄化进程加速,我国冠心病的发病例数持续增加,已成为严重危害国民生活质量和生命健康的重大公共卫生问题之一[1]。冠心病的病理基础是冠状动脉粥样硬化,特别是那些不稳定、易于破裂或形成血栓的冠状动脉粥样硬化易损斑块,是引起主要不良心血管事件(MACE)的重要原因[2,3]。因此,尽早识别冠状动脉粥样硬化易损斑块并指导临床采取针对性的诊疗措施,能有效降低MACE的发生风险。动脉粥样硬化是一种慢性动脉炎症反应性疾病。单核细胞作为机体重要的炎症细胞,能够参与动脉粥样硬化斑块形成的全过程。HDL-C是血脂中对机体有益的一种胆固醇,具有抗动脉粥样硬化作用。单核细胞计数/HDL-C(MHR)是一种将单核细胞与HDL-C整合后的新型炎症标志物。有研究发现,MHR能够辅助评估冠心病患者冠状动脉粥样硬化程度和预后[4~6]。但目前外周血MHR与冠状动脉粥样硬化易损斑块的关系国内外鲜见报道。本研究分析了外周血MHR与冠状动脉粥样硬化易损斑块的关系,并初步探讨其预测冠状动脉粥样硬化易损斑块的效能。现报告如下。
1 资料与方法
1.1 临床资料 选择2016年1月~2019年6月民航总医院收治的初诊冠心病患者186例。所有患者至少有1支主要冠状动脉管径狭窄程度≥50%[7]。排除合并脑血管意外、周围血管或造血系统疾病、肝肾功能不全及恶性肿瘤者。根据血管内超声(IVUS)检查结果判断斑块稳定性,其中单纯易损斑块50例、非易损斑块105例,同时存在易损斑块与非易损斑块31例。易损斑块诊断标准[8]:在管腔最小横截面积或最大坏死核心处,坏死核心面积>10%且至少占病变周径的33%,无明显纤维帽证据,斑块负荷>40%,至少连续3个相隔1 mm的横截面均满足以上条件。根据斑块稳定性将患者分为易损斑块组和非易损斑块组,同时存在易损斑块与非易损斑块患者归入易损斑块组。本研究经民航总医院医学伦理委员会批准,患者或其家属知情同意。
1.2 临床资料收集 所有患者入院后采集一般人口学资料(包括性别、年龄、BMI)和相关临床资料(包括吸烟、高血压、2型糖尿病及冠心病家族史)。
入院后禁食12 h,采集肘静脉血,采用Sysmex XE-2100血液分析仪计数白细胞、中性粒细胞、单核细胞、淋巴细胞;采用罗氏Cobas8000全自动生化分析仪检测血浆LDL-C、HDL-C、TC、TG、尿酸(UA)、肌酐(Cr),计算MHR。
1.3 斑块坏死核心构成比计算 所有患者入院后行IVUS检查,收集灰阶IVUS和虚拟组织学IVUS图像。根据美国心脏病学会临床专家共识关于IVUS图像的获得、测量和报告标准[9],由2位经验丰富的医师共同测定和分析。斑块坏死核心构成比即斑块坏死核心占斑块总面积的百分比。
2 结果
2.1 两组临床资料比较 一般人口学资料共纳入3个因素。易损斑块组男59例、女22例,年龄(48.29±6.02)岁,BMI(22.51±7.19)kg/m2;非易损斑块组男75例、女30例,年龄(49.17±6.17)岁,BMI(22.08±6.78)kg/m2。两组性别、年龄、BMI比较P均>0.05。
相关临床资料共纳入4个因素。易损斑块组有吸烟史者23例,合并高血压者19例、2型糖尿病者24例,有冠心病家族史者7例;非易损斑块组有吸烟史者27例,合并高血压者27例、2型糖尿病者15例,有冠心病家族史者9例。两组合并2型糖尿病者比较P<0.05,有吸烟史者、合并高血压者及有冠心病家族史者比较P均>0.05。
实验室检测资料共纳入11个因素。易损斑块组白细胞计数为(6.76±1.43)×109/L,中性粒细胞计数为(4.15±1.65)×109/L,单核细胞计数为(3.65±0.78)×108/L,淋巴细胞计数为(1.99±0.84)×109/L;非易损斑块组白细胞计数为(6.25±1.39)×109/L,中性粒细胞计数为(3.97±1.58)×109/L,单核细胞计数为(3.13±0.57)×108/L,淋巴细胞计数为(2.17±0.91)×109/L。两组白细胞、单核细胞计数比较P均<0.05,中性粒细胞、淋巴细胞计数比较P均>0.05。易损斑块组血浆LDL-C水平为(3.11±0.95)mmol/L,血浆HDL-C水平为(1.05±0.71)mmol/L,血浆TG水平为(1.86±0.72)mmol/L,血浆TC水平为(5.26±1.39)mmol/L,血浆UA水平为(368.18±65.78)μmol/L,血浆Cr水平为(85.79±10.05)μmol/L,MHR为2.98±0.47;非易损斑块组血浆LDL-C水平为(2.69±0.87)mmol/L,血浆HDL-C水平为(1.28±0.59)mmol/L,血浆TG水平为(1.93±0.75)mmol/L,血浆TC水平为(5.17±1.25)mmol/L,血浆UA水平为(377.15±60.15)μmol/L,血浆Cr水平为(87.68±9.97)μmol/L,MHR为2.51±0.35。两组血浆LDL-C、HDL-C水平及MHR比较P均<0.05,血浆TG、TC、UA、Cr水平比较P均>0.05。
2.2 冠状动脉粥样硬化易损斑块的独立危险因素分析 以冠状动脉粥样硬化易损斑块作为因变量,将上述有统计学差异的相关因素作为自变量(合并2型糖尿病赋值1、未合并赋值0,其余变量以实测值赋值),进行多因素Logistic回归分析,结果显示,2型糖尿病、LDL-C、MHR为冠状动脉粥样硬化易损斑块的独立危险因素(P均<0.05)。见表1。
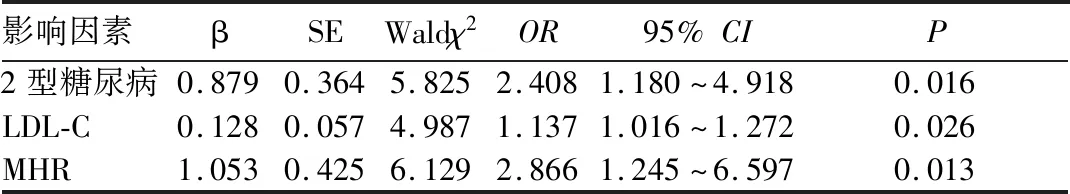
表1 冠状动脉粥样硬化易损斑块危险因素的多因素Logistic回归分析结果
2.3 外周血MHR评估冠状动脉粥样硬化易损斑块的效能分析 ROC曲线分析显示,外周血MHR评估冠状动脉粥样硬化易损斑块的曲线下面积为0.785(95%CI:0.730~0.840),最佳临界值为3.18,此时其诊断敏感性为72.45%、特异性为76.83%。
2.4 外周血MHR与冠状动脉粥样硬化易损斑块坏死核心构成比的关系 绘制外周血MHR与冠状动脉粥样硬化易损斑块坏死核心构成比关系的散点图,见图1。Pearson相关分析显示,外周血MHR与冠状动脉粥样硬化易损斑块坏死核心构成比呈正相关关系(r=0.506,P<0.01)。
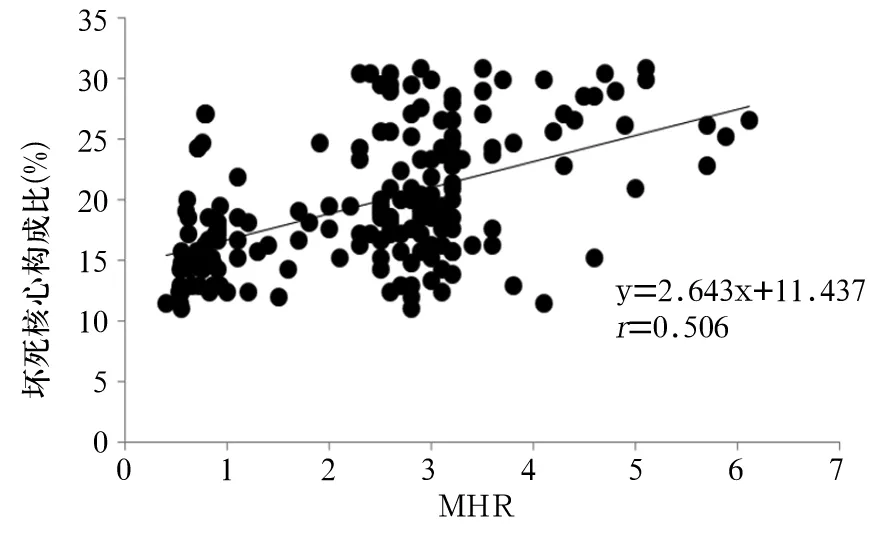
图1 外周血MHR与冠状动脉粥样硬化易损斑块坏死核心构成比关系的散点图
3 讨论
冠心病是冠状动脉粥样硬化性心脏病的简称,是冠状动脉发生粥样硬化病变而引起血管管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病。目前,我国冠心病患者超过1 000万人,且近年来其发病率明显上升并呈年轻化趋势[1]。冠心病的病理基础是冠状动脉粥样硬化。近年研究表明,冠心病的临床表现取决于冠状动脉粥样硬化斑块的稳定与否,而非斑块大小;冠状动脉粥样硬化易损斑块是导致冠心病患者发生MACE的重要原因[10,11]。因此,探索冠状动脉粥样硬化易损斑块的危险因素对预防冠心病患者发生MACE意义重大,也是近年心血管疾病领域研究的热点与难点。
目前,动脉粥样硬化被认为是一种发生在动脉壁的亚临床慢性炎症性疾病。炎症反应介导了动脉粥样硬化起始、进展及最终血栓并发症形成的全过程,而且炎症反应激活是导致动脉粥样硬化斑块不稳定和斑块破裂的重要因素。单核细胞和HDL-C分别作为机体促炎和抗炎因素参与动脉粥样硬化进程。有研究指出,血脂异常或血管内皮受损可激活单核细胞,使其黏附于动脉壁并迁移至内皮下间隙,激活并分化为巨噬细胞,经由清道夫受体吞噬氧化LDL而转化为泡沫细胞,一方面能直接促进动脉粥样硬化斑块脂质核心形成,另一方面能促进多种促炎因子、生长因子和组织因子分泌,加速动脉粥样硬化斑块进展,从而导致动脉粥样硬化斑块破裂风险升高[12]。HDL-C具有胆固醇逆转运、抗炎和抗氧化、抑制单核细胞迁移与活化等生物学作用,能够增强动脉粥样硬化斑块的稳定性[13,14]。MHR是单核细胞计数与血浆HDL-C水平的比值,该指标综合了冠状动脉粥样硬化斑块损伤机制与保护机制的信息,可动态反映促炎因素激活、抗炎因素受抑的动脉粥样硬化斑块炎症反应状态,能够辅助评估冠心病病情和预后,并与冠状动脉粥样硬化斑块的稳定性有关[15,16]。但MHR与冠状动脉粥样硬化易损斑块的关系尚无定论。
本研究单因素Logistic回归分析发现,合并2型糖尿病,白细胞和单核细胞计数,血浆LDL-C、HDL-C水平及外周血MHR可能与冠状动脉粥样硬化斑块的稳定性有关。多因素Logistic回归分析显示,2型糖尿病、LDL-C、MHR均为冠状动脉粥样硬化易损斑块的独立危险因素。2型糖尿病、LDL-C是冠状动脉粥样硬化易损斑块的传统危险因素,在大量研究中已被证实[17~20]。而外周血MHR是否为冠状动脉粥样硬化易损斑块的危险因素尚不清楚。本研究提示,外周血MHR亦为冠状动脉粥样硬化易损斑块的独立危险因素。本研究进一步采用ROC曲线评估外周血MHR辅助诊断冠状动脉粥样硬化易损斑块的效能,结果发现,外周血MHR评估冠状动脉粥样硬化易损斑块的曲线下面积为0.785,最佳临界值为3.18,此时其诊断敏感性为72.45%、特异性为76.83%。提示外周血MHR在辅助诊断冠状动脉粥样硬化易损斑块方面具有较高的临床价值。本研究还分析了外周血MHR与冠状动脉粥样硬化易损斑块坏死核心构成比的关系,结果发现外周血MHR与冠状动脉粥样硬化易损斑块坏死核心构成比呈正相关关系,即冠心病患者外周血MHR越高,冠状动脉粥样硬化易损斑块坏死核心构成比越大,斑块越易破裂,发生MACE的风险越高。
综上所述,外周血MHR是冠状动脉粥样硬化易损斑块的独立危险因素;外周血MHR可辅助识别冠状动脉粥样硬化易损斑块。

