急性呼吸窘迫综合征患者血清sCD14和LBP水平变化及其临床意义
陈德和,周金林,陈朋,肖高雄,罗熠,张仕国
巴中市中心医院,四川巴中636000
急性呼吸窘迫综合征(ARDS)是临床常见的急危重症,是在严重感染、休克、创伤等非心源性疾病过程中,肺毛细血管内皮细胞和肺泡上皮细胞损伤造成弥慢性肺间质和肺泡水肿,导致的急性低氧性呼吸功能不全或衰竭,临床上以难治性呼吸衰竭和顽固性低氧血症为主要表现[1,2]。如果不及时有效治疗,ARDS能够引起急性胰腺炎、脓毒症、休克等并发症,患者预后较差,病死率为35%~50%[3]。因此,早期评估ARDS病情并制定针对性干预措施,对改善患者病情、降低病死率具有重要意义。ARDS的本质是多种炎症细胞及其释放的炎症介质和细胞因子间接介导的肺脏炎症反应[4]。可溶性白细胞分化抗原14(sCD14)是存在于单核细胞、巨噬细胞表面的一种白细胞分化抗原。有研究发现,sCD14可通过与病原体抗原结合,从而介导机体炎症反应[5]。脂多糖结合蛋白(LBP)是由肝脏合成和分泌的一种急性期蛋白。有研究发现,LBP可参与机体多种炎症性疾病的发生、发展,如全身炎症反应综合征、脓毒症等[6]。但目前血清sCD14、LBP与ARDS发生、发展关系的报道相对较少。为此,本研究观察了ARDS患者血清sCD14、LBP水平变化,并探讨其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择2016年1月~2019年1月巴中市中心医院收治的ARDS患者153例。所有患者符合2012年ARDS柏林定义[7]。纳入标准:①符合ARDS临床诊断;②年龄≥18岁;③临床病历资料完整。排除标准:①存在肺结核、肺栓塞等其他肺部疾病者;②合并恶性肿瘤、急慢性炎症反应性疾病或自身免疫性疾病者;③合并心、肝、肾等重要脏器严重功能障碍者;④入院前1个月内接受过免疫抑制剂或激素类药物治疗者;⑤有精神疾病者;⑥妊娠期或哺乳期妇女。根据氧合指数(PaO2/FiO2)[8]将患者分为轻度组(200 mmHg 1.2 血清sCD14、LBP检测 ARDS患者入院次日,健康体检者体检当日,采集清晨空腹肘静脉血5 mL,室温下静置5 min,3 000 r/min离心10 min,离心半径为10 cm,留取上清液,-80 ℃保存待测。采用日立7170A全自动生化分析仪、ELISA法检测血清sCD14、LBP。sCD14 ELISA试剂盒购自德国IBL公司,LBP ELISA试剂盒购自上海西唐生物科技有限公司。所有操作严格按试剂盒说明进行。 2.1 两组血清sCD14、LBP水平和PaO2/FiO2比较 见表1。 表1 两组血清sCD14、LBP水平比较 注:与对照组比较,*P<0.05;与轻度组比较,#P<0.05;与中度组比较,△P<0.05。 2.2 ARDS患者血清sCD14、LBP水平与PaO2/FiO2的关系 Pearson积矩相关分析显示,ARDS患者血清sCD14、LBP水平与PaO2/FiO2均呈负相关关系(r分别为-0.729、-0.716,P均<0.05)。 2.3 ARDS存活者与死亡者血清sCD14、LBP水平比较 治疗后随访28 d,存活93例、死亡60例。ARDS存活者与死亡者血清sCD14水平分别为(46.18±19.27)、(63.45±20.29)μg/L,血清LBP水平分别为(82.24±21.60)、(119.86±20.57)μg/mL。ARDS存活者血清sCD14、LBP水平均低于死亡者(t分别为-5.308、-10.716,P均<0.05)。 2.4 血清sCD14、LBP预测ARDS患者死亡的效能分析 ROC曲线分析显示,血清sCD14预测ARDS患者死亡的曲线下面积(AUC)为0.855(95%CI:0.797~0.912),cut off值为55.24 μg/L,此时其预测ARDS患者死亡的敏感性为82%、特异性为79%、准确性为85%;血清LBP预测ARDS患者死亡的AUC为0.834(95%CI:0.773~0.896),cut off值为95.64 μg/mL,此时其预测ARDS患者死亡的敏感性为79%、特异性为75%、准确性为81%;血清sCD14联合LBP预测ARDS患者死亡的AUC为0.929(95%CI:0.892~0.966),其预测ARDS患者死亡的敏感性为92%、特异性为88%、准确性为95%。见图1。 ARDS是各种肺内、肺外致病因素导致的急性弥漫性肺损伤和进而发展的急性呼吸衰竭,是临床常见的急危重症,其病情发展迅速,病死率较高[9,10]。目前,ARDS的诊断主要依靠临床表现和胸部影像学改变,但易受临床医师主观经验的影响。此外,胸部影像学检查不能及时反映病情变化且存在辐射风险。因此,寻找敏感性和特异性均较好的客观指标辅助ARDS早期诊断、病情评估和预后判断成为近年研究的热点。 ARDS的发病机制目前尚不十分清楚,现普遍认为是全身炎症反应综合征在肺部失控的结果,各种炎症细胞及其释放的炎症介质和细胞因子诱发瀑布式炎症级联反应,从而导致肺损伤[11,12]。CD14是存在于单核细胞、巨噬细胞等表面的白细胞分化抗原,在人体内有两种存在形式,一种是位于细胞膜表面的结合型CD14,一种是游离存在于血清或尿液中的sCD14,其中sCD14占CD14含量的99%左右[13]。有研究发现,sCD14作为细胞糖蛋白家族成员,是革兰阴性菌内毒素脂多糖的高亲和受体,能够介导机体免疫反应和炎症反应过程[14]。钱平等[15]研究发现,sCD14能够介导脂多糖引起细胞炎症反应,提高白细胞对内毒素反应的敏感性,从而参与脓毒症的发生、发展,并可作为脓毒症诊断和预后判断的血清学指标之一。Sabry等[16]研究证实,类风湿关节炎患者血清sCD14水平明显升高,并与C反应蛋白呈正相关关系,提示血清sCD14水平能够反映炎症反应强度。杨镛等[17]研究报道,sCD14在感染发病过程中呈高水平,是评估组织损伤程度和感染程度敏感的血生化指标。LBP是由肝脏合成并分泌的一种糖蛋白,相对分子量为55~60 kD。在生理状态下,循环血液中LBP维持在5~10 μg/mL。当机体发生炎症、损伤等应激反应时,血清LBP水平急剧升高。作为脂多糖的载体蛋白,LBP与类脂A具有高度亲和性,可刺激内皮细胞、单核-巨噬细胞等释放大量的炎症介质,从而导致脓毒症休克、全身炎症反应综合征等炎症性疾病[18,19]。焦京等[20]报道,以26.84 mg/L为临界值,血清LBP诊断脓毒症的敏感性和特异性均超过95%;当血清LBP水平超过54.16 mg/L时,其预测脓毒症患者死亡的敏感性和特异性均超过80%。李乐辉等[21]认为,LBP是激活先天性免疫反应的首要步骤,是介导先天性免疫反应与动脉粥样硬化发生的桥梁。但目前血清sCD14、LBP与ARDS发生、发展关系的报道相对较少。 图1 血清sCD14、LBP单独或联合预测ARDS患者死亡的ROC曲线 本研究结果发现,轻度组、中度组、重度组血清sCD14、LBP水平均高于对照组,且随着ARDS病情加重,血清sCD14、LBP水平逐渐升高。提示sCD14、LBP均参与ARDS的发生、发展,且其水平越高,ARDS病情越重。LBP参与炎症反应过程与炎症级联信号通路密切相关,而sCD14能够特异性识别、结合LBP复合物并将其呈递给Toll样受体,Toll样受体通过激活核因子-κB信号转导通路,从而促使炎症细胞合成并释放大量炎症介质或细胞因子,引起组织器官损伤和全身炎症反应[22]。本研究结果发现,ARDS患者血清sCD14、LBP水平均与PaO2/FiO2呈负相关关系,进一步提示血清sCD14、LBP水平可作为评估ARDS患者病情程度的重要指标。本研究结果还发现,ARDS存活者血清sCD14、LBP水平低于ARDS死亡者,提示血清sCD14、LBP水平与ARDS患者预后可能有关,二者水平越高,ARDS病情越重,患者预后越差。本研究采用ROC曲线分析了血清sCD14、LBP单独或联合预测ARDS患者预后的效能,结果发现,血清sCD14、LBP单独对预测ARDS患者预后均有一定价值,而二者联合的预测价值优于二者单独,二者联合时预测ARDS患者死亡的AUC高达0.929,敏感性、特异性和准确性分别为92%、88%、95%。结果提示,早期检测血清sCD14、LBP水平有利于临床识别ARDS高危患者,从而尽早实施有效的干预措施。 综上所述,ARDS患者随着病情加重,血清sCD14、LBP水平逐渐升高。血清sCD14、LBP联合检测可用于ARDS早期诊断、病情评估和预后监测。但由于本研究样本量相对较少且为回顾性分析,其结论准确性还有待于进一步验证。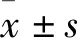
2 结果

3 讨论


