载多西紫杉醇超声微泡对乳腺癌MCF-7 细胞增殖和凋亡影响的研究
李炯,顾海涛
1.重庆市渝北区人民医院乳腺外科,重庆 401120;2.重庆医科大学附属第二医院普通外科,重庆 400010
近些年国内超声分子显像技术发展迅猛, 靶向超声造影剂的设计及制备逐步成为研究主流[1]。 虽然靶向超声造影剂目前仍然在临床前实验的阶段, 但是从国内外研究成果来看,已经初步展现出其应用价值。 它能够在疗效监测、 癌症鉴别以及作为基因和药物载体介导癌症靶向治疗等方面发挥重要作用[2-3]。 该研究通过制备出靶向载多西紫杉醇超声微泡, 探讨其在体外的乳腺癌MCF-7 细胞上的寻靶能力及对其增殖及凋亡的影响,现报道如下。
1 材料与方法
1.1 主要材料与仪器
NB 培养基;DSPC;DPPE、DPPA;Docetaxel; 荧光染料DiI;PI 染液;基质胶;银汞胶囊调合器。
1.2 实验方法
①细胞培养:在适宜条件的浮箱中培养乳腺癌MCF-7 细胞。
②确定多西紫杉醇药物浓度及计算细胞增殖抑制率。
③细胞分组及处理 (共分6 组:C、LDLM、Doc、PLM+US、Doc+US、LDLM+US)。
④使用MTT 法检测对乳腺癌MCF-7 细胞增殖的影响,乳腺癌MCF-7 细胞增殖抑制率(%)=[(A 对照组-A 实验组)/A 对照组]× 100%。
⑤使用Annexin V-FITC 检测细胞凋亡。
⑥检测并分析细胞周期分布。
⑦细胞侵袭实验。
1.3 统计方法
应用SPSS 18.0 统计学软件进行数据分析, 计量资料用(±s)表示,组间比较行t检验。 在数据录入之后进行定量或定性的处理, 采用离散或连续类型方式实现对数据的录入,针对定性的数据不应用分类处理。P<0.05 为差异有统计学意义。
2 结果
乳腺癌MCF-7 细胞的增殖抑制率与多西紫杉醇药物浓度与作用时间成正相关,见表1。
表1 不同浓度多西紫杉醇乳腺癌细胞NCF-7 的增殖抑制Table 1 NCF-7 proliferation inhibition of breast cancer cells with different concentrations of docetaxel(±s)

表1 不同浓度多西紫杉醇乳腺癌细胞NCF-7 的增殖抑制Table 1 NCF-7 proliferation inhibition of breast cancer cells with different concentrations of docetaxel(±s)
多西紫杉醇药物浓度(mol/L)空白对照组不同时间点的增殖抑制率24 h 48 h 72 h 0 0 0 5×10-7 1×10-7 5×10-8 1×10-8 5×10-9 1×10-9 5×10-10 1×10-10 0.916±0.006 0.811±0.005 0.713±0.006 0.636±0.007 0.560±0.004 0.568±0.005 0.359±0.008 0.327±0.023 0.917±0.006 0.850±0.004 0.801±0.004 0.725±0.005 0.731±0.006 0.644±0.004 0.496±0.006 0.399±0.008 0.959±0.005 0.956±0.005 0.858±0.006 0.792±0.005 0.785±0.003 0.712±0.004 0.507±0.004 0.489±0.005
乳腺癌细胞MCF-7 的增殖抑制与作用时间成正相关,其中LDLM+US 组抑制率高于各组,见表2。
表2 各组不同时间点对乳腺癌细胞MCF-7 的增殖抑制率[(±s),%]Table 2 Inhibition rate of breast cancer cell MCF-7 at different time points in each group[(±s),%]

表2 各组不同时间点对乳腺癌细胞MCF-7 的增殖抑制率[(±s),%]Table 2 Inhibition rate of breast cancer cell MCF-7 at different time points in each group[(±s),%]
组别 24 h 48 h 72 h C PLM+US LDLM Doc Doc+US LDLM+US 0 0 0 0.120 1±0.003 7 0.178 6±0.001 0 0.223 8±0.003 2 0.299 3±0.003 4 0.402 4±0.001 9 0.513 4±0.003 9 0.499 8±0.001 8 0.634 5±0.001 8 0.699 8±0.004 7 0.752 3±0.002 9 0.812 5±0.002 0 0.903 6±0.003 6 0.933 6±0.001 5 0.965 4±0.001 8 0.987 2±0.001 5
Annexin V-FITC 荧光染色联合流式细胞仪检测结果显示LDLM+US 组细胞凋亡率最高,见表3 。
表3 Annexin V-FITC 荧光染色联合流式细胞术检测乳腺癌细胞MCF-7 的凋亡率[(±s),%]Table 3 Annexin V-FITC fluorescence staining combined with flow cytometry to detect the apoptosis rate of breast cancer cell MCF-7[(±s),%]

表3 Annexin V-FITC 荧光染色联合流式细胞术检测乳腺癌细胞MCF-7 的凋亡率[(±s),%]Table 3 Annexin V-FITC fluorescence staining combined with flow cytometry to detect the apoptosis rate of breast cancer cell MCF-7[(±s),%]
组别组别C PLM+US LDLM Doc Doc+US LDLM+US F 值P 值2.866±0.203 8.023±0.258 11.236±1.365 17.568±1.075 29.605±3.665 45.558±8.455 69.591 0.000
细胞周期检测结果各处理组G2/M 期细胞比例有不同程度的增高,LDLM+US 组G0/G1 期细胞比例减少最明显,G2/M 期细胞比例升高最明显;Doc+US 组G2/M 期细胞比例也明显增高,见表4 。
表4 各组乳腺癌MCF-7 细胞的周期分布[(±s),%]Table 4 Cycle distribution of breast cancer MCF-7 cells in each group[(±s),%]
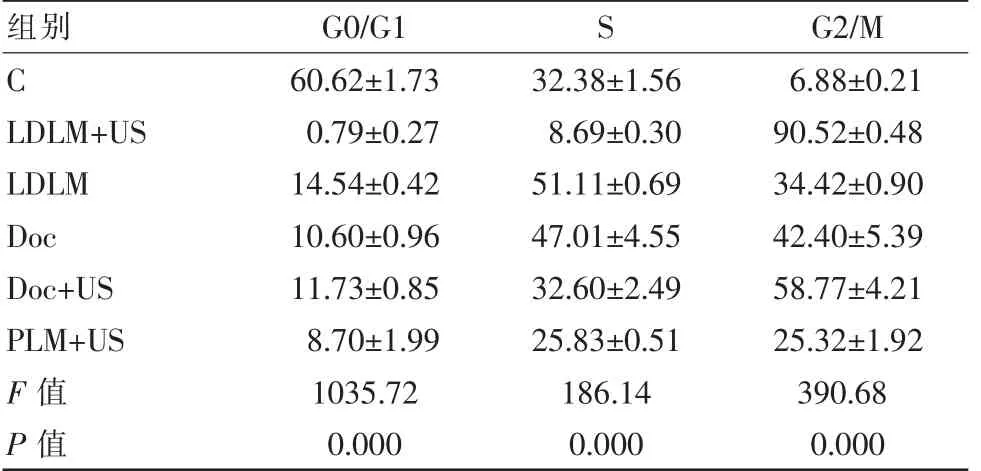
表4 各组乳腺癌MCF-7 细胞的周期分布[(±s),%]Table 4 Cycle distribution of breast cancer MCF-7 cells in each group[(±s),%]
组别 G0/G1 S G2/M C LDLM+US LDLM Doc Doc+US PLM+US F 值P 值60.62±1.73 0.79±0.27 14.54±0.42 10.60±0.96 11.73±0.85 8.70±1.99 1035.72 0.000 32.38±1.56 8.69±0.30 51.11±0.69 47.01±4.55 32.60±2.49 25.83±0.51 186.14 0.000 6.88±0.21 90.52±0.48 34.42±0.90 42.40±5.39 58.77±4.21 25.32±1.92 390.68 0.000
Transwell 法检测转染后对乳腺癌MCF-7 细胞侵袭力的影响: 各组经过相应处理的MCF-7 细胞穿过transwell上下室之间聚碳酸酯膜的结果如下,对照组及PLM+US 组穿过室膜的细胞数量较多,而Doc+US 组和LDLM+US 组穿过的细胞数量较少,其中LDLM+US 组穿过的细胞数最少。两组与其他组相比, 差异有统计学意义 (P<0.01),而LDLM+US 组所侵袭细胞数量最低(P<0.05)与Doc+US 组相比。
3 讨论
多西紫杉醇是目前国内比较常用的抗癌药物, 其药物原理不仅可以抑制微管解聚, 更可以促进微管的蛋白装配,进而抑制肿瘤细胞的有丝分裂,因此该实验选择多西紫杉醇载入微泡[3-4]。 乳腺癌MCF-7 细胞因其培养方法相对简单,通常作为细胞实验常用的细胞株,且培养方法相对比较简单易操作。 体细胞的增值失调与死亡抑制是肿瘤发生的两大关键因素。 因此,抑制肿瘤细胞繁殖与诱导肿瘤细胞凋亡是肿瘤治疗的主要方向之一, 同时抑制肿瘤细胞的繁殖与凋亡诱导作用的强弱也成为评价抗肿瘤药物疗效的重要标准[5-6]。 该实验采用MTT 法研究了8个不同浓度组的多西紫杉醇对乳腺癌MCF-7 细胞的增殖抑制作用, 其结果显示该乳腺癌细胞的活性与药物的作用时间和药物浓度成正相关, 且在作用24 h 时1×10-9mol/L 以上浓度组的增殖抑制率均高于50%,从而确定了多西紫杉醇干预浓度为1×10-9mol/L 为实验基础浓度。 通过Annexin VFITC 检测的各组细胞凋亡率结果显示:对照组最低 (2.866±0.203),LDLM+US 组的细胞凋亡率最高(45.558±8.455), Doc+US(29.605±3.665 ) 组、Doc(17.568±1.075)组次之。流式细胞仪检测和电镜观察的结果基本一致,均表明了LDLM+US 组的促凋亡作用最强。 MTT 法检测干预因素对乳腺癌MCF-7 细胞增殖的影响。 结果显示LDLM+US 组24、48、72 h (0.933 6±0.001 5);(0.965 4±0.001 8);(0.987 2±0.001 5)的细胞增殖抑制率明显高于其他各组,其原因主要在于超声微泡的作用,使癌细胞膜的空隙变大, 提高了其通透性, 使药物方便进入细胞内部,从而起到关键抑制作用。 单纯载药微泡组对肿瘤细胞也有增殖抑制作用, 说明微泡所载多西紫杉醇仍能保持原有的抗癌活性,但该组抑制率低于单纯药物组,考虑其可能的原因为载药微泡未受到超声波的辐照, 自身破裂缓慢,包裹于磷脂外壳中的药物无法充分释放,使药物浓度降低;PLM+US 组的细胞增殖抑制率低,说明空化效应、声孔效应等使细胞表面产生的空隙是短暂的、可逆的,未对肿瘤细胞的增殖产生根本的影响;Doc+US (0.7523±0.002 9) 组的增殖抑制作用也较明显, 且强于Doc(0.499 8±0.001 8)组,说明超声波本身具有的空化效应、声孔效应等促进了药物的吸收, 提高了疗效。 在2018 年曾乌查等学者[7-8]发表一篇《西紫杉醇血药浓度监测在乳腺癌化疗中的临床应用》中,其载药微泡+超声组24、48、72 h 的数据分别为:(0.896 6±0.004 7);(0.863 4±0.003 5);(0.895 4±0.002 8)的细胞增殖抑制率明显高于其他组,该实验载药微泡+超声组24、48、72 h (0.933 6±0.001 5);(0.965 4±0.001 8);(0.987 2±0.001 5),通过对比,该实验结果略高于其数据,分析原因:极有可能是该实验在浮箱中培养乳腺癌MCF-7 细胞时,由于温度略高于实验正常温度,固始MCF-7 细胞存活率上升,导致实验数据偏高。 其他实验组均与该实验基本一致。
该实验证实了LDLM 联合 UTMD 对乳腺癌细胞MCF-7 具有明显的增殖抑制和凋亡促进作用, 为后续进一步从蛋白、 基因层面探索其作用的机制奠定了重要的基础,提供了依据。