红曲色素高产菌的诱变选育与发酵优化
黎青华,堵国成*,李江华,刘 松
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏 无锡214122)
红曲霉菌——真菌界、子囊菌门、子囊菌纲、散囊菌目、红曲科[1],由法国科学家Van Tieghem于1884年分类并命名。红曲红色素是红曲霉的次级代谢产物,是一种用微生物发酵制备的安全无毒的天然食用色素[2]。随着生活水平的提高和安全意识的增强,红曲色素的市场需求量也随之迅速扩大[3-4]。
红曲红色素可替代亚硝酸盐作为肉制品中的着色剂,不仅赋予肉制品鲜艳的光泽,还大大降低了肉制品中致癌物亚硝酸盐含量[5-6]。红曲红色素应用在红曲饼干、红曲面包、红曲糕点、红曲面条等面制品中,不影响产品的口感[6]。红曲红色素还可作为调色剂应用于饮料和医药方面等[7],如红曲葡萄酒、红曲饮料等。
目前红曲红色素生产有固态发酵和液态发酵两种方式。郑虹等[8]以大米与玉米粒为基质,红曲霉固态发酵产红曲色素的色价可达到1 005.42 U/g。童爱均等[9]利用响应面法对固态发酵条件进行优化,使红曲色素色价达到6 684.16 U/g。由于发酵周期较长、条件不易控制且容易染菌,固态发酵已逐渐失去市场竞争力。液态发酵不但工艺上自动化程度高、周期短,而且产品质量稳定、纯度高[10-11]。然而,红曲霉液态发酵产红曲红色素的能力较低,目前国内液态发酵的平均色价水平为650 U/mL,这严重制约着液态发酵的推广与应用[12-13]。
选育适于液态发酵产红曲红色素的高产菌株及优化液态发酵工艺是提高液态发酵色素产量的重要策略[14]。常压室温等离子体诱变技术(ARTP)诱变比传统物理与化学诱变技术更高效、安全、便捷,且诱变所得突变株具有良好的遗传稳定性,因而受到广大研究者的青睐[15]。
作者利用ARTP技术对紫红曲霉(Monascus purpureus)LBBE进行诱变,获得了高产菌株,优化了高产菌的发酵条件并验证其在50 L罐中的发酵性能。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株紫红曲霉(Monascus purpureus)LBBE,作者所在实验室保藏菌种。
1.1.2 培养基
1)斜面培养基(质量分数) 可溶性淀粉4%,麦芽糖4%,蛋白胨3%,琼脂粉2%;乳酸调至pH 5.3。
2)种子培养基(质量分数) 籼米粉5%,玉米浆1.2%,NaNO30.2%,酵母膏0.9%,KH2PO40.18%,MgSO4·7H2O 0.09%;乳酸调至pH 4.5。
3)发酵培养基(质量分数) 籼米粉12.5%,黄豆粉2.5%,玉米浆0.9%,NaNO30.18%。先加入0.15%~2%的中温α-淀粉酶升温至60℃,酶解30 min,再用乳酸调至pH 3.7。
1.2 实验方法
1.2.1 活化培养从成熟的红曲平板上挑取几环红曲霉菌于加有玻璃珠的无菌去离子水中,摇匀打散后用脱脂棉过滤制成孢子悬液,稀释后涂布PDA平板,成熟后挑选直径较大、颜色较红的单菌落转接PDA试管斜面,33.5℃培养6~7 d。
1.2.2 常压室温等离子体(ARTP)诱变将红曲霉从试管斜面转接平板,培养成熟后用无菌水刮取洗涤红曲霉平板,利用脱脂棉过滤后获得孢子悬液。然后用无菌去离子水洗涤2~3次,去掉溶解的色素,悬浮备用。取制好的孢子悬液,血球计数板计数调整至合适浓度(107个/mL,体积分数15%甘油),取10μL孢子悬液均匀涂于载片上进行诱变。诱变条件设为:通气量10 SLM、功率80 W、时间分别为0、10、20、30、40、50、60 s。诱变结束后,将载片浸于500μL的无菌水中振荡洗脱,稀释10倍、100倍、1 000倍后分别取50μL悬液涂布PDA平板,0 s计数为B,其他计数为A。
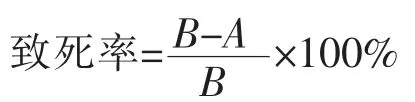
其中,A为诱变后存活孢子数;B为诱变前总孢子数。
1.2.3 摇瓶发酵挑取2~3环红曲霉菌菌丝体接种到种子培养基中(50 mL/500 mL),33.5℃、220 r/min摇床培养24 h。然后按8%的接种体积分数将种子液转接发酵培养基(60 mL/500 mL),33.5℃、220 r/min发酵培养6 d,挑选红曲红色价高的菌株并统计正向突变率。
1.2.4 传代稳定性验证对挑选出来的高产菌株进行试管斜面传代,培养成熟后再次进行摇瓶发酵,检测红曲色素色价,循环传代5次,验证传代稳定性。
1.2.5 培养条件优化
1)接种体积分数优化 将培养成熟的种子液分别按5%、6%、7%、8%、9%、10%等6个不同的接种体积分数接种到发酵液中,33.5℃、220 r/min培养6 d,以红曲红色价为指标,考察接种体积分数对色素积累的影响。
2)发酵的初始pH优化 分别选取3.5、3.7、3.9、4.1、4.3、4.5为发酵培养基的初始pH值,考察色素积累情况。
3)金属离子的优化 在初始培养基的基础上,分别添加1 g/L的CaCl2、MnSO4、FeSO4、ZnSO4,以红曲红色价为指标探究各金属离子的影响。
1.2.6 50 L罐发酵
1)摇瓶种子培养 向长有成熟红曲霉的茄子瓶中加入30 mL无菌水刮取洗涤孢子,脱脂棉过滤后获得孢子悬液。取5 mL孢子悬液接种于装液600 mL种子培养基的3 L摇瓶中,33.5℃、200 r/min培养24 h。
2)二级种子罐培养 将600 mL摇瓶种子全部接入装液量70%的10 L种子罐,0.75 vvm、300 r/min培养20 h。
3)50 L罐分批发酵:按7%的接种体积分数将二级种子罐接入装液量70%的50 L发酵罐,33.5℃培养96 h。期间根据菌丝的生长状态适当调整通气量和转速。接种后,调整通气量和转速分别为0.25 vvm和300 r/min;接种6 h后调至0.38 vvm和350 r/min;接种24 h调至0.75 vvm和350 r/min,第37.5小时调至0.75 vvm和400 r/min至发酵结束。
1.2.7 色价检测用移液管准确吸取10 mL发酵液于100 mL容量瓶中,然后加入90 mL体积分数70%的酒精,摇匀后静置30 min,离心后取上清液,用体积分数70%酒精稀释适当的倍数于1 cm比色皿中,用分光光度计检测波长为505 nm处的吸光度(A)。
色价(U/mL)=A×总稀释倍数
1.2.8 单糖测定斐林试剂法测定还原糖质量浓度。
1.2.9 总糖测定取10 mL发酵液,加入5 mL水和5 mL体积分数50%硫酸溶液,煮沸5 min,然后用斐林试剂法测定还原糖质量浓度。
2 结果与分析
2.1 诱变致死率优化
ARTP即常压室温等离子体,能够在大气压下产生温度在25~40℃之间的、具有高活性粒子浓度的等离子体射流,等离子体会对细胞结构产生破坏而导致细胞死亡[15]。但也有少数细胞会通过自身的修复存活下来,同时会带来突变。采用ARTP对红曲红孢子悬液进行诱变,控制诱变时间为惟一变量,通过孢子萌发计数的方法,得出的致死率与诱变时间的关系。随机挑取一定数量的单菌落发酵,统计色价情况,获得正突变率与致死率的变化情况,见图1。随着诱变时间的延长,孢子的致死率越来越高,30 s致死率达到85%以上。正突变率整体呈现先上升后下降的趋势,30 s和40 s的正突变率分别为45.2%和44.6%,相差不大,而因为高致死率有利于缩小突变库,故诱变条件确定为:通气量10 SLM、功率80 W、时间40 s,此时保证高正突变率的情况下,致死率达到了95%。

图1 ARTP诱变的正突变率与致死率关系Fig.1 Relationship between positive mutation rate and lethality rate of ARTP mutagenesis
2.2 多轮迭代诱变对红曲色素发酵的影响
在致死率为95%的条件下对红曲孢子悬液进行诱变,涂板后获得单菌落。为了尽可能挑选高产菌株,观察并比较单菌落与色圈的直径比,比值越小越好,同时观察色圈颜色的深浅,越深越好。将挑选的突变株进行摇瓶发酵,挑选色价最高的菌株传代并作为下一轮诱变的出发菌株。如图2,在第一次诱变时,出发菌株对诱变条件非常敏感,正突变率高达44.6%,随着诱变次数的增加,正突变率明显下降。在经过10轮诱变筛选后,突变株LBBE-15最高色价达到1 244 U/mL,相比最初出发菌株提高了1.26倍,而正突变率由最初的44.6%降到3.8%。可能是随着诱变次数的增加,菌株对诱变条件产生了一定的“疲劳效应”[16]。
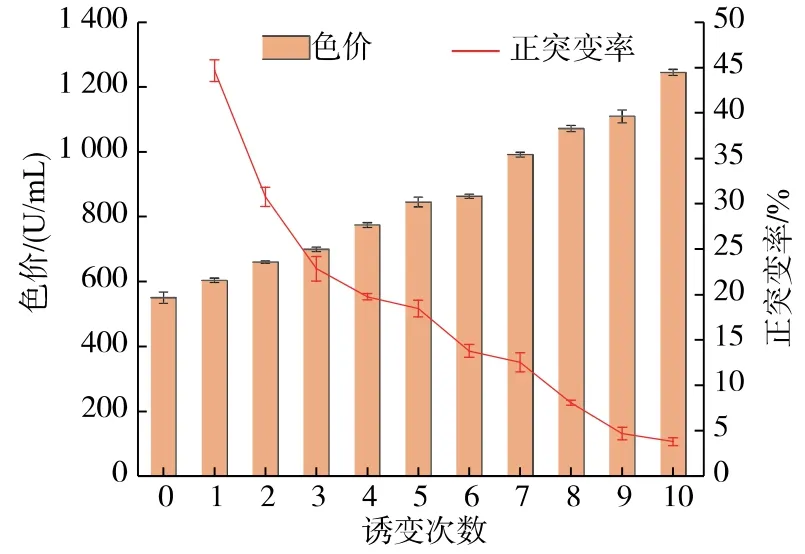
图2 诱变次数对色价及正向突变率的影响Fig.2 Effects of mutagenesis on color value and forward mutation rate
2.3 高产菌株遗传稳定性分析
经过10轮诱变,获得的红曲红色素高产突变株LBBE-15形态也发生了较大的变化,见图3。菌丝变得纤长粗壮,交错更加紧密。在深层发酵中,可以将菌丝体的生长状态分为活性生长区域、非活性生长区域、小空泡区、衰退区域与自溶区,次级代谢产物通常与菌丝体的非活性生长部位有关[20]。纤长的菌丝具有更长的非活性生长区域,有利于积累更多的红曲色素。对突变株进行5次连续传代,并且每一代都进行摇瓶发酵培养,以红曲红色价为指标,考察其遗传稳定性,结果见图4。在相同的培养条件下,各代间色价的波动范围很小,说明突变株的遗传稳定性很好。

图3 红曲霉单菌落Fig.3 Single colony of Monascus

图4 突变株遗传稳定性分析Fig.4 Genetic stability analysis of mutant strain
2.4 培养条件对红曲发酵的影响
基于种群的数量平衡原理[17],摇瓶发酵时,种子液的接种体积分数直接决定了其种群的数量。接种体积分数太低,菌丝生长缓慢,会延长发酵周期,降低发酵效率。接种体积分数太高,菌丝生长太快,营养物质过快被消耗,不利于色素积累。合适的接种体积分数有利于缩短发酵周期,同时也会对红曲色素的积累带来较大影响[10]。如图5所示,相同条件下,接种体积分数为7%时色价最高。

图5 接种体积分数对色价的影响Fig.5 Effect of inoculation amount on color value
红曲霉是一种嗜酸菌,尤嗜乳酸,生长的最适pH为3.5~5。培养基的pH值会影响微生物的生理特性[18]。细胞膜上的电荷情况会受pH的变化而变化,一方面会影响细胞对营养物质的吸收,另一方面会影响色素的分泌。因此,确定好红曲霉生长繁殖的最初pH值是提高色价的关键因素之一。如图6所示,pH为3.7时,发酵效果最好。

图6 pH值对色价的影响Fig.6 Effect of pH on color value
根据微生物生长的特性,通过优化培养基的组成,如碳源、氮源、金属离子的浓度及种类,控制丝状真菌形态[19]。有报道证明Ca2+、Fe2+、Mn2+、Zn2+等离子都与菌丝体合成有关[20-21]。试验选取不同金属离子,考察其对红色素合成的影响,结果见图7。锰离子和亚铁离子对色素的积累有促进作用,钙离子和锌离子的存在不利于红曲色素的积累。

图7 金属离子对色价的影响Fig.7 Influence of metal ions on color value
2.5 50 L罐发酵
50 L罐发酵实验中,为了研究溶氧条件对色素积累的影响,恒定转速为400 r/min,控制通气量分别为0.5、1.0、1.5 vvm进行分批发酵,同时对色价和菌丝体的形态进行监控,菌丝形态见图8。

图8 发酵过程中的菌丝状态Fig.8 Morphology of mycelium during fermentation
试验结果表明,溶氧的不同会直接影响菌丝体的形态,从而影响色素的积累。0.5 vvm溶氧条件下,菌丝生长缓慢,菌丝球松散稀疏,主要呈球状菌丝体,色素积累缓慢,发酵周期延长;1.0 vvm溶氧条件下,菌丝生长迅速,菌丝纤长粗壮。进入稳定期后菌丝相对致密,主要呈簇状菌丝体,此时色素大量积累;1.5 vvm溶氧条件下,菌丝生长迅猛,菌丝交错致密,呈紧密簇状菌丝体,发酵液粘度增加,发酵体系溶氧不均,在线溶氧波动很大。随后发酵液中出现大量分生孢子,原料消耗很快,发酵周期缩短,色素积累很少。
将高产突变菌株LBBE-15进行50 L发酵罐分批发酵试验,控制通气量为1.0 vvm,手动调整转速使溶氧在20%左右。发酵过程中对pH、单糖、总糖及色价进行检测,每12小时取一次样,结果见图9。随着菌丝的生长,发酵液的pH缓慢上升。在前24 h,菌丝呈对数生长,溶氧迅速下降。菌丝分泌的淀粉酶对米粉进行酶解使得单糖质量浓度升高,但没有色素积累。24 h后菌丝继续生长,糖不断被消耗,并开始积累色素。到96 h糖基本耗完,发酵结束,最终获得色价为642 U/mL。
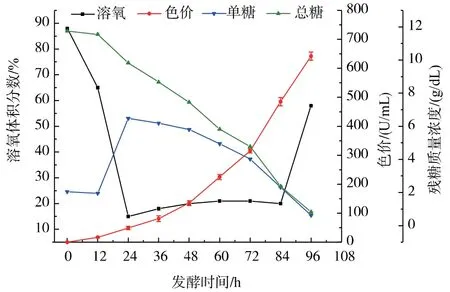
图9 突变株LBBE-15 50 L罐发酵曲线Fig.9 Fermentation curve of 50 L jar-fermenter of mutant strain LBBE-15
从发酵结果看,发酵罐中的色价水平只有摇瓶的一半,对比分析摇瓶和发酵罐的发酵液发现,发酵罐中菌丝生长不好,菌丝量明显低于摇瓶,分析主要原因是发酵培养基本身太粘稠造成溶氧总体上处于偏低的水平。而单方面增加通气量和转速会短时间增加发酵体系的溶氧,但菌丝的迅速生长会增加体系的粘稠度造成溶氧不均,且加大转速带来的剪切力会打断菌丝。这也解释了在通气量为1.5 vvm时的分批发酵失败的原因,同时也说明发酵工艺还有很大的改善空间。后续会着重对发酵培养基的成分及比例进一步调整和优化,在保证正常溶氧的基础上再进行发酵条件的优化。
3 结语
为提高红曲霉液态发酵产红曲色素能力,加快红曲霉液态发酵生产红曲色素工业化进程。经过10轮的ARTP诱变和筛选,获得的突变菌株LBBE-15最高色价可达1 244 U/mL,传代稳定后经简单的培养条件优化,摇瓶色价可达到1 376 U/mL,较出发菌株色素生产能力有较大提高。在此基础上,尝试对突变株LBBE-15进行了50 L发酵罐分批发酵试验,通过对转速和通气量的控制,发酵96 h可使色价达到642 U/mL,为后续菌株的放大培养提供参考。
相对于常规的诱变技术,ARTP诱变更加高效、安全、便于操作,且能有效对红曲霉菌进行诱变,获得高产菌株[15,22]。但实验中随着诱变次数的增加,菌株表现出了一定的“疲劳效应”,导致正突变率不断降低[16]。因此,多种方式的交叉诱变可减少“疲劳效应”的影响,诱变效果会更好。
在丝状真菌液态深层发酵中,溶氧是一个关键性问题,溶氧的好坏会直接影响菌丝生长的状态,而菌丝的生长形态直接影响色价的高低。需要注意的是,在丝状真菌液态深层发酵时,丝状真菌生长成菌丝球,会使培养基变得粘稠,不利于溶质传氧[23]。为了保证溶氧,需要提高转速并增加通气量,但增大的剪切力会打断菌丝体,不利于色素的积累。因此,如何控制转速和通气量是保证所需溶氧的情况下有效提高液态发酵色价的关键。

