超声振荡改性玉米醇溶蛋白及高F值寡肽制备
李婷婷,田亚平*,周楠迪,孙付保,王志翠
(1.江南大学工业生物技术教育部重点实验室,江苏 无锡214122;2.纽绥笙特殊医用食品江苏有限公司,江苏泰州225300)
玉米醇溶蛋白(Zein),其含量位居玉米蛋白首位,约占比60%[1];其具有成膜、黏结、生物降解和抗氧化等特性,被用于制作保鲜、药物缓冲、活性包装等材料[2],但以其为原料酶法制备活性肽就需要解决其易形成“粘弹性面筋团”的现象[3];其富含异亮氨酸、亮氨酸,缺乏色氨酸,是用于生产高F值寡肽的优质天然蛋白质[4]。
高F值寡肽,其为一类混合物,相对分子质量为200~1 000;其组成独特,F值大于20,苯丙氨酸(Phe)和酪氨酸(Tyr)含量不超过2%[5];其较氨基酸产品更易被生物体利用[6-7]。其中,F值为支链氨基酸(BCAA)的摩尔数比芳香族氨基酸(AAA)的摩尔数[8]。大量研究表明,高F值寡肽不仅可以缓解肝性脑病,还具有解醉酒[9]、增强记忆[10]、抗疲劳[11]、抗氧化[12]及防衰老[13]等功效。早在20世纪70年代,Yamashita等[14]制得Phe含量低的肽,从此掀起了国内外对高F值寡肽的研究热潮。
本研究旨在借助超声协同振荡手段破坏蛋白质分子间作用力,使其紧致结构及聚集程度得到有效改善[15-17],解决其在加热温度超过玻璃化转变温度(Tg)会聚成面团的现象[18],易于蛋白酶作用[16,19],为有效利用其天然优势且高效制备高F值玉米寡肽提供有利条件,进而推动高F值寡肽的商品化。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白:武汉远成共创科技有限公司;Alcalase 2.4 L碱性蛋白酶:诺维信(中国)生物技术有限公司;胃蛋白酶、木瓜蛋白酶、中性蛋白酶:生工生物工程(上海)股份有限公司;α-胰凝乳蛋白酶:美国Amresco公司;羧肽酶A:美国Sigma公司;活性炭:宁夏天福盛园建设安装有限公司。
1.2 仪器设备
KX-85-2A数显恒温磁力搅拌器:金坛市科析仪器有限公司;超声振荡仪、真空冷冻干燥机:宁波新芝生物科技股份有限公司;UF101超滤纳滤装置:上海弗立特实业有限公司;NEXUS傅里叶变换红外光谱:美国尼高力仪器公司;差示扫描量热仪(DSC 204F1):德国耐驰仪器制造有限公司;高速低温离心机、SU1510扫描电镜(SEM)、SU8220冷场发射扫描电镜(FESEM):日本日立HITACH集团。
1.3 实验方法
1.3.1 玉米醇溶蛋白的预处理
1)各预处理方式对宏观形态的影响 配制50 g/L的悬浮液,pH调至9.5。分别采用50℃水浴、亚硫酸钠、吐温、聚乙二醇、皂素、丙三醇、十二烷基磺酸钠(SDS)、225 W超声振荡的方式进行90 min预处理,以50 g/L玉米醇溶蛋白悬浮液在高于玻璃化温度却不聚成团为指标,选择最佳预处理方式。
2)超声振荡对热稳定的影响 在张等[20]的测定方法上稍有改良,固态样品的扫描范围为30~200℃;50 g/L悬浮液的扫描范围为20~80℃。Tg的计算参考卞[21]的方法。
3)超声振荡对微观表面形貌的影响 取少量待测固态样品固定在样品台上,喷金镀膜处理,在高真空、5 kV的环境下,采用SEM在1 000、5 000倍下观察其微观表面形貌在超声处理前后的变化。
用体积分数70%乙醇配制2 mg/mL质量浓度的待测样品,取少量滴于硅片上,自然干后固定在样品台上,喷金镀膜处理后采用FESEM放大10 000倍,在高真空、3 kV的条件下观察其微观表面形貌在超声处理前后的变化。
4)超声振荡对结构的影响 参照董等[22]的测定方法。
1.3.2 玉米粗肽的制备
1)蛋白酶的选择 将预处理后的玉米醇溶蛋白悬浮液分别调至各内切酶最适的反应温度、pH条件,均以1×104U/g的酶底比加入各内切酶且反应2 h。利用水解度(DH)、游离态BCAA和AAA含量作衡量参数,选择制备玉米粗肽(肽含量高且氨基酸组成特殊)的最佳蛋白酶。
2)Alcalase 2.4 L碱性蛋白酶水解条件的优化将超声振荡后的悬浮液调至50℃,pH调至8.0,分别以1×104、2×104、3×104、4×104、5×104U/g的酶底比添加Alcalase 2.4L碱性蛋白酶,反应4 h,通过控制DH和蛋白质质量浓度,对该酶的最佳酶底比和反应时间进行优化。
3)酶解液的膜过滤 将酶解液加入超滤纳滤系统,选择操作压力为0.25 MPa,经超滤(5 000)和纳滤(500)收集相对分子质量500~5 000的混合肽,冷冻干燥后进行氨基酸测定和相对分子质量分析。
1.3.3 高F值玉米寡肽的制备将膜过滤得到的冻干粉配制成50 g/L的玉米粗肽溶液,温度维持在40℃,pH调至8.0,按酶底比2.0×104U/g加入α-胰凝乳蛋白酶,水解4 h;然后温度调至37℃,pH调至7.0,按酶底比40 U/g加入羧肽酶A,水解2 h,然后进行10 min的90℃酶失活处理;调pH至2.5,按炭液比为1∶15加入改性活性炭,调转速至160 r/min,25℃处理2 h,然后离心取上清液,经冷冻干燥后进行氨基酸和相对分子质量的测定。
1.3.4 水解度测定采用甲醛滴定法,参照Wang等[23]的测定方法。
1.3.5 蛋白质质量浓度测定采用BCA法微量测定,按照BCA试剂盒的说明书进行标准曲线的制定及待测样品的多肽质量浓度测定。其中,反应温度为37℃,反应时间为30 min,检测波长为562 nm。
1.3.6 多肽分布测定参照齐等[24]的测定方法进行待测样品的多肽相对分子质量分布测定。
1.3.7 氨基酸质量浓度测定游离态氨基酸参照朱等[25]的方法,总氨基酸参照尹等[26]的方法。
1.3.8 产品得率计算为保证工业转化的高质量运行,则对小试阶段的产品得率(Y)进行计算,公式如下:
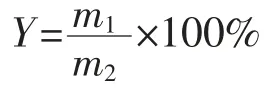
式中,Y为产品得率(%);m1为高F值玉米寡肽质量(g);m2为玉米醇溶蛋白质量(g)。
1.4 数据处理
实验中所有数据均进行3次平行测定,使用SPSS 18.0软件进行数据分析,以平均值±标准误差表示结果,采用Origin 8.5软件绘图。
2 结果与分析
2.1 玉米醇溶蛋白的预处理
2.1.1 各处理方式对宏观形态的影响Tg是非晶态高聚物的重要特征温度之一,是从玻璃态转变为高弹态的温度,是影响性能的主要因素[27-29]。由DSC图谱可知,50 g/L玉米醇溶蛋白悬浮液的Tg为34.8℃(图1(a));固态玉米醇溶蛋白的Tg为107℃(图1(b)),高于其50 g/L悬浮液的Tg,因为Tg与样品含水量呈负相关[18,30];其Tg在超声振荡前后没有显著变化,而超声振荡后变性峰显著减弱(图1(b)),可能因为超声协同振荡的空化与剪切作用削弱了蛋白质的聚集程度而使其变得分散[31]。

图1 超声振荡前后玉米醇溶蛋白的DSC图谱Fig.1 DSC curves of zein before and after ultrasound oscillation pretreatment
作者发现50 g/L的玉米醇溶蛋白悬浮液在50℃加热时会形成“粘弹性面筋团”(图2(b)),因为其在温度高于Tg时,会失去其固有结构,通过蛋白质的重排形成粘弹性体系[18]。该玉米醇溶蛋白悬浮液分别经亚硫酸钠、吐温、聚乙二醇、皂素、甘油、SDS处理后,再经过50℃加热仍会聚成“粘弹性面筋团”(图2(b));但经超声振荡处理后,不仅解决了其在50℃聚成团的难题(图2(d)),且其冻干粉(图2(c))较原玉米醇溶蛋白(图2(a))显著松散,由颗粒状转变为粉末状。结合DSC图谱进行综合分析,则本研究选择超声振荡作为降低该蛋白质聚集程度的最佳处理方式。

图2 不同预处理对玉米醇溶蛋白宏观形态的影响Fig.2 Effects of different pretreatments on macroscopic morphology of zein
2.1.2 超声振荡对微观表面形貌的影响从SEM和FESEM中观察到:未经超声处理的玉米醇溶蛋白呈“海带”状,连接紧密,韧性强,表面光滑(图3(a)和3(b)),且蛋白质在70%乙醇中聚成球体,球的大小不等,球的顶端附有一层“薄膜”,球与球间连接紧密并盘旋成一团(图3(c)),这些聚集体也许就是其加热成团的结构基础;经超声振荡处理后,其微观表面形貌有显著变化,由整体片状型转变为块状堆积形态,由韧性变得松散,且表面出现了许多微小孔洞,增加了许多小突起(图3(d)和3(e)),且在70%乙醇溶液中分散较好,球直径显著变小,球大小较均一,球表面失去了“薄膜”而变得光滑,且球与球间失去了紧密的盘旋而呈线状(图3(f))。蛋白质松散度的提高为高效水解提供有利条件。超声振荡通过机械和空化作用、断裂作用于蛋白质分子间的范德华力和氢键,破坏蛋白质分子之间的交联[15,17],这可能是玉米醇溶蛋白质的微观表面形貌经超声震荡后显著变化的根本原因,与DSC分析结果一致。

图3 超声振荡前后玉米醇溶蛋白的SEM图(a,b,d,e)和FESEM图(c,f)Fig.3 SEM(a,b,d,e)and FESEM(c,f)images of zein before and after ultrasound oscillation pretreatment
2.1.3 超声振荡对结构的影响如图4(a)所示,超声处理前后的玉米醇溶蛋白在4 000~400 cm-1的FTIR中均出现特征吸收带,但强度存在差异。其中,蛋白质的粘弹性和二级结构通常基于波数1 700~1 600 cm-1的FTIR分析(酰胺Ι带)[32],其特征振动主要是C=O起作用,且1 610~1 640 cm-1是β-折叠区域,1 640~1 650 cm-1是无规卷曲区域,1 650~1 658 cm-1是α-螺旋区域,1 660~1 700 cm-1是β-转角区域[33]。如图4(b)所示,超声振荡前后的玉米醇溶蛋白在酰胺Ι带的吸收波形一致,但吸收强度在经超声振荡后明显减弱,这说明其二级结构经超声振荡后有很大程度的改变,但未被完全破坏。

图4 超声振荡前后玉米醇溶蛋白的FTIR谱图Fig.4 FTIR spectra of zein before and after ultrasound oscillation pretreatment
2.2 玉米粗肽的制备
2.2.1 蛋白酶的选择选择作用于AAA的蛋白酶、采用内外切酶协同水解是获得高F值寡肽的关键。选用5种在AAA处有酶切位点的内切酶进行初步水解(表1),在打开紧致结构的同时避免产生过多的游离氨基酸[34]。如图5(a)所示,DH从大到小依次为:D、A、E、C、B。游离态氨基酸含量由多到少依次为:D、A、E、C、B(图5(b)),与DH排序一致,D水解物的游离态氨基酸为1.86 mg/mL,其中,BCAA为0.87 mg/mL,AAA为0.37 mg/mL,均高于A水解物(1.03、0.34、0.26 mg/mL),但游离态AAA/BCAA为0.42,低于A水解物(0.76),可能因为木瓜蛋白酶也具备外切酶的作用[35]。结合玉米醇溶蛋白的特性及各内切酶的作用特点,该步选用Alcalase 2.4L碱性蛋白酶进行初步水解。

表1 不同内切酶的作用位点Table 1 Action sites of different endoproteases

图5 不同内切酶水解玉米醇溶蛋白的DH及游离态氨基酸质量浓度Fig.5 Degree of hydrolysis and free amino acids content of zein hydrolysed by different endoproteases
2.2.2 Alcalase 2.4L碱性蛋白酶酶解条件的优化在DH和蛋白质质量浓度双指标的控制下,优化水解时间和酶添加量,以达到高水解度且肽含量高的目标。如图6(a)所示,在其蛋白质质量浓度(50 g/L)恒定的条件下,随着酶添加量的增大,活性基团增加,反应增速,DH增大,但蛋白质中可被酶作用的位点随反应的进行而减少,当反应4 h时,水解过程基本达到饱和状态,且以酶底比4×104U/g水解4 h的水解度(18.6%)与以酶底比5×104U/g水解4 h的水解度(19.66%)相近,而反应超过3 h后,蛋白质质量浓度迅速降低(图6(b))。因此,选用4×104U/g的酶底比对该松散蛋白质进行3 h的水解反应,以保证得到肽含量较高的玉米粗肽。

图6 Alcalase 2.4L碱性蛋白酶水解玉米醇溶蛋白的蛋白质水解度和蛋白质质量浓度Fig.6 Degree of hydrolysis and protein concentration of zein hydrolyzed by alkaline protease(Alcalase 2.4L)
2.2.3 Alcalase 2.4L碱性蛋白酶酶解液的超滤纳滤将得到的酶解液经超滤膜(5 000)和纳滤膜(500)过滤,得到的粗肽中相对分子质量小于1 000的约占97.62%(图7(a)和图7(b))。其中,相对分子质量500~1 000的肽占10.33%,180~500的肽占57.56%,小于180的物质占29.73%(主要是二肽和游离氨基酸),见图7(b)。同时对此粗肽进行氨基酸组成分析,见表2。总氨基酸质量分数为80.047 3%,游离态氨基酸8.924 9%且占比11.15%,结合图7(b)分析,18.58%的小于180的物质可能是二肽;另外,此肽混合物中BCAA质量分数为20.818 7%,AAA总量为7.852 2%,F值为4.07,见表2。可用于高F值玉米寡肽的制备,此F值高于何等[36]水解大豆与玉米复配蛋白质制得的水解液的F值。另外,此粗肽混合物为短肽,便于α-胰凝乳蛋白酶协同羧肽酶A进一步的定向且高效酶解[37]。

图7 粗肽的相对分子质量分布和比例Fig.7 Molecular weight distribution and content of crude peptides
2.3 高F值玉米寡肽的制备

表2 粗肽的氨基酸质量分数Table 2 Amino acid content of crude peptides %
按1.3.3所述方法制得高F值玉米寡肽混合物;以1.3.8所述公式算出此高F值玉米寡肽的得率为34.66%,高于林[38]制备高F值寡肽的得率,同时为后期工业化生产提供理论依据;以1.3.7所述方法进行氨基酸质量分数测定,见表3。此混合物中富含BCAA、AAA,被活性炭大量吸附,由7.852 2%降至0.42%,仅占氨基酸总量的0.73%,且F值由玉米粗肽的4.07提高到41.87,提高了10.29倍,高于使用这两种酶水解大米[39]、蚂蟥[40]、酪蛋白[41]制备高F值寡肽的F值。这一结果表明:此粗肽是制备高F值寡肽的优质肽源,此双酶协同酶解能定向且高效释放AAA,且AAA能被改性后的粉末活性炭高效除去。同时,以1.3.6所述方法进行多肽相对分子质量分布分析,见图8。由图8(a)可知,此混合物的相对分子质量主要集中于1 000以下,约占97.68%,其中180~1 000的肽占比71.37%(图8(b)),此相对分子质量范围的肽符合高F值寡肽的相对分子质量要求,且易被人体吸收利用。

表3 高F值玉米寡肽的氨基酸质量分数Table 3 Amino acid content of corn oligopeptides with a high Fischer"s ratio


图8 高F值玉米寡肽的相对分子质量分布和百分比Fig.8 Molecular weight distribution and content of crude oligopeptides with a high Fischers ratio
3 结语
超声振荡使玉米醇溶蛋白的微观表面形貌由片型韧状转变为块型松散状,蛋白球状体的聚集程度减弱且球直径变小,二级结构有一定程度的破坏等一系列的变化。结果说明超声振荡技术是通过改善玉米醇溶蛋白的结构特性而解决其加热温度高于Tg会形成“粘弹性面筋团”的现象。该蛋白质在结构松散状态下易被Alcalase 2.4L碱性蛋白酶作用,提高了酶解效率,并通过超滤纳滤膜分离、定向水解、活性炭脱芳香族氨基酸制得F值高达41.87,Phe和Tyr质量分数仅占氨基酸总量的0.73%,相对分子质量180~1 000占比71.37%的玉米寡肽。进一步研究的重点是通过动物实验和临床试验研究该高F值玉米寡肽是否有纠正低蛋白血症和预防早期肝损伤的功效,为来源于天然原料且具备特殊功效的高F值玉米寡肽的真正运用奠定基础。

