沙门氏菌噬菌体ΦSHDA-1生物学特性及基因组学初步研究
温 慧,刘 婷,陈忠军,满都拉,孙子羽
(内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特010018)
沙门氏菌(Salmonella)是世界上最常见的食源性致病菌之一[1],在美国每年约有150万例沙门氏菌感染,每10万人中就有17.6人发病,是死亡率最高(39%)的食源性病原体[2]。2015年欧洲报告了94 625例沙门氏菌病,占欧洲所有报告的食源性疾病的28%,与2014年相比增加了1.9%[3]。沙门氏菌经常导致人类胃肠不适,如恶心、呕吐和腹泻(症状统称为沙门氏菌病),如不及时治疗,可能会引起危及生命的肾和肝并发症,最终导致死亡[4]。沙门氏菌的污染可以发生在从农场到消费者的任何地方,例如生产、收获、加工、储存、运输、零售等[5]。已经从世界各地的不同动物源性食品中分离出耐药性沙门氏菌,这主要归因于抗菌剂的不当使用,而耐药性沙门氏菌会导致食源性传染病发病率的提高[6],因此必须开发替代方法来控制这些病原体。
噬菌体(bacteriophage,phage)是感染细菌、真菌等微生物的病毒,广泛存在于环境和各种食物中。噬菌体具有特异性强、易于分离、研发成本低、对人体无害等特点,并且可以消除与化学抗生素相关的副作用[7-9],所有这些特征使得噬菌体有希望成为食品中细菌病原体的新型生物控制剂。
作者从环境污水中分离获得1株沙门氏菌裂解性噬菌体ΦSHDA-1,对其生物学特性和基因组进行了初步研究,以期为噬菌体控制食品中沙门氏菌污染奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和样品沙门氏菌:鼠伤寒沙门氏菌标准株(CMCC50115);噬菌体ΦSHDA-1:分离自呼和浩特市某下水道污水。
1.1.2 仪器与设备恒温振荡培养箱THZ-98C:上海一恒科学仪器有限公司;立式压力蒸汽灭菌器YXQ-LS-100SII:上海博讯实业有限公司医疗设备厂;双人单面垂直净化工作台SW-CJ-2FD:苏州安泰空气技术有限公司;酶标仪SYNERGY H1:美国伯腾仪器有限公司;高速冷冻离心机SIGMA 3-18KS:赛维斯科技(北京)有限公司;小型台式高速冷冻离心机5424R:德国艾本德股份公司。
1.2 噬菌体的分离和纯化
1.2.1 宿主菌株的复苏与培养挑取鼠伤寒沙门氏菌CMCC50115单菌落接种于5 mL LB液体培养基中,120 r/min、37℃摇床中培养6 h至对数生长早期,备用。
1.2.2 噬菌体的分离纯化参照Jamalludeen N等[10]的方法进行改进,采用双层平板法分离噬菌体。取来自内蒙古呼和浩特市某下水道的污水,使用8层纱布粗滤,离心取上清液10 mL加入到30 mL 2×LB液体培养基中,并加入1 mL处于对数早期的沙门氏菌培养过夜。培养液经8 000 r/min、4℃离心10 min,上清液经0.22μm微孔滤膜过滤后即得到噬菌体原液。采用双层平板法纯化噬菌体,用SM缓冲液对噬菌体原液适当稀释,取适宜稀释度各100 μL与100μL对数早期宿主菌悬液混合,加入5 mL半固体LB培养基,充分混匀后倒于预先制备好的LB营养琼脂固体平板上,待其凝固后于37℃培养过夜。观察平板上噬菌斑情况,挑取直径大、生长均匀的单斑于SM缓冲液中,振荡3 h后用0.22μm滤膜过滤,滤液适当稀释后按以上操作进行纯化,重复5次后即得到纯化的噬菌体。
1.3 噬菌体的生物学特性
1.3.1 噬菌体形态观察采用磷钨酸负染色法,取20μL高效价(>109PFU/mL)噬菌体液滴在铜网上,自然沉淀10~15 min,用滤纸从侧面吸去多余的噬菌体液。再将铜网置于磷钨酸染料中染色10 min,吸去多余液体,自然干燥后在透射电镜(transmission electron microscopy,TEM)下观察噬菌体形态,此试验由中国科学院微生物研究院进行。
1.3.2 噬菌体最佳感染复数感染复数(Multiplicity of Infection,MOI)是指初始感染时噬菌体的数量与宿主菌数量的比值。按一定的MOI值(0.000 001、0.000 01、0.000 1、0.001、0.01、0.1、1、10、100)将噬菌体与宿主菌混合,37℃培养4 h,10 000 r/min离心10 min,用双层平板法测定不同MOI值样品中上清液的噬菌体效价[11]。试验重复3次,每次设2个平行。
1.3.3 噬菌体一步生长曲线将噬菌体与宿主菌按最佳MOI值混合,37℃温育15 min左右,使噬菌体吸附于细菌上,于4℃、10 000 r/min离心10 min,弃上清液,用等体积LB重悬,重复2次,以除去未吸附的噬菌体。加入15 mL LB液体培养基悬浮沉淀并充分混匀,迅速置于37℃培养箱于120 r/min振荡培养。前45分钟每隔5分钟取样,45~115 min每隔10分钟取样,8 000 r/min离心2 min,采用双层平板法测定上清液中噬菌体的效价[12]。试验重复3次,每次设2个平行。
1.3.4 噬菌体热稳定性取已知效价的噬菌体悬液(108PFU/mL)分装于1.5 mL无菌EP管中,将EP管分别放置在30、40、50、60、70、80℃的恒温水浴锅中,1 h后测定各管中噬菌体的效价[13]。试验重复3次,每次设2个平行。
1.3.5 噬菌体pH稳定性取已知效价的噬菌体悬液(108PFU/mL)100μL加入到900μL不同pH值(1~12)的SM缓冲液中,将其置于37℃恒温水浴锅1 h,测定各EP管中噬菌体的效价[14]。试验重复3次,每次设2个平行。
1.3.6 噬菌体的紫外稳定性取已知效价的噬菌体悬液(108PFU/mL,4 mL)均匀平铺于直径90 mm的无菌培养皿中,放到灭菌后的超净工作台上,使培养皿距离紫外灯(功率为14 W)2 cm,打开紫外灯后分别在0、30、60、90、120 s和5、10、30 min时取300μL噬菌体,室温静置至少30 min。取100μL用SM缓冲液适当稀释后,双层平板法测定效价[15]。试验重复3次,每次设2个平行。
1.3.7 噬菌体对宿主菌的裂解曲线噬菌体分别按照MOI=10、1、0.1、0.01、0.001、0.000 1、0.000 01,各取100μL加入到96孔板中,并加入100μL 108CFU/mL的沙门氏菌菌液。另设空白组(Blank)加入200μL LB培养基;对照组(Control)加入100μL 108CFU/mL的沙门氏菌菌液和100μL LB培养基[16]。每隔1小时测定600 nm处的吸光值,共测定12 h。
1.4 噬菌体基因组学初步研究
1.4.1 全基因组测序噬菌体基因组DNA由上海生工生物工程技术服务有限公司测序,构建文库类型为PE文库。利用Illumina公司Hiseq平台进行2×150 bp测序。获得的原始测序数据,经过预处理去除接头、引物及低质量数据后,优化参数Kmer值,通过FastQC进行质量评估、通过Trimmomatic对Illumina测序数据进行质量剪切,得到相对准确的有效数据。使用SPAdes拼接二代测序数据,采用GapFiller对拼接得到的重叠群补GAP。使用Prokka预测基因元件:基因、tRNA、rRNA等,采用Repeat Masker鉴定基因组上的重复序列。利用PrInSeS-G进行序列矫正,修正拼接过程中的剪辑错误及小片段的插入缺失。获得噬菌体ΦSHDA-1最好的DNA序列拼接结果。利用TMHMM进行跨膜蛋白预测分析,SignalP进行信号肽预测分析,LipoP进行脂蛋白预测分析。同时,采用CG View(http://stothard.afns.ualberta.ca/cgview_server/index.html)方法绘制出噬菌体的基因组图谱。
1.4.2 噬菌体ΦSHDA-1裂解酶的蛋白质结构预测分析使用ProtParam在线软件对裂解酶蛋白进行理化性质分析,同时使用PredictProtein(https://www.proforprotein.org/home)预测裂解酶蛋白质的二级结构。
2 结果与分析
2.1 噬菌体的分离纯化
本研究是以鼠伤寒沙门氏菌为宿主菌从下水道污水中分离得到一株噬菌体,命名为ΦSHDA-1。通过双层平板法经过5次纯化后,噬菌体ΦSHDA-1所形成的噬菌斑形态和大小保持均匀一致,呈圆形透明状态,直径约为3 mm,见图1。

图1 噬菌体ΦSHDA-1的噬菌斑形态Fig.1 Bacteriophage plaques ofΦSHDA-1
2.2 噬菌体生物学特性
2.2.1 噬菌体形态观察噬菌体ΦSHDA-1高浓度裂解液经过TEM观察得到的噬菌体形态见图2。该噬菌体具有直径为(53±8)nm的二十面体头部,长(112±12)nm的非收缩性尾部,符合长尾噬菌体科(Siphoviridae)特征,因此鉴定噬菌体ΦSHDA-1为长尾噬菌体。

图2 噬菌体ΦSHDA-1的电镜观察图Fig.2 TEM micrograph ofΦSHDA-1
2.2.2 噬菌体最佳感染复数由表1可知,噬菌体ΦSHDA-1在MOI=0.000 01时,噬菌体效价最高为6.0×1010PFU/mL,因此噬菌体ΦSHDA-1的最佳MOI为0.000 01

表1 噬菌体ΦSHDA-1的最佳感染复数的测定Table 1 Determination of optimal multiplicity of infection(MOI)
2.2.3 噬菌体一步生长曲线由图3可知,噬菌体ΦSHDA-1在前25分钟曲线趋势保持平稳,即判断噬菌体ΦSHDA-1的潜伏期为25 min,之后噬菌体的效价急剧增加,在55 min之后逐渐保持平稳,即判断噬菌体爆发期为30 min。
噬菌体ΦSHDA-1的裂解量为36.52 PFU/cell。
2.2.4 噬菌体热稳定性由图4可知,噬菌体在30~60℃以内活性保持稳定,在70℃时噬菌体ΦSHDA-1活性大约降低4个对数值,在高温80℃时基本失活。由此可知,噬菌体ΦSHDA-1对温度有较强耐受性,适合在60℃及以下环境中生存。

图4 噬菌体的热稳定性Fig.4 Heat sensitivity of phageΦSHDA-1
2.2.5 噬菌体pH稳定性由图5可知,噬菌体ΦSHDA-1在pH值2~10范围内活性保持稳定,说明该噬菌体对酸碱的耐受力较强;而pH低于2或者大于10时噬菌体基本失活。由此可知,噬菌体ΦSHDA-1的最适pH范围为2~10。

图5 噬菌体的pH稳定性Fig.5 pH sensitivity of phageΦSHDA-1
2.2.6 噬菌体的紫外稳定性由图6可知,噬菌体ΦSHDA-1在紫外线下照射60 s时效价降低约4个对数值,在紫外线照射120 s后完全失活,说明该噬菌体对紫外线的耐受力较弱。
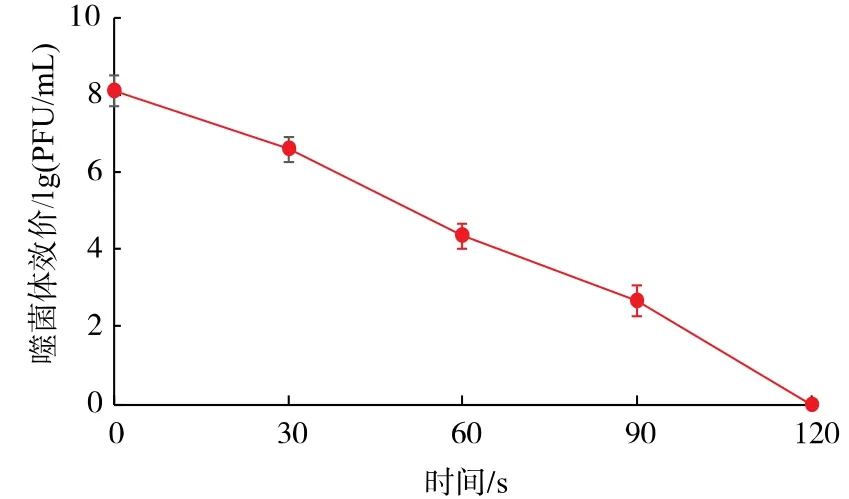
图6 噬菌体的紫外稳定性Fig.6 UV sensitivity of phageΦSHDA-1
由图7可知,与未加噬菌体ΦSHDA-1的阳性对照相比,噬菌体ΦSHDA-1在12 h内不同MOI值下都可以抑制鼠伤寒沙门氏菌的生长,并且阳性对照组曲线与沙门菌正常的生长曲线相符。实验结果表明,噬菌体ΦSHDA-1对宿主菌有较强裂解作用。

图7 噬菌体ΦSHDA-1在不同MOI值下裂解宿主菌的曲线Fig.7 Curves of lysed host strain by the phageΦSHDA-1 in different MOI
2.3 噬菌体基因组学初步研究
2.3.1 ΦSHDA-1基因组序列分析序列组装完成后共得到6个重叠群,长度分别为:22 458、7 543、7 224、1 430、1 086、782 bp,共40 523 bp,见表2。G+C含量为51%,编码59个CDS,其中未发现tRNA和rRNA。将噬菌体ΦSHDA-1的序列在NCBI中对比,其与噬菌体Salmonella phage vB_SenS_SE1(登录号为MK479295.1)相似度最高,覆盖率为97%,以Salmonella phage vB_SenS_SE1噬菌体基因组序列为参考,对噬菌体ΦSHDA-1的6个重叠群进行排序,并使用CGview server对其绘制基因组圈图,见图8。为了进一步了解ΦSHDA-1与其他噬菌体的进化关系,选取具有进化意义且保守的噬菌体DNA聚合酶氨基酸序列构建系统进化树[17]。通过blastp比对,找到同源性高的噬菌体,在此基础之上,利用进化树软件MEGA-X进行进化分析,采用最大似然法(Maximum likelihood,ML)构建的进化树,见图9。由图9可知,ΦSHDA-1与Salmonella phage vB_SenS_SE1(登录号为MK479295.1)亲缘关系相对较近。通过blastp比对结果可知,噬菌体基因编码的保守序列具有已知的相关功能,其中包括裂解酶、终止酶、尾部相关蛋白质等,但未发现穿孔素。通过对开放阅读框与CARD以及VFDB进行分析,未发现携带耐药基因和毒力基因。

表2 噬菌体ΦSHDA-1基因组框架图信息Table 2 Genome framework map ofΦSHDA-1

图8 ΦSHDA-1基因组圈图Fig.8 Genome map ofΦSHDA-1
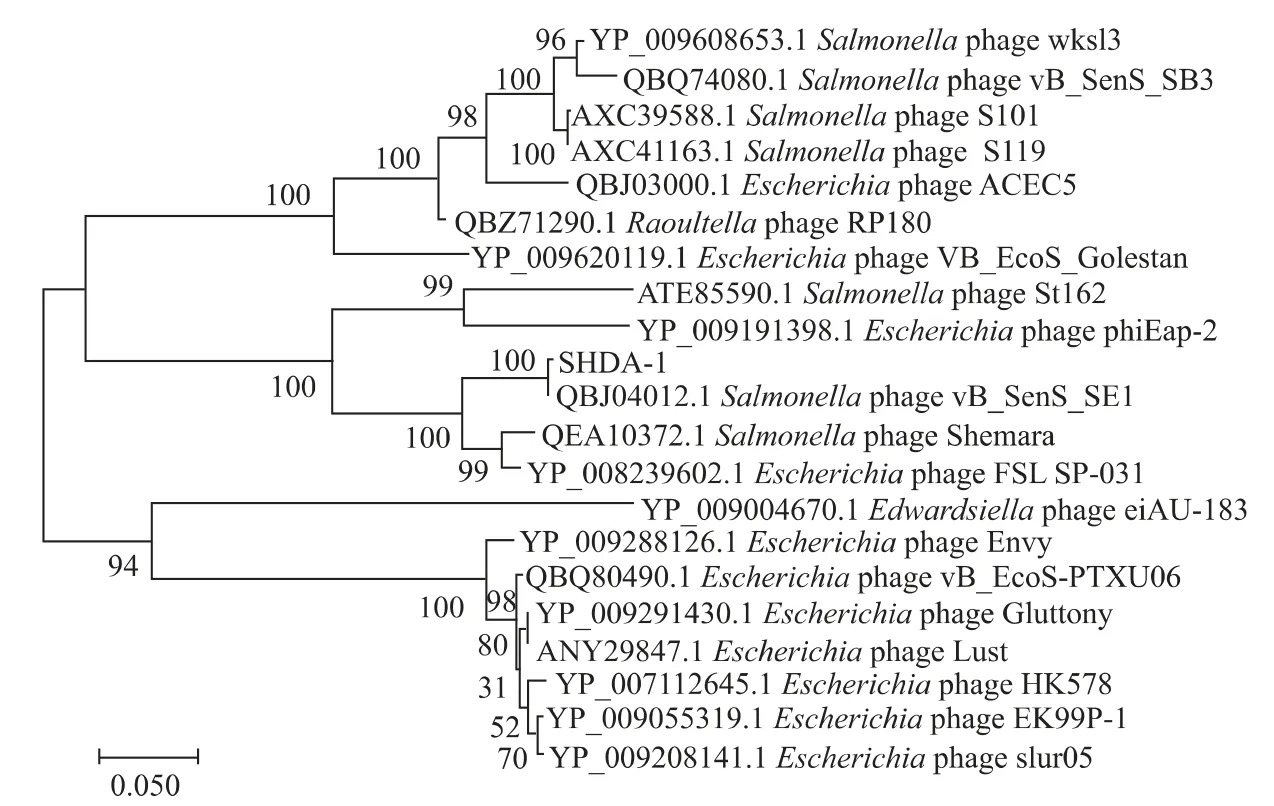
图9 ΦSHDA-1 DNA聚合酶系统进化树Fig.9 Phylogenetic tree formed by DNA polymerase protein ofΦSHDA-1
2.3.2 噬菌体ΦSHDA-1裂解酶的蛋白质结构预测分析将获得的59个编码基因的氨基酸序列采用blast程序逐个进行检索分析,发现一个裂解酶(LysSHDA-1)的编码区。使用ProtParam在线软件对LysSHDA-1蛋白进行理化性质分析,同时使用PredictProtein预测其二级结构。结果表明:该蛋白质由160个氨基酸组成,相对分子质量为17 300,等电点为9.99,其亲水性平均系数为-0.271,因此属于亲水性蛋白质,不稳定指数为23.52,因此属于稳定蛋白质。其二级结构中,α-螺旋、β-折叠、无规则卷曲分别占氨基酸总数的54.38%、5.62%、40%,不包含任何核定位信号,为非球状蛋白质。TMHMM和SignalP的结果分析表明,其不含跨膜结构及信号肽。
3 结语
目前用于防治食品中病原菌的手段各有缺陷,且随着抗生素长期大量和不当使用,出现了越来越多的沙门氏菌耐药株,因此迫切需要找到一种相对环保且高效的方法来控制这种病原体。噬菌体不仅能够安全有效抑制病源微生物,而且不会对食品的外观、营养及风味造成影响。目前美国、欧洲、加拿大和澳大利亚等多个国家已将商业噬菌体制剂(例如ListShield,LMP-102,Listex P100,EcoShield和SalmoFresh)应用于食品工业中[18]。因此噬菌体成为一种有吸引力的替代品,用于控制食品和食品加工及储存环境中污染的沙门氏菌。
本研究以鼠伤寒沙门氏菌为宿主菌,从环境污水中分离到一株裂解性噬菌体,命名为ΦSHDA-1,其噬菌斑边缘清晰透亮,具有典型裂解性噬菌体的特性。噬菌体ΦSHDA-1的头部呈多面体立体对称,头部直径约为(53±8)nm,尾长约(112±12)nm。根据噬菌体分类方法,本研究分离的沙门噬菌体ΦSHDA-1属于有尾病毒目、长尾噬菌体(Siphoviridae)科。通过温度和pH耐受实验发现,ΦSHDA-1具有良好的酸碱稳定性及较强的温度适应能力,且ΦSHDA-1对沙门氏菌的裂解曲线表明,其具有较好的抑菌能力,这些特征为噬菌体制剂的制备、保存及应用提供了可靠保证。
开展噬菌体基因组学研究,不仅能够提高我们对于噬菌体基因序列丰富多样性程度的认识,为进一步了解噬菌体提供可靠的信息,还可以为噬菌体应用或是开发新型的抗菌剂奠定科学基础。噬菌体及其裂解酶作为抗生素替代品近年来备受关注,对耐药菌的防治具有潜在的应用价值。噬菌体裂解酶是多数噬菌体在侵染后期编码的一类肽聚糖水解酶,其主要功能是降解细菌细胞壁的肽聚糖成分,从而促使细菌裂解并释放出子代噬菌体[19]。噬菌体裂解酶具有与细菌共同进化的选择优势和高效的裂解活性,其作用不受细菌耐药性的影响,不易诱导细菌产生新的抗性,而且易于人工设计和基因工程改造,因此成为噬菌体抗菌研究的关键基因[20]。国内外已有很多文献报道指出,裂解酶能够被用来防控和检测食品中的食源性致病菌[21-25]。裂解酶与其他的抑菌剂相比,它的宿主特异性较强,能选择性地杀死致病菌而不会引起食品中其他天然有益菌群的改变,因此成为一种全新的抗菌剂[26]。通过blastp对比可知,ΦSHDA-1基因组含有一裂解酶基因。LysSHDA-1蛋白质不存在跨膜结构域,同时其缺乏信号肽序列,不属于分泌蛋白质。上述结果表明,LysSHDA-1与大部分噬菌体的裂解酶一样,不能够直接穿透宿主菌的细胞膜,必须借助噬菌体编码的穿孔素蛋白的辅助作用才能够穿过宿主细胞膜,从而发挥其裂菌作用[27]。
在噬菌体投入到实际应用之前必须全面深入了解其基因组信息,有研究表明,噬菌体含有编码某些毒力因子合成的基因,在进入宿主菌细胞之后便合成毒力因子,对人体造成危害,噬菌体还可能是耐药菌之间耐药基因水平传播的介质[28]。通过对本试验筛选的噬菌体的开放阅读框与CARD以及VFDB进行分析,噬菌体ΦSHDA-1未发现携带耐药基因和毒力基因,保证了其作为抗菌剂用于防治食品中沙门氏菌污染的安全性。总之,噬菌体ΦSHDA-1的生物学特性及基因组学分析表明,其有作为抑菌剂用于防控食品中沙门氏菌污染的潜力。

