荧光定量PCR方法检测肉制品中鳄鱼源性成分
吴颖峰,董合磊,刘 佳,刘 梅,肖红梅
(南京农业大学 食品与科技学院,江苏 南京210095)
鳄鱼属于动物界脊索动物门脊椎动物亚门爬行纲鳄形总目鳄科,是现存最古老的动物之一[1]。近些年来,在国家政策的大力支持以及鳄鱼人工养殖技术的飞速发展下,鳄鱼肉逐渐从一种稀有食材变成广大消费者都能接触到的新兴食材[2]。据悉,国内鳄鱼养殖产业发展快速,总养殖量逐年递增,但目前养殖地区仍主要集中在我国南方地区[3]。鳄鱼肉中含有丰富的维生素和矿物元素,口感好,是优秀的肉类食材[4]。根据已有研究表明,鳄鱼肉中粗蛋白质质量分数约为18%,且必需氨基酸与总氨基酸比例高于41%,总必需氨基酸与总非必需氨基酸比例接近73%,在营养学中属于FAO/WHO最理想的模式[5]。此外鳄鱼肉还具有诸多保健功能,将鳄鱼肉冻干磨碎后对人体有抗脂质氧化作用,并可改善缺氧引起的症状[6],鳄鱼肉也具有清除自由基的能力,能够抵抗人体的衰老[7-8]。鳄鱼肉中脂肪酸种类约有30种,其中多不饱和脂肪酸比例在30%左右,并且富含DHA和EPA,鳄鱼肉在脂肪酸含量和组成方面与深海鱼接近,具有极高的营养保健价值[9]。但是鳄鱼肉作为一种新兴的高价值肉类,在市场监管等方面存在许多不足。
食品掺假和伪造是指人为向食品中掺入外观难以辨认、最终想达到以次充好的行为[10-11]。在传统的肉制品行业中很多商贩以次充好,将廉价劣质肉类添加到高价优质肉中进行售卖,这种行为不但损害了消费者利益,还扰乱了市场秩序。鳄鱼肉作为一种高蛋白质、低脂肪的良好肉质,拥有非常良好的市场。随着鳄鱼肉市场的扩大,建立一个完善高效的食品溯源及防伪机制来应对鳄鱼肉掺假行为问题是非常重要的。而建立鳄鱼肉溯源防伪机制的关键在于加工肉制品中鳄鱼源性的检测。目前物种的鉴定主要基于蛋白质和DNA的分析[12]。而其中又以DNA分析为主,因为DNA比蛋白质耐热性更强,更易于在加热后的食品中鉴定[13]。常规的DNA分析方法有:常规PCR-凝胶电泳、多重PCR-凝胶电泳法、荧光定量PCR等[14]。作者将用实时SYBR Green荧光PCR技术来建立检测方法。因为它作为一种利用荧光分子提供的荧光强度与PCR产物的丰度之间的相关性来实现实时数据采集,相比于在末期进行分析的凝胶琼脂或聚丙烯酰胺电泳技术和Taq Man探针实时PCR,SYBR Green实时PCR的实验设计更加简单快捷且不需要探针、成本低[15-19]。在复杂的混合而成的产品中,即使只有微量的不同物种成分,也能分析出来。
目前国内外关于实时荧光PCR方法来测定食品中鳄鱼肉源性的研究较少。丁健等人[20]利用SYBR Green荧光定量PCR建立了快速鉴定小体鲟物种的方法,检测的灵敏度达0.04 mg/L,可对血液样品和组织样品进行种源鉴别。陈正芳等人[21]通过SYBR GeenⅠReal time PCR对动物源食品中猪源性成分进行测定,最后灵敏度达1×10-6ng/μL。在加工肉制品中检测鳄鱼肉源性的研究较少,尤其是使用实时荧光PCR检测方法,因此作者利用SYBR Green荧光定量PCR对鳄鱼源性成分进行鉴定,通过鳄鱼线粒体色素细胞b基因设计特异性引物,并进行特异性试验、检出限试验、灵敏度检测以及加工制品中鳄鱼肉源性的检测来验证食品中SYBR Green荧光定量PCR在检测鳄鱼肉源性成分的可靠性。
1 材料与方法
1.1 材料与试剂
牛肉、羊肉、猪肉、鸡肉、鸭肉、鱼肉、虾肉、牛肉棒、猪肉脯、鸡肉肠、培根:均在超市购得;鳄鱼肉:购于江苏苏州市奥新鳄鱼开发有限公司;泰兴分公司,鳄鱼肉脯、鳄鱼香肠加工:作者所在实验室制得,使用前均储存在-20℃冰箱。
EDTA、Tris-HCl、Na2EDTA、蛋白酶k(20 mg/mL):均购自上海生工公司;CTAB:购自Aladdin公司;氯仿、异丙醇、乙醇:均购自国药-沪试;实时荧光PCR混合液(TB Green®Premix Ex TaqTMII):大连宝生物工程有限公司。
1.2 仪器与设备
台式高速冷冻离心机:德国Eppendorf公司;QuantStudioTM6 Flex实时荧光定量PCR仪:美国ABI公司;Nnanodrop-2000微量核酸蛋白质分析仪:美国热电公司;恒温水浴锅:南京科尔仪器设备有限公司。
1.3 方法
1.3.1 引物的设计与合成根据GenBank中已发表的鳄鱼(NC008143.1)基因组序列,并用Primer5.0软件设计特异性引物,再将引物序列在美国国立生物技术信息中心(NCBI)数据库中进行BLAST分析比较和评估,保证鳄鱼引物的特异性。扩增所用引物由上海生工公司合成,引物序列见表1。

表1 引物序列汇总表Table 1 Primers list
1.3.2 DNA的提取称取100 mg样品,加入10 μL蛋白酶K(20 mg/mL)、1.5 mL CTAB提取缓冲液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.02 mol/L Na2EDTA,pH 8.0),样品于60℃水浴4 h。溶解产物通过13 000 g离心10 min,转移上清液到新的离心管中。加入750μL氯仿后振荡,13 000 g离心5 min。取上清液后加入2倍体积的CTAB沉淀溶液(5 g/L CTAB,40 mmol/L NaCl),13 000 g离心15 min。弃上清液并加入350μL NaCl溶液(1.2mol/L NaCl)、350μL氯仿,混匀轻摇,13 000g离心10 min。取上清液后加入0.6倍体积的异丙醇,13 000g离心10 min,弃上清液,加入500μL体积分数70%乙醇溶液洗涤沉淀,13 000g离心5 min,弃上清液晾干,溶解于100μL灭菌超纯水中,用微量核酸蛋白质分析仪测定其质量浓度,-20℃保存备用[29]。
1.3.3 特异性试验将鳄鱼、羊、牛、猪、鸡、鸭、鱼、虾样品质量浓度用灭菌超纯水水调整为20 ng/μL DNA溶液,并用上述设计引物进行实时荧光PCR扩增。荧光PCR反应体系为20μL,包含TBGreen TaqⅡ10μL、模板DNA 2μL、上下游引物各0.8 μL、灭菌超纯水6μL、ROX Reference Dye 0.4μL。反应条件根据试剂盒调整为:95℃预变性30 s;95℃变性5 s,64℃退火延伸30 s,40个循环。
1.3.4 检出限试验将鳄鱼DNA梯度稀释,制备成100、10、1、0.1、0.01、0.001、0.000 1 ng/μL 7个质量浓度梯度样品,进行检出限试验。
1.3.5 灵敏度试验用20 ng/μL鸡肉DNA溶液稀释20 ng/μL鳄鱼DNA溶液,最后稀释成鳄鱼DNA含量分别为100%、10%、1%、0.1%、0.01%、0.001%、0%的样品,进行灵敏度试验。
1.3.6 肉加工制品样品鉴定于实验室制得鳄鱼肉脯、鳄鱼肉香肠,市场购置培根、猪肉脯、鸡肉肠、牛肉棒,用1.3.2方法提取DNA,并调整样品DNA质量浓度为20 ng/μL,最后利用所建立的SYBR Green荧光PCR检测方法对肉加工制品进行鉴定。
1.3.7 数据处理利用QuantStudioTMReal-Time PCR Software对结果进行扩增曲线和Ct值的分析,数据均以平均值±标准差表示。
2 结果与分析
2.1 DNA质量分析
通过微量核酸蛋白质分析仪测定样品在260、280 nm的光密度(OD)值,所有样品的OD260/OD280均在1.8~2.2。结果表明,所有样品提取的DNA均适用于PCR检测,见表2。
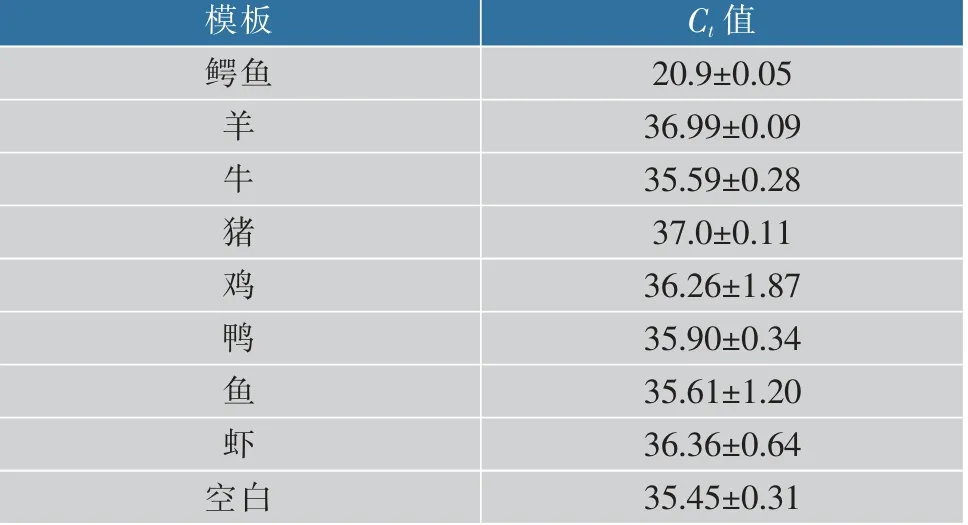
表2 不同肉类DNA模板PCR扩增的Ct值Table 2 Results of PCR amplification of different meat DNA templates
2.2 特异性试验结果
以鳄鱼、羊、牛、猪、鸡、鸭、鱼、虾样本各20 ng/μL DNA作为模板进行PCR,只有鳄鱼样本出现显著扩增,Ct值为20.92±0.05,鸡、羊、牛、猪、鸭、鱼、虾样品的Ct值均大于35,可以认为本方法针对鳄鱼设计的引物特异性良好,见图1。
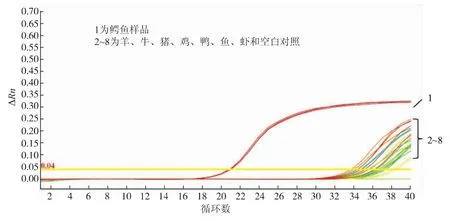
图1 鳄鱼引物特异性实时荧光PCR检测结果Fig.1 Specificity of the crocodile primers
2.3 检出限试验结果
通过鳄鱼引物对100、10、1、0.1、0.01、0.001、0.000 1 ng/μL 7个不同质量浓度梯度的样品DNA进行实时荧光定量PCR扩增,结果见图2,具体数值见表3。由图2和表3可知,100、10、1、0.1、0.01、0.001 ng/μL模板质量浓度样品均出现Ct值小于35的扩增,而当鳄鱼DNA模板质量浓度为0.000 1 ng/μL时,Ct值为35.85±1.25。表明该方法的检出限为0.001 ng/μL鳄鱼DNA质量浓度。通过对鳄鱼肉样品DNA进行一系列的梯度稀释(100、10、1、0.1、0.01、0.001、0.000 1 ng/μL),鳄鱼DNA质量浓度的对数值与其对应的Ct值成线性关系,通过以模板质量浓度的对数值为X轴,Ct值为Y轴,得到线性回归方程见图3。因此本试验方法的标准曲线方程为:y=-2.783x+24.618,R2=0.986 2,通过检测肉制品中的鳄鱼源性的Ct值带入标准曲线中的公式,可以得到所测样品中鳄鱼DNA的质量浓度,且R2=0.986 2,说明本试验设计的鳄鱼引物具有良好的检测能力。
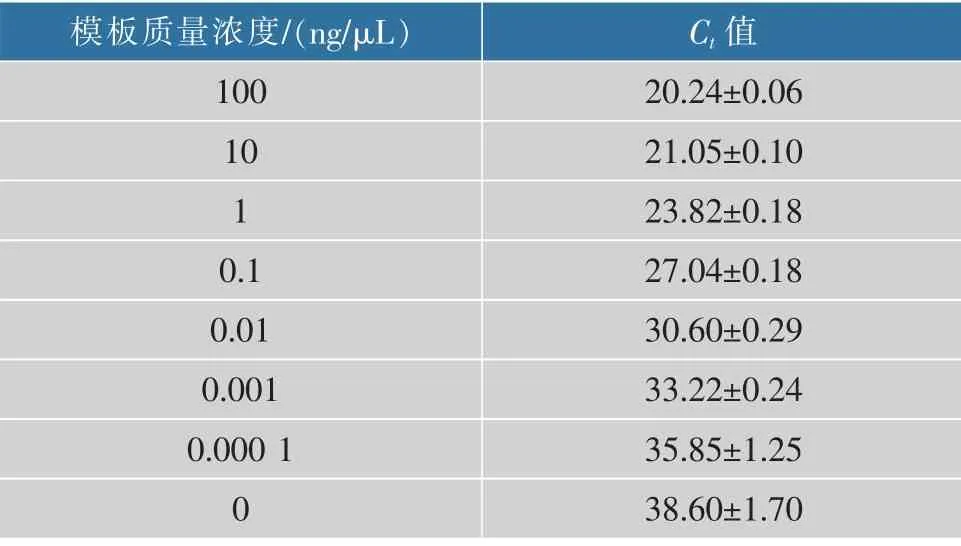
表3 不同鳄鱼DNA模板质量浓度PCR扩增的Ct值Table3 Results of PCR amplification of different crocodile DNA template concentrations
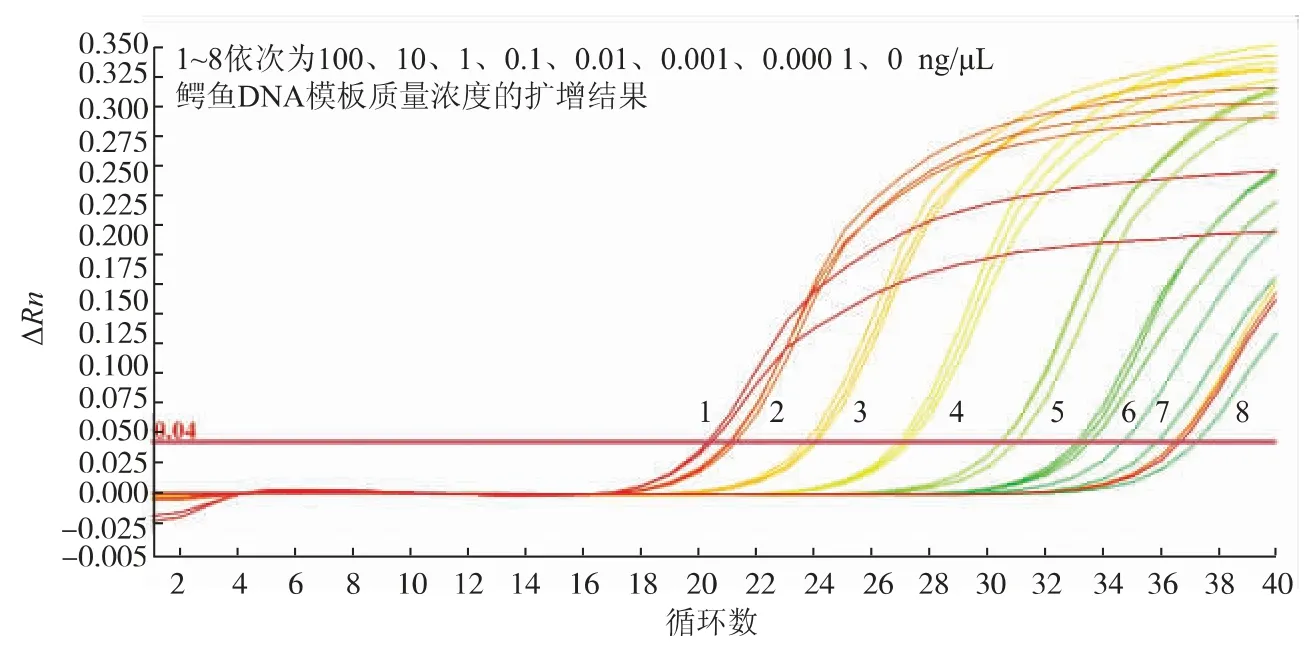
图2 鳄鱼引物检出限实时荧光PCR检测结果Fig.2 Detection limit of crocodile primers real-time PCR results
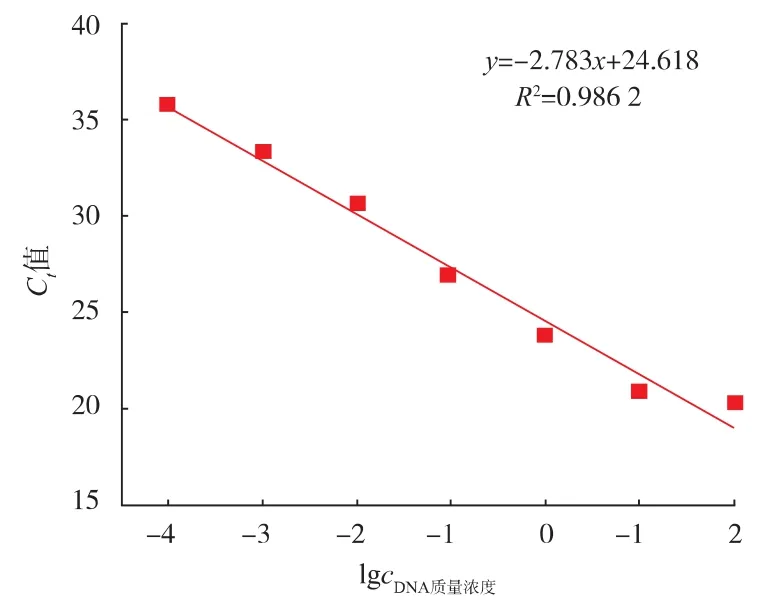
图3 鳄鱼源性成分定量检测标准曲线Fig.3 Standard curve for quantitative detection of crocodile-derived components
2.4 灵敏度试验结果
通过鳄鱼引物对鳄鱼组分DNA和鸡肉组分DNA混合样(鳄鱼组分质量分数分别为100%、10%、1%、0.1%、0.01%、0.001%、0)进行荧光定量PCR扩增试验,结果见图4,具体数值见表4。当鳄鱼组分DNA占混合DNA 0.001%的时,Ct值为35.15±0.13,而鳄鱼组分DNA占比为100%、10%、1%、0.1%、0.01%时,扩增Ct值均小于35。结果表明,该检测方法在混合DNA样品中的灵敏度可达0.01%。
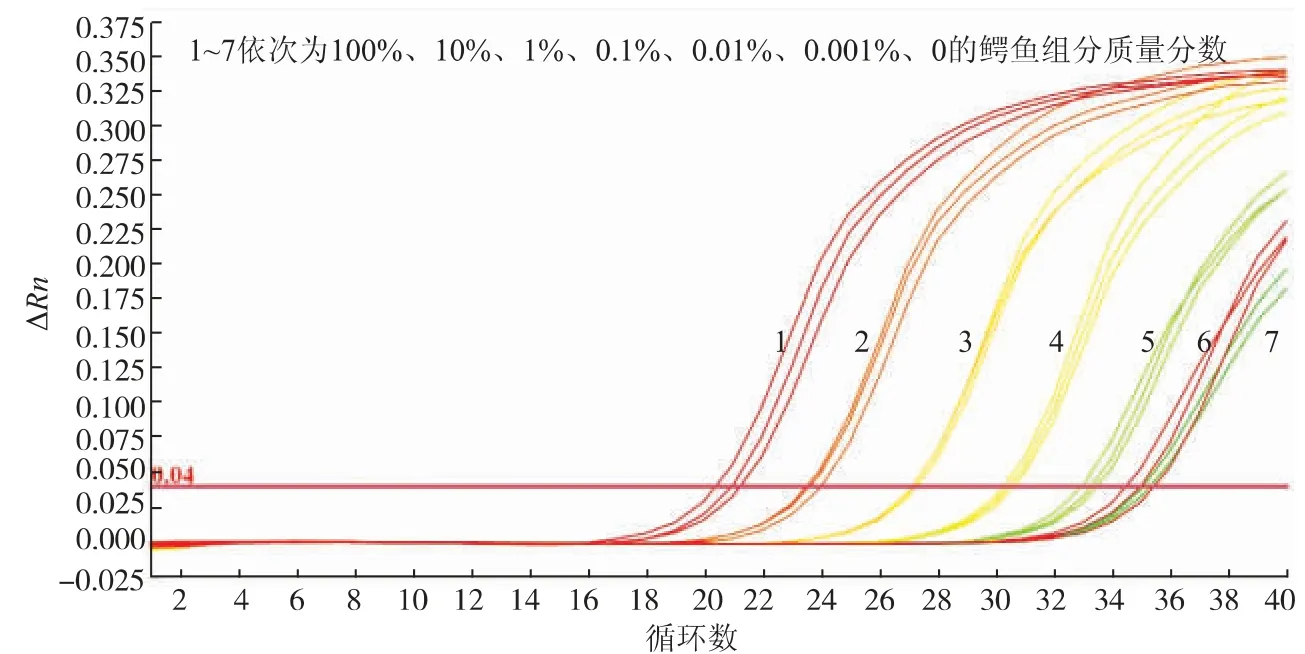
图4 鳄鱼引物灵敏度实时荧光PCR检测结果Fig.4 Detection results of crocodile primer sensitivity real-time PCR
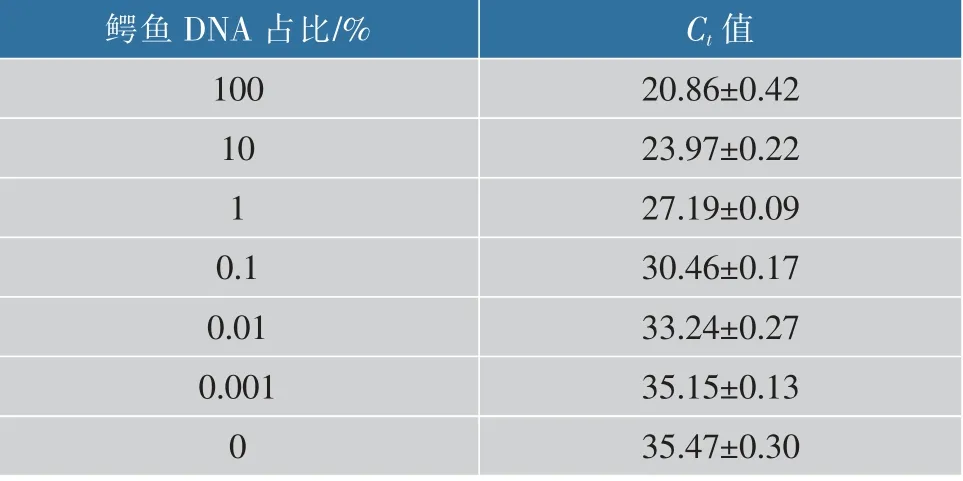
表4 不同鳄鱼组分DNA模板PCR扩增的Ct值Table4 Results of PCR amplification of different crocodile DNA template contents
2.5 加工肉制品中鳄鱼源性检测结果
提取从超市购买的培根、猪肉脯、鸡肉肠、牛肉棒以及实验室制作的鳄鱼肉脯、鳄鱼肉香肠的DNA,对其进行荧光定量PCR扩增试验,结果见表5和图5。可以看出,只有2个鳄鱼肉制品出现特异性扩增曲线,Ct值分别为21.28±0.20、20.58±0.07,其余无鳄鱼源性制品均未检测出其源性,说明此引物具有较高的适用性及特异性,可用于市售加工制品中鳄鱼源性的检测。
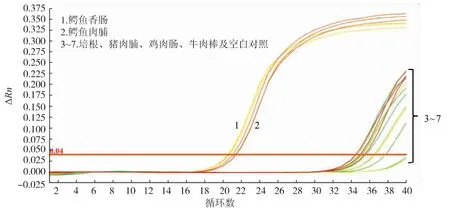
图5 加工肉制品鳄鱼源性实时荧光PCR检测结果Fig.5 Real-time PCR detection results of processed meat products
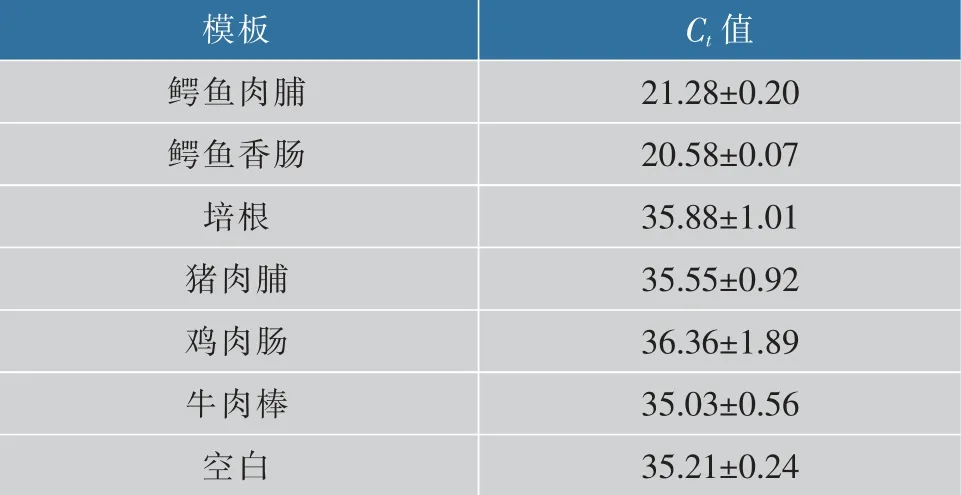
表5 不同加工肉制品DNA模板PCR扩增的Ct值Table 5 Results of PCR amplification of different processed meat products
3 结语
实时荧光PCR技术因其高特异性和高灵敏度的优点被广泛应用于肉类及其加工制品物种源性的鉴定。然而目前利用实时荧光PCR对鳄鱼源性成分进行鉴定的研究报道较少。Naquiah等人通过双基因靶向PCR技术对鳄鱼肉及其加工制品检测,最终纯鳄鱼肉的检出限为0.001 ng,而混合肉样的检出限为0.01 ng[30]。作者选择鳄鱼线粒体细胞中的色素细胞b作为目的基因,因具有含量高、多拷贝基因的特点,所以可以达到较高的特异性及灵敏度,适用于物种源性检测。相较于Nina等人的双基因靶向PCR检测鳄鱼源性,本研究所建立的实时荧光PCR鉴定鳄鱼源性的方法更加方便快捷、成本低且有出色的灵敏度。相比于普通PCR技术,实时荧光PCR技术无需电泳就可以对试验结果进行分析,省去了对阳性样品进行DNA测序等步骤,增加了检测效率。
自从牛羊肉掺假事件的曝光,肉制品的掺假已经成为消费者关注的热点问题。鳄鱼肉作为一种高蛋白质、低脂肪的良好肉质,拥有非常良好的市场。随着鳄鱼肉市场的扩大,建立一个完善高效的食品溯源及防伪机制来应对将会出现的鳄鱼肉掺假行为问题是非常重要的。本研究建立的方法可检测出0.001 ng/μL的鳄鱼肉,灵敏度可达0.01%,且该特异性引物只能扩增出鳄鱼源性成分,对羊、牛、猪、鸡、鸭、鱼、虾样品均无特异性扩增。因此在对冒充鳄鱼肉售卖、加工产品中违规添加鳄鱼肉以及鳄鱼肉制品中掺入低价值肉等现象时该试验方法能够作为监管有效手段筛查,通过该方法可以有效维持鳄鱼肉肉制品市场的秩序,维护消费者的权益。

