EMA结合实时荧光PCR方法检测单核细胞增生李斯特氏菌
吴海江,孙玉萍,范田丽,赵建勇,张煌涛,张晓波,杨珊珊
(1.新疆维吾尔自治区产品质量监督检验研究院/国家农副产品质量监督检验中心,新疆 乌鲁木齐830011;2.新疆医科大学基础医学院,新疆 乌鲁木齐830054)
单核细胞增生李斯特氏菌(Listeria monocytogenes)是一种食源性致病菌,可在冰箱冷藏室生长繁殖[1-2]。人感染后引起脑膜炎、流产、败血症等疾病,致死率达20%~30%,美国每年近300人死亡[3]。我国非常重视L.monocytogenes污染,要求预包装食品检出率为零,因此准确快速检测成为研究热点[4-5]。
目前,L.monocytogenes检测方法有生理生化[6]、酶联免疫方法[7]等,操作繁杂、试剂成本高,确定阳性样品需要5~8 d[8]。实时荧光PCR检测具有高效准确、操作简单、减少交叉污染等优点[9]。利用核酸荧光染料叠氮溴化乙锭(EMA)与死菌DNA共价结合阻断PCR反应[10-11],通过qPCR循环次数(Ct值)增加区分死菌。Casini等[12]监测医院直饮水中军团菌(Legionella)。有研究表明,脱氧胆酸钠溶液(SD)处理受损细胞,增强EMA渗入。Wang等[13]用0.1%SD处理肠出血性大肠埃希氏菌O157,抑制效果增强。
TaqMan荧光水解探针特异性强、高通量[14-15]。hly基因编码李斯特溶血素O(LLO)是L.monocytogenes重要的致病物质,导致细菌在巨噬细胞、上皮细胞中传播[16]。作者设计引物、TaqMan探针检测hly基因,将EMA与qPCR结合鉴别活菌,尝试SD强化抑制效果,人工污染样品测试实用性。本方法操作简单、准确可靠,为食品、环境中检测L.monocytogenes提供了新途径。
1 材料与方法
1.1 菌种
56株标准菌株:购自美国种质保藏中心(ATCC)、英国典型菌种保藏中心(NCTC)、中国工业微生物菌种保藏管理中心(CICC)、中国医学细菌保藏管理中心(CMCC),分离株由国家农副产品质量监督检验中心(新疆)分离保存。
1.2 主要试剂和仪器
EMA:购自美国Sigma公司;细菌DNA提取试剂:购自上海生工公司;qPCR反应试剂Premix Ex Taq(含TaKaRa Ex Taq HS,dNTP Mixture,Mg2+等):购自日本Takara宝生物公司;SD:购自北京雷根生物技术有限公司;微生物培养基:购自北京陆桥有限公司。
Dry Block Heater 2金属干浴器:德国IKA公司;ROTINA 420离心机:德国Hettich公司;VITEK 2 Compact全自动细菌鉴定仪:法国生物梅里埃公司;LED光照装置(等效于卤素灯600 W):日本Takara宝生物公司;CFX96荧光定量PCR仪:美国伯乐Bio-Rad公司。
1.3 实验方法
1.3.1 微生物的培养将L.monocytogenes、沙门氏菌、肠出血性大肠埃希氏菌(O-157:H7)等标准菌株、实验室分离株用脑心浸出液肉汤(BHI)复苏,VITEK 2 Compact确认。将单菌落接种于10 mL缓冲蛋白胨水(Buffered peptone water,BPW)试管中,36℃过夜培养至对数期。
1.3.2 热致死方法取培养至对数期L.monocytogenes的新鲜菌液,调整菌悬液为0.5麦氏浊度(约1.5×108CFU/mL),取1 000μL至1.5 mL离心管中,金属干浴80℃加热10 min,冷却至室温。活菌置于冰盒中避免繁殖扩增。吸取菌液300、300、400μL,涂布于显色培养基,36℃培养48 h观察生长情况,计算菌落数量。
1.3.3 最适EMA质量浓度及DNA提取将EMA溶解制成质量浓度2.5 mg/mL母液,-20℃避光保存。将EMA加入菌液,用涡旋振荡器混匀,每管终质量浓度为0、2.5、5.0、7.5、10.0μg/mL。暗处避光、室温静置15 min,过程中每隔2~3 min用手轻弹混匀。暗反应后,用LED装置光照15 min(或500 W卤素灯,距离20 cm,光照15 min)。细菌DNA通过上海生工试剂提取,4℃保存备用。
1.3.4 qPCR引物探针设计以L.monocytogenes溶血蛋白基因hly(Genbank accession no.M24199)为目的基因,使用Primer Express 3.0软件设计引物、TaqMan探针,美国Thermo Fisher赛默飞世尔科技(中国)有限公司合成。
qPCR反应体系(25μL):12.5μL Premix Ex Taq;10μmol/L上、下游引物、探针各0.5μL;DNA模板2.0μL;用ddH2O补至25μL。反应程序:95℃30 s、95℃5 s、60℃30 s(收集FAM荧光),40个循环。通过Bio-rad伯乐CFX Manager Software软件分析实验数据。
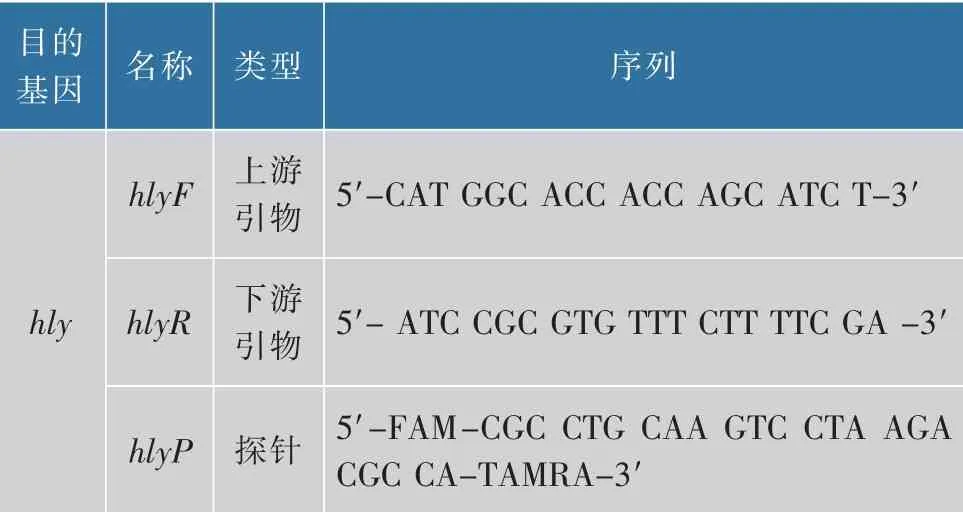
表1 引物探针序列Table 1 Sequences of primers and probe
1.3.5 EMA-qPCR方法检出限将0.5麦氏浊度的L.monocytogenes活菌(约1.5×108CFU/mL)进行10倍梯度稀释,制得浓度为106、105、104、103、102CFU/mL菌液,EMA处理和未处理菌液同时进行qPCR检测,确定方法检出限。
1.3.6 SD增强EMA-qPCR效果将体积分数1%SD分别加入热致死、活L.monocytogenes培养液中,使SD终体积分数为0.01%、0.03%、0.1%。充分混匀后,暗处避光、室温静置20 min,过程中每隔6~7 min用手轻弹混匀后,后续按1.3.3处理,选择最适质量浓度EMA处理进行qPCR检测。
1.3.7 人工污染样品检测从超市、商场、垃圾处理站采集食品、环境样品73份,包括卤鸡肉、牛奶、肉馅、垃圾渗滤液。经高温灭菌后,25 g样品分别加入L.monocytogenes死菌、活菌,增菌液至0.3~0.5麦氏浊度时,食品安全国家标准GB 4789.30-2016[17]定性法和EMA-qPCR方法检测L.monocytogenes。
2 结果与分析
2.1 实验原理
EMA进入热致死L.monocytogenes细胞经可见光曝光,所带的光敏性基团(-N3)脱去(-N2)转化为高活性的氮宾中间体,与DNA链上碳氢化合物结合形成不可逆的共价键(-NH-CH2-),造成DNA永久修饰抑制PCR反应[18]。EMA处理死菌Ct值增加,实现消除“假阳性”特异性检测活菌,见图1。

图1 检测单增李斯特氏菌活菌示意图Fig.1 Overall process of EMA-qPCR assay for detection of live Listeria monocytogenes
前增菌采用非选择BPW培养基,适用于L.monocytogenes、沙门氏菌、阪崎肠杆菌、空肠弯曲菌等食品致病菌在食品加工热处理及防腐剂添加过程中的损伤恢复和增菌培养。本研究方法可同时检测多种致病菌,细菌DNA提取全过程在一个离心管中完成,裂解液直接qPCR检测,操作简单,防止交叉污染。
2.2 qPCR检测特异性
实验重要因素是引物、TaqMan探针对编码李斯特溶血素O(LLO)基因hly灵敏性和特异性。通过检测56株常见的致病菌,包括L.monocytogenes、李斯特菌属、沙门氏菌、金黄色葡萄球菌、大肠埃希氏菌O157、蜡样芽胞杆菌等,结果仅有L.monocytogenes准确扩增检测,其他菌株的Ct值均大于35或无Ct值(无信号),无交叉反应,表明方法有高度特异性,见表2。
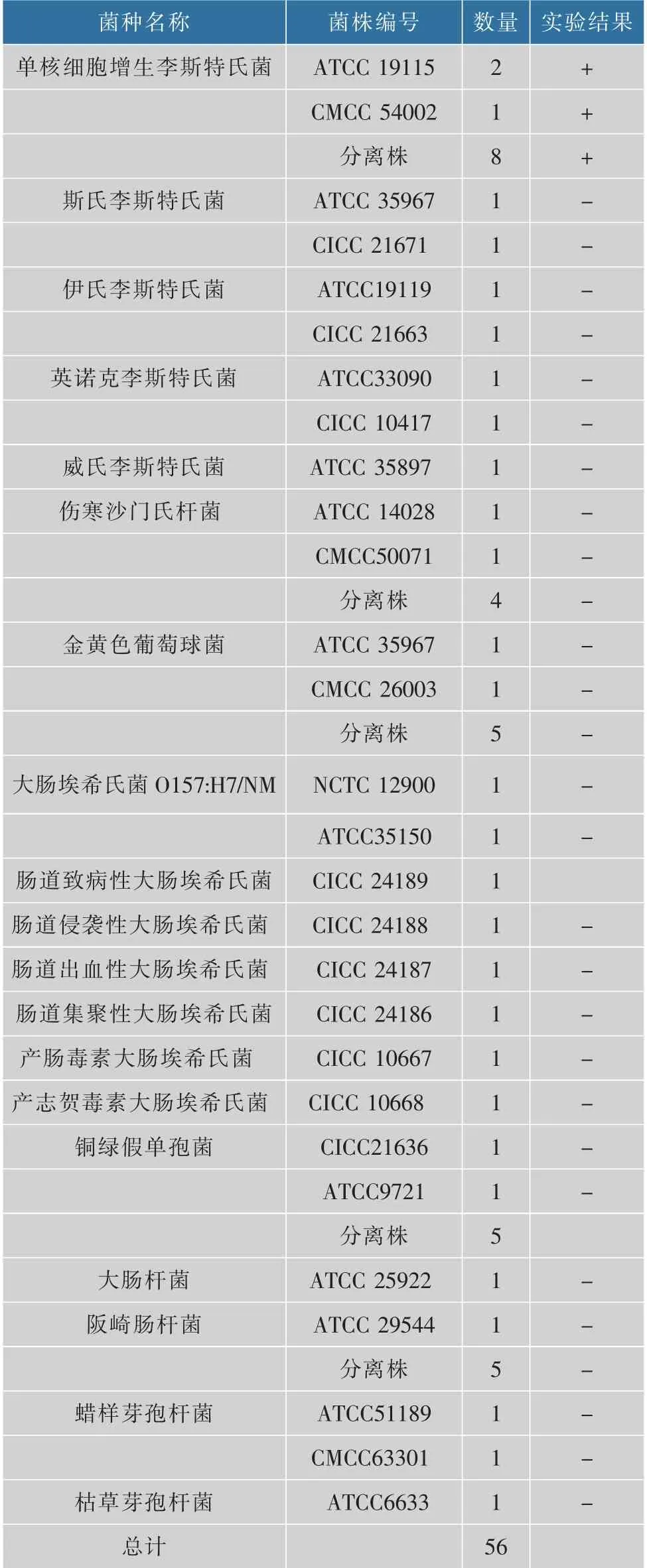
表2 验证qPCR方法检测L.monocytogenes特异性菌株Table 2 Strains used for validation in qPCR assay for identification of Listeria monocytogenes
2.3 最适EMA质量浓度
随着EMA质量浓度的增大,热致死L.monocytogenes的Ct值升增加。当EMA质量浓度为2.5μg/mL时,有效抑制热致死菌DNA扩增,EMA无法进入活菌细胞内,Ct值增幅可以忽略,与未处理的热致死菌相比,Ct值相差6。EMA质量浓度大于5.0μg/mL,死菌Ct值增幅不明显,影响效果接近饱和;EMA进入活菌影响结果,活菌Ct值增加。选取最适质量浓度为2.5μg/mL,经过EMA处理样品菌液qPCR结果增加5以上,判定含有L.monocytogenes死菌,见图2—3。
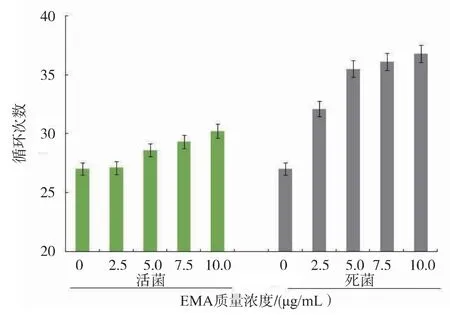
图2 不同质量浓度EMA对活及热致死L.monocytogenes影响Fig.2 Effect of different EMA concentrations on qPCR signals of live and heat-killed Listeria monocytogenes
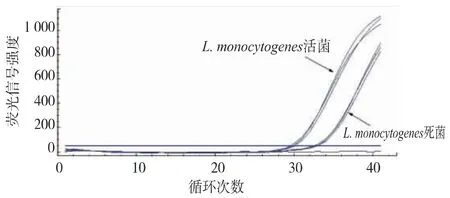
图3 比较EMA质量浓度为2.5μg/mL对活及热致死L.monocytogenes的qPCR扩增Fig.3 Comparison of DNA amplification of live and heat-killed Listeria monocytogenes treated with 2.5μg/mL EMA in the qPCR assay
2.4 检出限
将0.5麦氏浊度L.monocytogenes(约1.5×108CFU/mL)活菌10倍梯度稀释,用质量浓度2.5μg/mL EMA处理菌液,与未处理菌液进行qPCR实验。结果显示,EMA处理与未处理qPCR结果近似,低质量浓度EMA影响较小,标准曲线R2=0.991。菌液浓度为150 CFU/mL时,实验结果Ct值为34.7。EMAqPCR方法检测L.monocytogenes的检出限为150 CFU/mL,见图4。

图4 L.monocytogenes活菌10倍梯度稀释2.5μg/mL EMA处理和未处理qPCR检测结果Fig.4 A serial of 10-fold-diluted live Listeria monocytogenes cell dilutions were treated with EMA or without EMA
2.5 SD增强EMA-qPCR效果
当SD体积分数由0.01%增至0.1%,EMAqPCR检测结果显示,L.monocytogenes活菌Ct值增加。SD体积分数为0.1%时,活菌Ct值为31。分析原因,L.monocytogenes属于革兰氏阳性菌,对胆盐敏感,胆盐通常作为分离革兰氏阴性菌抑制剂,如沙门氏菌、肠出血性埃希氏菌分离培养时使用[19]。高体积分数SD导致活L.monocytogenes细胞膜受损,EMA进入菌体,影响qPCR检测。结果说明SD不适合L.monocytogenes作为EMA-qPCR方法的前处理,见图5。

图5 不同体积分数SD处理对L.monocytogenes活菌、热致死菌EMA-qPCR检测影响Fig.5 Effect of exposure of live and heat-killed Listeria monocytogenes to EMA in the presence of different concentrations of sodium deoxycholate(SD)
2.6 人工污染样品
人工污染样品包括18份卤鸡肉、19份牛奶、29份肉馅和8份垃圾渗滤液,共计73份。阴性样本加入热致死L.monocytogenes,EMA-qPCR方法快速鉴别与传统培养法一致,共计42份阳性样本,30份阴性样本,结果准确率100%,表明本方法良好的实用性和可靠性,见表3。
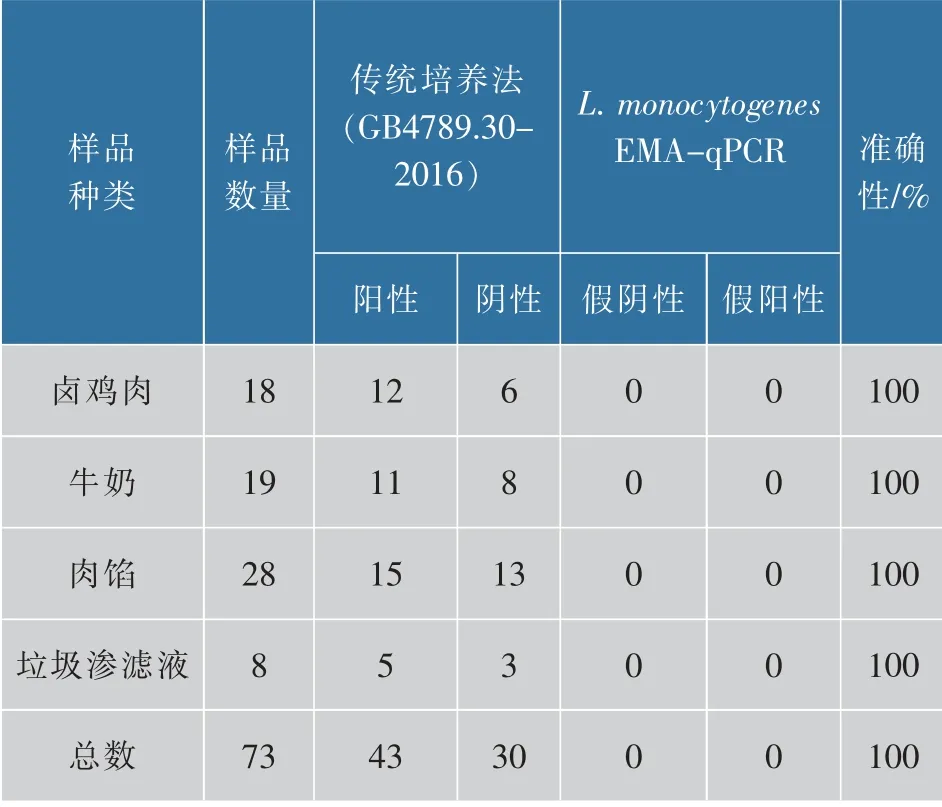
表3 EMA-qPCR方法和传统培养法检测人工污染L.monocytogenes样品结果Table 3 Result of EMA-qPCR method compared to the traditional culture method for identification of Listeria monocytogenes in artificial contaminated samples
3 结语
近年来,国家市场监督管理总局组织食品监督安全抽检显示,微生物污染问题占比较大,许多产品不合格由微生物造成,餐饮领域、环境污水检测致病菌都缺少高效方法。因此,建立快速准确的检测方法对食品安全和环境保护有重要意义。王静等[20]应用PMA-ddPCR方法检测食品中106 CFU/mL灭活沙门氏菌。本研究可直接用qPCR方法检测L.monocytogenes,也可以结合EMA处理检测L.monocytogenes活菌,打消PCR方法无法检测活菌的疑虑。与传统培养法5~8 d相比,EMA-qPCR检测方法24 h完成(包括前增菌、DNA提取、EMA处理和qPCR实验),期待可成为标准检测方法,未来应用于批量检测样品的自动化仪器。

