白藜芦醇调控Hedgehog信号通路抑制肝星状细胞活化的研究
周薏, 阙任烨, 李勇, 朱樑
(1.海军军医大学附属长征医院消化内科,上海 200003;2.上海中医药大学附属上海市中西医结合医院脾胃病科,上海 200082)
肝纤维化是肝硬化发病的重要环节,迄今没有满意的治疗方法。目前国内外绝大多数学者认为,肝星状细胞(hepatic stellate cell,HSC)激活是肝纤维化形成的关键,抑制HSC的激活对肝纤维化的防治具有重要价值[1]。有研究发现Hedgehog信号通路与HSC的活化密切相关,有效干预Hedgehog信号通路可抑制肝纤维化进展[2]。白藜芦醇是存在于中药藜芦、虎杖中的一种多酚类化合物,具有广泛的药理作用,且无毒副作用及致癌性报道[3],抗肝纤维化是白藜芦醇的重要应用领域之一[4-6]。目前,关于白藜芦醇抗肝纤维化的作用机制尚不完全明确,而又有多项研究[7-9]报道白藜芦醇可调控Hedgehog信号通路发挥作用,故本研究旨在观察白藜芦醇抑制HSC-T6细胞活化的机制是否与调控Hedgehog信号通路有关,现将研究结果报道如下。
1 材料与方法
1.1 细胞 大鼠肝星状细胞株HSC-T6由上海第二军医大学长征医院消化科惠赠,其表型为活化的HSC。
1.2 药物、试剂与仪器 白藜芦醇购于中国药品生物制品检定所,纯度>99%,批号:111535-201703;环耙明(cyclopamine)购自美国Cayman公司,批号:11321。α-平滑肌肌动蛋白(α-SMA)(兔抗大鼠IgG多克隆抗体)购自美国Santa Cruz公司,批号:k1814;电化学发光(ECL)试剂盒购自美国Millipore公司,批号:1115702;DMEM高糖培养基购自美国Thermo Scientific公司,批号:NZH1209;胎牛血清(fetal bovine serum,FBS)购自奥地利PAA公司,批号:A10106-0455;牛血清白蛋白(bovine serum albumin,BSA)购自美国Amresco公司,批号:201705;蛋白质分子量预染Marker购自美国Pierce公司,批号:27681;山羊抗兔HRP标记二抗购自美国Cell Signaling公司产品 , 批 号 : 8176; Shh、 Smo、 Patched、 Gli1、Cyclin D1、Cyclin D2、Bcl-2引物由生工生物公司合成;Trizol Reagent购自美国Sigma公司,批号:BCBN5665V;PrimeScriptTMRT Reagent Kit with gDNA Eraser购自日本Takara公司,批号:AK2301;SYBR®Green Realtime PCR Master Mix购自日本Takara公司,批号:AK5005。ChemiDocTMXRS+凝胶成像分析系统(美国Bio-Rad公司);酶标仪(美国Thermo Scientific公司);PCR仪(美国Bio-Rad公司)。
1.3 细胞培养[10]与分组 HSC-T6细胞用含有体积分数10%热灭活胎牛血清的DMEM完全培养基在37℃、体积分数5%CO2、完全饱和湿度条件下常规培养,每48 h更换培养基,细胞生长铺满培养瓶底80%后,用0.25%胰蛋白酶联合0.02%EDTA消化传代。实验选用处于对数生长期细胞,将细胞接种于合适的细胞板中进行培养,24 h后进行干预处理。白藜芦醇组分别加入终浓度为4、8、16 μmol/L的白藜芦醇,环耙明组加入终浓度为100 μmol/L的环耙明,空白组及模型组加入等量培养基溶液。预处理30 min后,模型组及各药物处理组加入终浓度为100 ng/mL的瘦素诱导HSC-T6细胞活化,空白组加入等量培养基溶液。24 h后收集样本进行相关检测。
1.4 四甲基偶氮唑盐(MTT)检测细胞增殖情况[10]取对数生长期的大鼠HSC-T6细胞,常规消化、制备单细胞悬液,接种于96孔培养板中,每孔1×104个/100 μL,另设细胞空白组及单纯培养液本底组。细胞铺板24 h后,每孔加入完全培养基配制的药物,每个浓度设6个复孔,空白组加入等体积的三联液。分别继续培养24 h。加入5 mg/mL的MTT试剂,每孔10 μL,37℃孵育4 h。弃孔内上清,加入二甲基亚砜(DMSO)溶剂,每孔150 μL。37℃恒温摇床中震荡10 min,使沉淀充分溶解后,置于酶标仪上测定490 nm波长的吸光度(OD)值,按以下公式计算细胞增殖率:细胞增殖率=(实验组OD值-本底组OD值)/(空白组OD值-本底组OD值)×100%。
1.5 Western Blot检测[11]将药物处理后的细胞弃去培养液,磷酸盐缓冲液(PBS)洗涤细胞3次后,加入150 μL细胞裂解液(含蛋白酶抑制剂1∶100),置于摇床上30 min(冰上)。用细胞刮刀将细胞刮下后,将细胞悬液移入EP管内,以12 000 r/min离心20 min,取上清。按照1∶4体积比加入5×loading buffer,100℃水浴10 min,使蛋白变性。分装,于-20℃保存备用。配制十二烷基硫酸钠(SDS)—聚丙烯酰胺凝胶电泳(PAGE)胶,分离胶的浓度为8%,积层胶为5%。上样10 μL预染Marker,以确定所检测蛋白带的位置。初始电压为80 V,溴酚蓝电泳至积层胶和分离胶分界面后加大至120 V,至凝胶底部时停止电泳。将蛋白从SDS-PAGE胶上转移至相同大小的NC膜上,转膜条件为电压100 V,90 min。使用50 g/L的脱脂奶粉封闭1~2 h后,加入按比例稀释的一抗(α-SMA 1∶1 000,β-actin 1∶1 000),4℃过夜。使用TBST洗膜以后,加入二抗,即1∶1 000稀释的山羊抗小鼠或兔抗体,室温慢摇1 h。TBST洗膜后,在条带上滴加100 μL的荧光液。使用ChemiDocTMXRS+凝胶成像分析系统进行半定量分析,以积分光密度(IOD)值表示,以目的蛋白/内参蛋白表示目的蛋白的相对表达水平(p)。
1.6 RT-PCR方法[10](1)提取总RNA:取6孔板培养的各组细胞,向每孔加入0.5 mL Trizol溶液,充分吹打。加入200 μL氯仿剧烈振荡15 s,冰上静置10 min。于4℃以12 000 r/min离心20 min,吸取上层液体,转移到新的EP管中。加入等体积异丙醇,混匀,冰上静置10 min,于4℃以12 000 r/min离心20 min。弃上清,沉淀体积分数75%乙醇洗涤2遍。常温下以7 500 r/min离心5 min,弃上清,沉淀干燥然后用20 μL DEPC水溶解得到RNA原液,测各样本RNA浓度。(2)两步法实时逆转录PCR反应:①第1步逆转录:在无核酸酶的离心管中每个样本加入总RNA 4 μg,5×PrimeScript RT Master Mix 2 μL,RNase free H2O补足至10 μL。反应条件:25℃10 min,42℃30 min,85℃10 min。cDNA将得到的样品-20℃短期保存。②第2步PCR反应:各引物见表1。SyberGreen预混Taq酶10 μL,加上下游引物至总浓度10 μmol/L,加入第1步得到的cDNA模板5 μL(稀释10倍后),以DEPC-dd H2O补足至20 μL,混匀,实时上机检测。反应条件为95℃3 min预变性,95℃10 s变性,60℃30 s退火,同时收集荧光,40个循环。由软件自动生成扩增曲线和熔解曲线判断其扩增效率,根据目标基因与GAPDH扩增产物的2-△△CT比值来分析计算各目标基因相对表达量。

表1 PCR引物序列Table 1 PCR primer sequence
1.7 统计方法 采用SPSS 23.0软件进行数据分析,计量资料用均数±标准差()表示,多组数据比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 白藜芦醇对瘦素诱导的HSC-T6细胞增殖与活化的影响 图1结果显示:经瘦素诱导后,HSCT6细胞增殖率明显升高,活化表型α-SMA蛋白表达明显增多,与空白组比较,差异有统计学意义(P<0.01);白藜芦醇呈剂量依赖性抑制瘦素诱导HSC-T6细胞的增殖与活化,与模型组比较,差异均有统计学意义(P<0.01);与模型组比较,环耙明组亦具有显著的抑制瘦素诱导的HSC-T6细胞增殖的作用(P<0.01)。
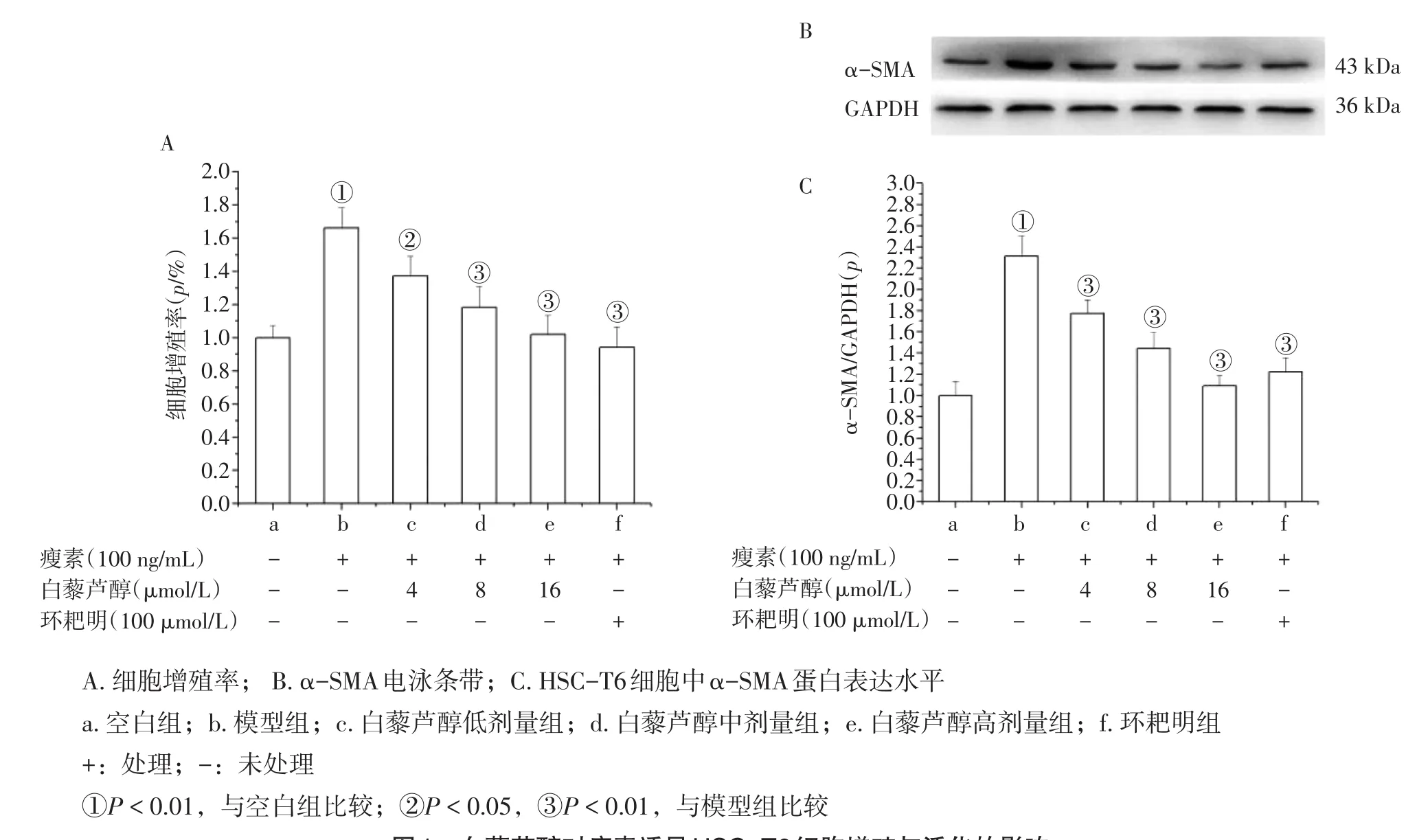
图1 白藜芦醇对瘦素诱导HSC-T6细胞增殖与活化的影响Figure 1 The effects of resveratrol on the proliferation and activation of HSC-T6 cells induced by leptin
2.2 白藜芦醇对活化的HSC-T6细胞中Hedgehog信号通路的影响 图2结果显示,经瘦素诱导后,HSC-T6细胞内Hedgehog信号通路成员Shh、Smo、Patched、Gli1 mRNA表达水平明显升高,与空白组比较,差异均有统计学意义(P<0.01);白藜芦醇呈剂量依赖性抑制活化HSC-T6细胞内Shh、Smo、Patched、Gli1 mRNA的表达,与模型组比较,差异均有统计学意义(P<0.05或P<0.01);环耙明组与模型组比较亦具有显著的抑制Shh、Smo、Patched、Gli1 mRNA表达的作用(P <0.01)。
2.3 白藜芦醇对活化的HSC-T6细胞中Gli1靶基因表达的影响 图3结果显示:经瘦素诱导后,HSC-T6细胞内Gli1靶基因Bcl-2、Cyclin D1、Cyclin D2 mRNA表达明显升高,与空白组比较,差异有统计学意义(P<0.01);白藜芦醇呈剂量依赖性抑制活化HSC-T6细胞内Gli1靶基因Shh、Smo、Patched、Gli1 mRNA的表达,与模型组比较,差异有统计学意义(P<0.05或P<0.01);与模型组比较,环耙明组亦具有显著的抑制HSC-T6细胞Bcl-2、Cyclin D1、Cyclin D2 mRNA表达的作用(P < 0.01)。
3 讨论
肝纤维化是肝硬化过程中一种可逆的病理改变。随着肝纤维化病理机制研究的不断深入,人们发现Hedgehog信号通路的活化与HSC细胞的激活密切相关,该通路可能是一个很有前途的药物干预靶标[2,12-14]。
Hedgehog信号通路是主要的调节昆虫和哺乳动物胚胎发育的经典通路之一,其对细胞命运的决定是通过调节其转录因子Gli的表达来完成的。Hedgehog通路决定着胚胎干细胞的分化发育,HSC可能是定向分化的干细胞,在异常使动因素的作用下,向成纤维细胞转变。Hedgehog信号通路在多种损伤组织的重塑中起重要作用,共同促进创伤的愈合[15-16],如Shh能加速血管生成[17]、心脏修复[18]、神经和皮肤再生[19]、骨骼重塑、定向造血干细胞的分化;而HSC的异常活化则是对受损的肝组织的修复。

图2 白藜芦醇对瘦素诱导的HSC-T6细胞中Hedgehog信号通路的影响Figure 2 The effects of resveratrol on Hedgehog signaling pathway in HSC-T6 cells induced by leptin
Hedgehog信号通路主要由信号分子Shh,膜受体Patched、Smoothened(Smo),一些中间传递分子和转录因子Glis组成。在无配体激活的情况下,Patched经VitD3与Smo结合并抑制Smo的活性;当Hedgehog通路配体Shh与Patched结合后,就解除了对Smo的抑制,进而激活下游Gli家族转录因子,调控靶基因的转录[20]。研究[21]表明,Hedgehog通路的大部分靶基因可以由Gli1转录激活,如调控细胞增殖、控制细胞命运的基因包括Cyclin D1、Cyclin D2、Bcl-2等。Bcl-2是第一个被确认具有抑制凋亡作用的Gli1下游靶基因,其高表达能阻抑多种凋亡诱导因素(如射线、化学药物等)所引发的细胞凋亡[21-22]。Bcl-2的转录是由于Gli的锌指结构域与位于Bcl-2转录起始位点上游的Gli结合位点相互结合所引起的[21]。Zarnara等[23]的研究也证实了Bcl-2在维持人HSC的持续激活中发挥了重要作用。因此,提示Hedgehog通路可通过Gli介导Bcl-2,激活HSC。
在各种生理或病理状态下,Hedgehog通路以旁分泌和自分泌的方式作用于Hedgehog敏感细胞。在慢性肝病的细胞微环境中,受损的肝细胞和活化的HSC大量分泌Hedgehog配体至胞外环境中,与Hedgehog敏感的HSC的相应受体结合,进而活化Hedgehog通路调控HSC的生物学行为[24]。研究[25-28]发现,多种活化的HSC均表达Hedgehog配体和 Hedgehog通路 Shh、Patch、Smo和 Gli等多重组分。另外,还有研究发现Hedgehog通路的激活是静息性HSC(Q-HSC)转变成肌成纤维样HSC(MF-HSC)所需要的,尤其是可促进上皮到间质转换[29];Hedgehog信号通路通过Gli调控相关靶基因,促进HSC不断地活化[30]。用Hedgehog通路抑制剂—环耙明作用后,肝损伤明显降低,并通过调节HSC激活后基因表达的改变,控制细胞的转化,改善肝纤维化[31]。
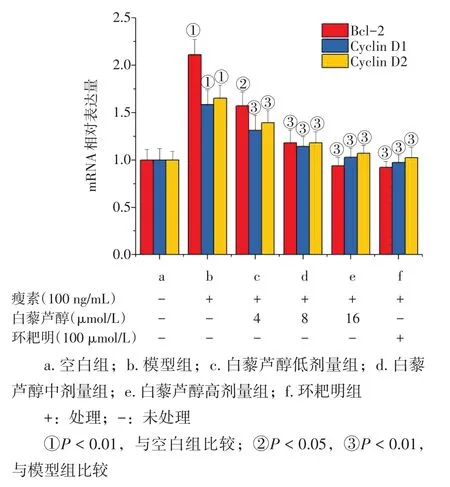
图3 白藜芦醇对瘦素诱导HSC-T6细胞中Gli1靶基因的影响Figure 3 The effects of resveratrol on Gli1 target genes in HSC-T6 cells induced by leptin
中医药在抗肝纤维化方面具有独特优势。大量的临床实践和实验研究表明,一些中药复方、单味中药及中药单体已经被证实有抗纤维化作用,疗效肯定,副作用少。白藜芦醇具有显著的抗氧化应激作用[32],且在体内外均具有明显的抗肝纤维化作用[33]。但目前对其抗纤维化作用机制及靶点的仍不明确。有文献[7-9]报道,白藜芦醇能够通过下调Hedgehog信号通路抑制上皮间质转化,进而在治疗胰腺癌转移、肾纤维化、肺纤维化等疾病中发挥重要作用。故本研究将白藜芦醇调控Hedgehog信号通路这一机制引入肝纤维化这一疾病进行实验探索。本次研究发现白藜芦醇能够通过抑制Hedgehog信号通路活化及其下游靶基因表达,从而达到抑制HSC细胞激活的作用。由于Hedgehog信号通路参与细胞增殖、细胞凋亡、上皮细胞间质转化等多种肝纤维化病理机制,我们推测其抑制纤维化作用可能是通过促进HSC凋亡,抑制上皮细胞间质转化等途径发挥其药理作用,但仍需进一步实验证实。本研究结果不仅对发现白藜芦醇新的药理作用机制和作用靶点具有积极的作用,也为中药新药的开发提供了一定的实验依据,可为白藜芦醇临床应用于治疗各种急慢性肝脏疾病提供一定的理论支持。

