硫化亚铁去除水中四氯化碳的实验研究
蔡邦成, 翟由涛, 王玉磊
(南京国环科技股份有限公司, 江苏 南京 210000)
0 引言
四氯化碳是一种挥发性有机物, 作为一种重要的工业原料和溶剂被广泛应用于化工、制药等行业,化学性质稳定,能够在环境中长期存在,受污染场地的治理和修复均十分困难[1-2]。 同时,由于四氯化碳的挥发性和类脂物可溶性,容易通过皮肤、粘膜等被生物体吸收,造成严重毒害作用[3-5]。 随着我国工业的不断发展,四氯化碳污染也日益严重,尤其在工业发达的地区, 由于工业废水中四氯化碳的超标排放及部分工业企业偷排,导致部分地区土壤、地下水环境受到严重影响,甚至危害了区域饮用水安全。如我国山东小清河沿岸水井监测结果, 区域浅层地下水四氯化碳污染面积达80 km2, 污染区肝病及肠胃病的发病率明显较高[6]。 韩宝平等[7]研究我国北方某城市岩溶水源地污染情况发现,受制药厂影响,导致区域岩溶水中四氯化碳浓度增加, 污染面积达17.5 km2, 井水中四氯化碳最高质量浓度达3.9 mg/L,污染严重。 张新钰等[8]研究我国华北某污染场地大气、水、土壤及地下水中四氯化碳污染,发现污染主要集中在地下水中, 饮水暴露途径致爱危害指数最大达到了3.03×10-5,超过可接受的风险水平。
目前, 学者关于四氯化碳的去除的研究包括生物降解[9-10]、曝气吹脱[11-12]以及还原脱氯[13]等方法,其中还原脱氯方法因效率高、 适应性强且处理彻底的特点被研究和利用, 目前常用的方法包括电化学法[14]和零价铁还原法[15]等,处理效果好但成本相对较高。近年来,国内外部分学者利用FeS 去除氯代烃类污染物,也取得了一定的成效[16],FeS 中含有铁和硫2 种还原性物质,在四氯乙烯、六氯乙烷、三氯乙烯等的去除中均有较好的效果;另一方面,FeS 在还原性土壤和底泥中普遍存在, 且在硫酸盐还原条件下可以通过微生物作用自动生成,成本相对较低。因此,研究利用FeS 为还原性材料,探讨其对四氯化碳的降解的可行性, 并分析不同条件对FeS 降解四氯化碳的影响。
1 材料与方法
1.1 实验材料
实验用FeS 购自国药集团化学试剂有限公司(化学纯,≥70%), 将FeS 破碎筛选0.35 ~0.45 mm的颗粒,磁选去除杂质,以去离子水洗去浮灰,然后用稀硫酸溶液(pH 值为2 ~3)洗去表面氧化层,再用去离子水清洗2 ~3 次, 以95%乙醇浸泡30 min灭菌,后置于40 ℃真空干燥箱中烘干待用。
试验用水采用蒸馏水, 由东南大学蒸馏水厂提供。 四氯化碳(分析纯),国药集团化学试剂有限公司。 甲醇(分析纯)、乙醇(分析纯)、氢氧化钠(分析纯)、硫酸(分析纯),南京化学试剂有限公司。
1.2 实验装置
反应在100 mL 血清瓶中进行,购自上海安谱科学仪器有限公司。 通过恒温震荡实现试验体系的均一性和环境条件的一致性。
四氯化碳测定采用美国Agilent6890N 自动顶空进样气相色谱仪。 参数设置为:HP-5 石英毛细管柱(30 m×0.32 mm×0.25 μm)、ECD 电子捕获检测器;顶空瓶温度40 ℃、瓶平衡时间40 min、定量圈温度85 ℃、传输线105 ℃;进样口温度150 ℃,检测器温度250 ℃,载气流量20 mL/min(分流比10 ∶1);程序升温:30 ℃(保持1 min),10 ℃/min 升至80 ℃(保持1 min)。
1.3 实验方法
研究表明,FeS 还原体系反应效率主要受反应时间、反应温度、pH 值及FeS 的投加量影响,因此,研究综合考虑设置反应条件见表1。
将100 mL 去离子水倒入100 mL 血清瓶中,添加一定量的FeS, 然后注入100 μL 质量浓度为1×104mg/L 的四氯化碳(实验体系四氯化碳质量浓度为10 mg/L),调节相应pH 值,将反应瓶置于恒温振荡器上,在200±5 r/min 下反应。定时用微量取样器取样分析四氯化碳的浓度。
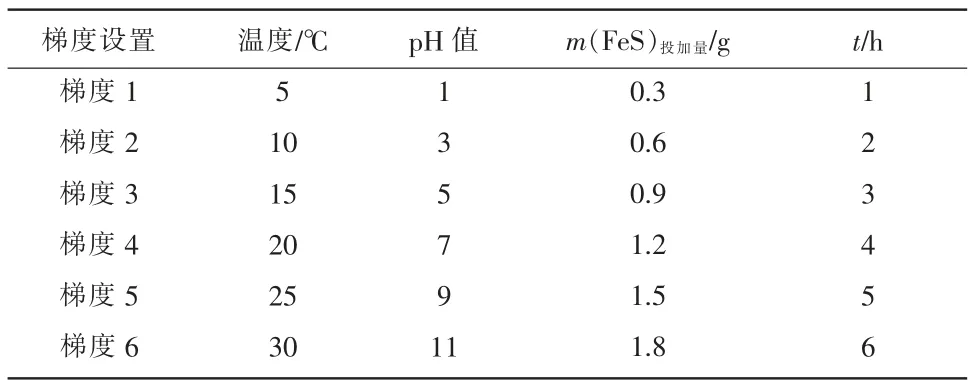
表1 不同影响因素及梯度设置
2 结果与讨论
2.1 反应温度对四氯化碳去除的影响
研究通过预实验, 确定反应时间为4 h 时,FeS还原反应体系对四氯化碳的降解效率可达85%以上,并结合查阅的文献资料及可操作性,确定在pH值=7,FeS 投加量为1 g, 反应时间为4 h 条件下研究反应温度对四氯化碳去除的影响,结果见图1。

图1 反应温度对四氯化碳去除的影响
温度是反应的重要影响因素。温度升高时,绝大多数反应的速率都会加快。 升温使反应物分子的能量增加, 大量的非活化分子获得能量后转变为活化分子,体系中活化分子百分数增加,有效碰撞次数增多,因而反应速率明显加快。 由图1 可以看出,四氯化碳去除率随温度升高而增大。 温度从5 ℃上升至10 ℃时, 硝基苯去除率略有增加, 从65.0%增至66.7%; 之后四氯化碳的去除率随温度升高呈线性方式增加, 至25 ℃时, 四氯化碳的去除率已达到95.6%,几乎将体系中四氯化碳完全去除,因此,综合实际情况,确定最佳反应温度为25 ℃。
2.2 反应体系pH 值对四氯化碳去除的影响
根据反应温度对四氯化碳去除的影响结果,确定反应条件为:反应温度为25 ℃、反应时间为4 h、FeS 投加量为1.0 g, 研究反应体系pH 值对四氯化碳去除的影响,结果见图2。

图2 pH 值对四氯化碳去除的影响
由图2 可以看出, 为反应体系初始pH 值对四氯化碳去除率的影响,可以看出,四氯化碳去除率随pH 值变化呈负相关性变化规律。 初始pH 值为酸性时,四氯化碳去除率较高,最高达100%;而在中性区,四氯化碳去除率随着pH 值的增加缓慢降低;至pH 值为碱性时,四氯化碳去除率几乎出现断层式的下降。 形成原因主要有:①FeS 还原反应体系中,主要由Fe2+,S2-提供四氯化碳加氢脱氯所需的电子,其还原脱氯模式见图3。 当pH 值呈酸性时,溶液中存在较高浓度的H+, 促进了四氯化碳加氢反应的进行,随着pH 值增加,反应体系中H+浓度逐渐降低,降解反应被抑制;②当pH 值为碱性时,溶液中存在大量的OH-,与还原产生的Fe3+转化为Fe(OH)3沉淀并附着在FeS 表面, 占据FeS 表面活性位点阻碍反应进行,此外,OH-也可与FeS 表面的铁基团络合生成氧化物或沉淀阻碍反应的进行, 而酸性条件则不易形成钝化层。 考虑实际应用中的可操作性,当pH值为5 ~7 时, 能满足处理要求, 由于反应过程中Fe3+的形成会消耗反应体系中的OH-,因此研究选择最佳pH 值为7。

图3 FeS 还原降解四氯化碳反应过程
2.3 FeS 投加量对四氯化碳去除的影响
FeS 颗粒是四氯化碳还原反应中电子供体的最终来源, 体系中FeS 与四氯化碳的浓度比必然会对反应产生影响。 根据研究结果,选择25 ℃,pH 值=7、反应时间4 h 的条件下分析不同FeS 投加量对四氯化碳去除的影响,结果见图4。 可以看出FeS 用量对四氯化碳的还原有重要影响,当FeS 用量在0.3 ~1.2 g 范围内变化时这种影响尤为显著,随着FeS 用量增加,四氯化碳浓度线性下降,去除率显著增加,当FeS 投加量为1.2 g, 反应4 h 后四氯化碳的去除率可达到99.0%。 四氯化碳和FeS 组成的反应体系中,无论哪一种物质增加都会对反应效率造成影响,因此二者存在最佳比例关系, 通过分析FeS 投加量对降解效率的影响, 可知Fes 和四氯化碳的最佳反应质量比为1 200 ∶1。

图4 FeS 投加量对四氯化碳去除的影响
2.4 反应时间对四氯化碳去除的影响
根据以上研究结果, 选择25 ℃,pH 值=7,FeS投加量为1.2 g 的条件下,分析四氯化碳随反应时间的变化规律,结果见图5。 由图5 可以看出,随着反应时间的进行, 溶液中四氯化碳的去除速率呈先增加后减小的趋势。 反应前3 h 内,溶液中四氯化碳去除率快速增加,之后去除速率逐渐降低,到4 h 后四氯化碳去除率趋于平缓变化, 直到溶液中四氯化碳被完全消耗。 FeS 主要通过提供电子给四氯化碳实现四氯化碳的脱氯还原,反应初期,系统中FeS 与四氯化碳充分接触,随着反应时间的增加,溶液中四氯化碳不断被消耗,四氯化碳浓度降低,同时溶液中三氯甲烷等中间产物不断增加, 与四氯化碳竞争反应体系中的电子,加上FeS 的不断消耗,导致降解速率变慢,结合反应的实际情况以及工程因素,确定最佳反应时间为3.5 h。
通过分析, 四氯化碳去除率符合一级动力学反应过程,表示为:

式中:C 为反应物质量浓度,mg/L;t 为反应时间,h;k为反应速率常数。
设四氯化碳初始质量浓度为C0,mg/L;t(h)时刻后的反应质量浓度为Ct,mg/L; 对上述公式进行积分,得到:

两边取对数:

即ln(C0/Ct)与反应时间呈线性关系,其斜率为降解速率常数。 计算后获得最佳条件下FeS 还原降解四氯化碳的k=0.962 5 h-1。
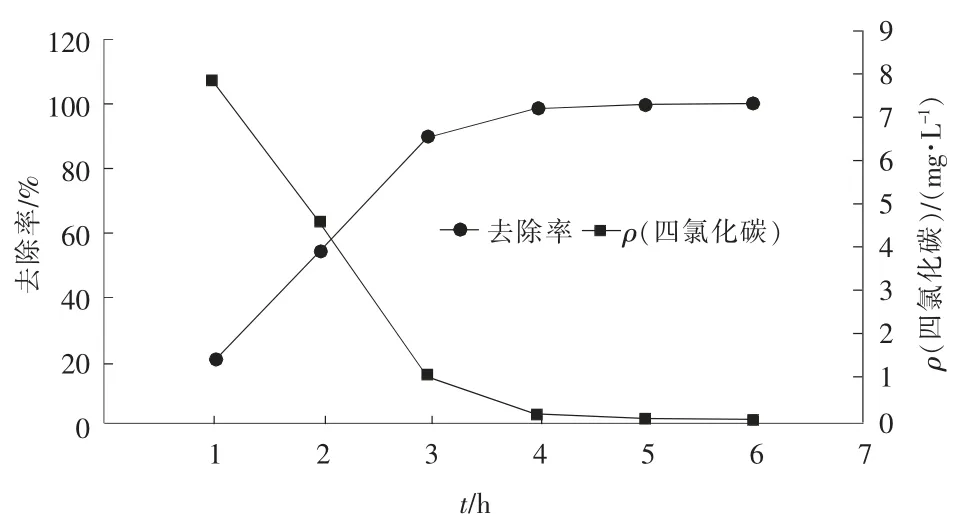
图5 FeS还原反应时间对四氯化碳去除效率的影响
3 结论
(1)FeS 去除水中四氯化碳主要受反应温度、pH值、反应时间和FeS 投加量的影响,除pH 值外,水中四氯化碳的去除率和反应温度、 反应时间以及FeS 投加量呈正相关。
(2)FeS 去除水中四氯化碳的最佳反应条件:反应时间为3.5 h,温度为25 ℃,pH 值为7,FeS 投加量为1.2 g,此时FeS 和四氯化碳的质量比为1 200 ∶1,四氯化碳去除率可达95%以上。
(3)FeS 还原水中四氯化碳的反应过程符合一级反应动力学过程, 最佳反应条件下四氯化碳的k为0.962 5 h-1。

