miR-497调控PlexinA4对鼻咽鳞状细胞癌侵袭和迁移能力的影响研究
徐志 邢朝晖 徐淑芠 赵臣
鼻咽鳞状细胞癌是常见的恶性肿瘤之一,具有发病迅速,转移率高的特点,目前治疗鼻咽鳞状细胞癌的主要手段是手术,但术后复发率较高,且早期症状不明显,患者在就诊时往往处于晚期[1],治愈力低,因此寻找新的靶点成为医学工作者不断探寻的课题。有文献报道鼻咽鳞状细胞癌的侵袭和癌基因的活化表达相关,因此揭示鼻咽癌相关的基因和调控机制,对控制鼻咽癌转移具有重要的意义[2]。癌细胞的侵袭能力与细胞内miRNA密切相关,miR-497在多种癌细胞中如肺癌、膀胱癌、乳腺癌、宫颈癌中活性受抑制[3-7],原因可能miR-497通过某些特定的通路起到抑癌基因的作用。PlexinA4作为重要的信号通路,参与到癌细胞的侵袭与转移过程,有报道称喉鳞状癌细胞中miR-497与PlexinA4的表达量呈负相关,而沉默PlexinA4基因,喉鳞状癌细胞的侵袭率显著降低[8]。而miR-497和PlexinA4在鼻咽癌鳞状细胞中的表达及与细胞侵袭能力的研究笔者所见鲜有报道,因此本实验通过研究miR-497与PlexinA4与在鼻咽癌鳞状细胞侵袭能力之间的关系,从而为治疗鼻咽癌提供新的靶点。
1 材料与方法
1.1 材料 收集2017年1月至2018年12月于我院就诊且经病理学确诊的鼻咽鳞状细胞癌患者60例的癌组织及相应癌旁组织,其中男30例,女30例;年龄40~75岁,平均年龄(54.01±6.21)岁;按美国肿瘤研究联合第七版分期:Ⅰ期20例,Ⅱ期20例,Ⅲ期30例,Ⅳ期10例;淋巴结分期N0+N1患者38例,N0+N1患者22例。术前患者均未进行放化疗。患者及其家属签署知情同意书。鼻咽鳞状细胞HEP-2采购自ATCC细胞库。
1.2 试剂与仪器 miR-497 mimics和阴性对照(货号B05009)由上海吉玛制药技术有限公司代为合成;qRT-PCR检测试剂盒、Trizol总RNA 提取试剂盒、Bulge-Loop miRNA、 购自广东锐博生物科技技术股份有限公司;DMEM细胞培养基购自Hyclone 公司、Promega Dual-Luciferase ReporterAssay System试剂盒、胰蛋白酶购自美国Gibco公司;青、链霉素购自华北制药有限公司、SYBR Premix Extaq system 购自宝生物工程(大连)有限公司、TRIzol细胞培养箱采购自上海三腾仪器有限公司。各种抗体:PTEN 兔抗 (WB)、PTEN 兔抗 (IHC)、Occludin 兔抗购自美国 santacruz 公司、二抗(IHC)、Actin 鼠抗购自Fermentas 公司。实时荧光定量PCR仪购自应用生物系统公司、恒温培养箱购自上海谱元仪器有限公司。
1.3 方法
1.3.1 免疫组织化学检测PlexinA蛋白表达:将收集的组织样本固定包埋并切片,用二甲苯和梯度乙醇脱蜡后置于柠檬酸盐缓冲液中进行修复,以充分暴露抗原决定簇。然后用3%的过氧化氢室温下浸泡10 min,封闭,分别加稀释好的一抗4℃过夜孵育,次日冲洗干净,分别加入适量生物素标记的二抗室温孵育30 min,清洗。加适量DAB作用2~5 min后用去离子水终止反应,苏木素复染1.5~2 min,清洗后于梯度乙醇中脱水,二甲苯浸泡并干燥后用中性树胶封片,镜检观察并记录实验结果。由两位经验丰富的病理医师对病理切片进行盲评。每张切片随机选取5个高倍镜视野(×400)在光镜下观察,用阳性细胞染色强度和阳性细胞比例来判定染色结果。染色强度评分:无显色为0分,浅黄色或黄色为1分,棕黄色为2分,棕褐色为3分。以染色细胞的阳性比例评分<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。上述2项积分相乘,积分0分为阴性(-),≥1分为阳性。
1.3.2 细胞培养:液氮中取出人鼻咽癌鳞状细胞株HEP-2,37℃水浴溶解,加入含有10%FBS的DMEM培养基中,离心去上清,加入细胞培养液悬浮细胞,接种于培养瓶中,37℃,5%CO2培养,融合度到80%,采用0.25%的胰蛋白酶消化,采用完全培养基传代。传代次数一致且细胞处于对数期用于后续研究。
1.3.3 实时定量PCR检测miR-497及PlexinA4mRNA的表达:取200 mg癌组织及癌旁组织磨碎,Trizol液与组织处理液混合作用10 min,12 000 r/min离心10 min,去除上层清液,加入Trizol与氯仿震荡混匀,12 000 r/min 离心20 min,加入异丙醇,用移液器吹打均匀,12 000 r/min离心后,弃去上层清液,留下层絮状沉淀,加入Trizol与乙醇的混合液,离心弃上清。提取的RNA用DEPC水溶解,按照反转录试剂盒反转录总的cDNA。按照SYBR方法进行实时定量PCR,并以U6为内参。结果用2-ΔΔCT表示,设计试验重复。检测各组基因的表达量。引物miR-497 上游5’-CAGGGTCCGATTCA-3’下游5’-TAGCCGCACACTGTGGT-3’,PlexinA4上游5’-TCTCAGTACAACGTGC-3’上游5’-TAGCACTGGATCGAT-3’。
1.3.4 miR-497过表达细胞系的构建:调整鼻咽鳞状细胞HEP-2浓度为1×106个/ml,取2 ml接种于6孔板中,培养过夜,采用Lipofectamine2000将浓度均为100 nmol/L的miR-497 mimics和阴性对照转染至细胞,以空脂质体作为对照。
1.3.5 蛋白免疫印迹检测PlexinA4蛋白的表达:取转染48 h细胞,加入适量的RIPA裂解液,裂解30 min,离心,条件为12 000 r/min,4℃ 10 min,收集上清。采用BCA试剂盒检测蛋白浓度,将蛋白样品和Loading buffer混合,100涉世度水域变性5 min,然后加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,浓缩胶时调整电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,加入一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h。加入ECL显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。
1.3.6 双荧光素酶报告基因检测:利用PCR方法构建PlexinA4-wt(野生型PlexinA4-2-3’UTR序列的荧光素酶报告基因质粒)及PlexinA4-mut(突变型PlexinA4-2- 3’UTR序列的荧光素酶报告基因质粒),将1.3.1中HEP-2癌细胞复苏,DMEM培养液将癌细胞稀释到1×105/ml,接种到细胞培养板上,把PlexinA4-wt质粒、PlexinA4-mut质粒、miR-497模拟物和阴性对照转染分别转染至相应的HEP-2癌细胞中,37℃、5%CO2培养48 h。检测各组处理荧光素酶活性。
1.3.7 细胞侵袭实验:8 μl的Matrigel覆盖于transwell小室底部,消化液将试验组及对照组细胞消化,细胞计数,吸取1×105个细胞加入到上室,下室加入细胞培养液,将小室置于细胞培养箱中培养24 h,取出后用无水甲醇固定,用1%的结晶紫染色30 min,PBS冲洗多余染料,放于高倍镜视野计数穿透细胞数。
1.3.8 细胞迁移实验:取处于对数期的HEP-2细胞,调整细胞浓度至1×105接种于6孔板,用一次性接种环画出无细胞区,采用磷酸缓冲液吸取划痕后脱落的细胞并进行拍照,实验分为3组:对照组、空白对照组、miR-497过表达组。培养24 h后进行拍照,观察细胞迁移能力。

2 结果
2.1 miR-497及PlexinA4在鼻咽鳞状细胞癌组织和癌旁组织中的表达 免疫组织化学结果显示PlexinA4在鼻咽鳞状细胞癌组织中的阳性表达率为86.67%(52/60)明显高于癌旁组织中的阳性表达率33.33%(20/60),差异有统计学意义(χ2=35.556,P=0.000)。qRT-PCR结果也显示鼻咽鳞状细胞癌组织中的PlexinA4 mRNA的表达量显著高于癌旁组织,差异有统计学意义(P<0.01)鼻咽鳞状细胞癌组织中miR-497的表达量显著低于癌旁组织,差异有统计学意义(P<0.01)。见图1、2,表1、2。
2.2 miR-497过表达细胞系构建 qRT-PCR结果显示空白对照组和阴性对照组miR-497的表达差异无统计学意义(P>0.05),过表达组中miR-497的表达量明显高于空白对照组和阴性对照组,差异有统计学意义(P<0.01),提示成功构建miR-497过表达细胞系。见图3,表3。
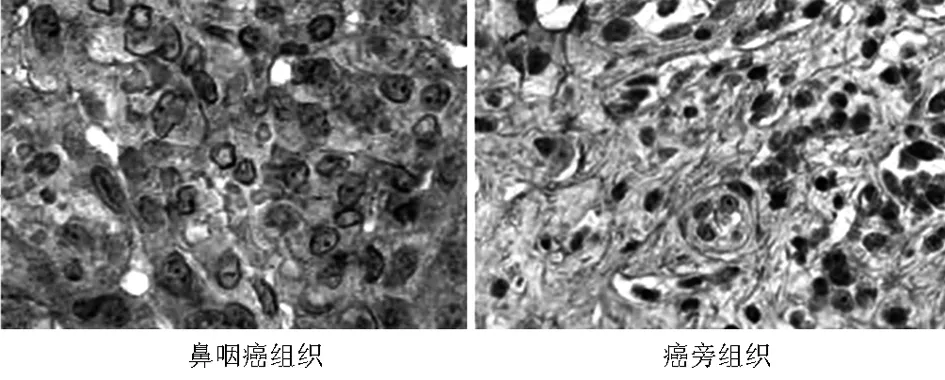
图1 PlexinA在鼻咽鳞状细胞癌组织和癌旁组织中的表达(免疫组织化学×400)
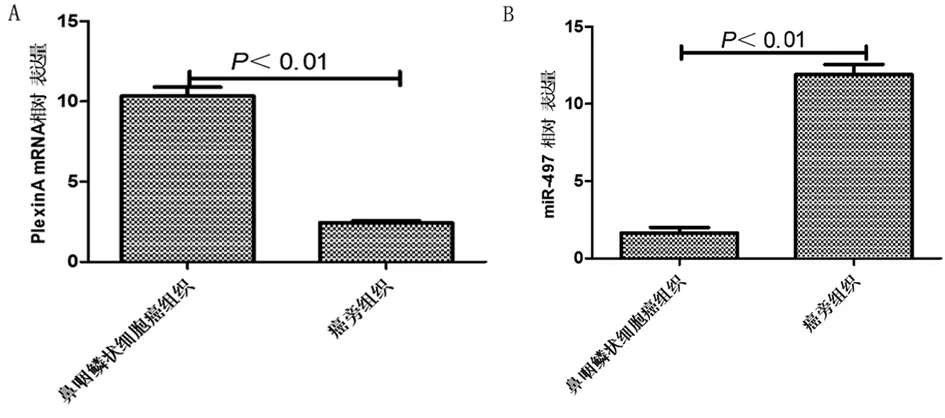
图2 miR-497及PlexinA4 mRNA在鼻咽鳞状细胞癌组织和癌旁组织中的表达

表1 PlexinA在鼻咽鳞状细胞癌组织和癌旁组织中的表达 n=60,例(%)

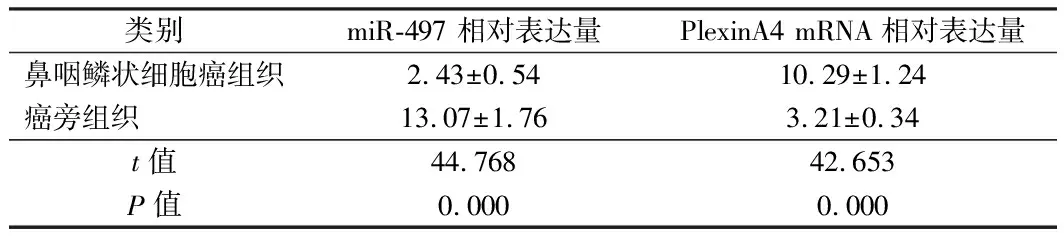
类别miR-497 相对表达量PlexinA4 mRNA相对表达量鼻咽鳞状细胞癌组织2.43±0.5410.29±1.24癌旁组织 13.07±1.763.21±0.34t值44.76842.653P值0.0000.000

图3 RT-PCR检测miR-497在鼻咽癌细胞HEP-2中的表达
表3 RT-PCR检测miR-497在鼻咽癌细胞HEP-2中的表达
2.3 miR-497过表达对PlexinA4蛋白的影响 Western blot检测结果显示miR-497过表达组中PlexinA4的表达明显低于空白对照组与阴性对照组(P<0.01),空白对照组和阴性对照组中PlexinA4的表达量差异无统计学意义(P>0.05),提示miR-497能够下调PlexinA4的表达。见图4,表4。

图4 miR-497过表达对PlexinA4蛋白的影响
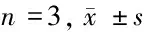
表4 miR-497过表达对PlexinA4蛋白的影响
2.4 双荧光素酶报告基因检测结果 双荧光素酶报告基因检测转染miR-497后,PlexinA4-wt(野生型PlexinA4-2-3’UTR序列的荧光素酶报告基因质粒)荧光活性的相对表达量受到显著抑制(P<0.01),PlexinA4-mut(突变型PlexinA4-2-3’UTR序列的荧光素酶报告基因质粒)荧光活性的相对表达量没有变化(P>0.05)。说明miR-497与PlexinA4具有靶向关系。见图5,表5。
2.5 miR-497对HEP-2侵袭能力的影响 miR-497过表达组穿透细胞数明显低于空白对照组和阴性对照组,差异有统计学意义(P<0.001),而空白对照组和阴性对照组穿透细胞数差异无统计学意义(P>0.05),提示miR-497能够抑制HEP-2的侵袭能力。见图6,表6。
2.6 miR-497对HEP-2迁移能力的影响 miR-497过表达组HEP-2迁移率明显低于空白对照组和阴性对照组,差异有统计学意义(P<0.01),而空白对照组和阴性对照组迁移率无统计学意义(P>0.05),提示miR-497能够抑制HEP-2的迁移能力。见图7,表7。
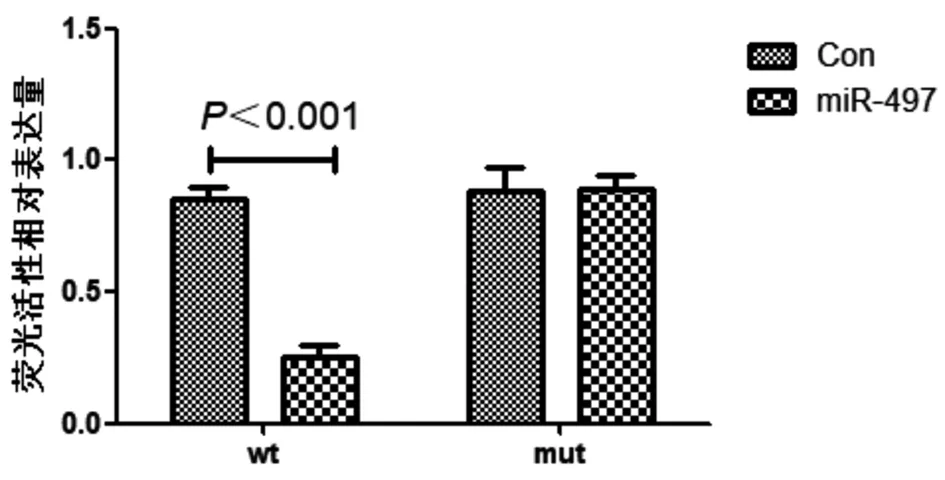
图5 双荧光素酶报告基因检测结果
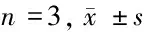
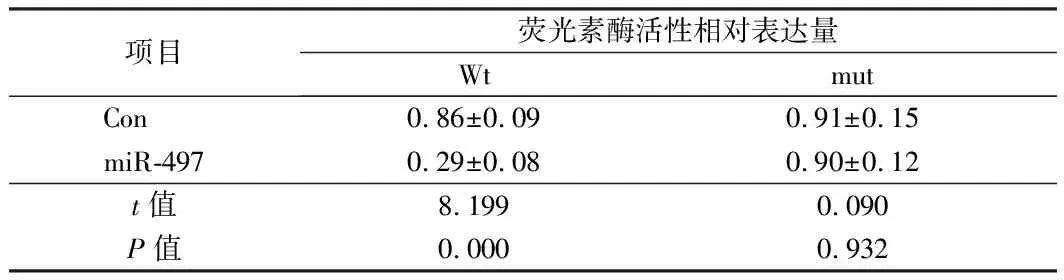
项目荧光素酶活性相对表达量WtmutCon 0.86±0.090.91±0.15miR-4970.29±0.080.90±0.12t值8.1990.090P值0.0000.932
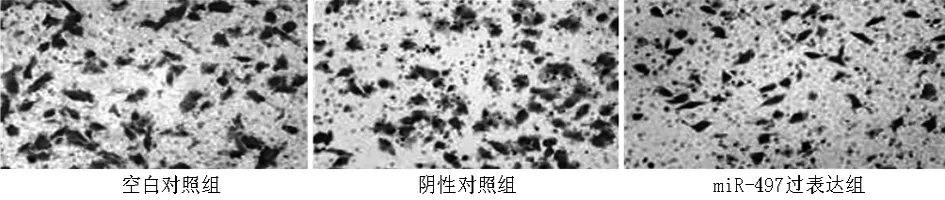
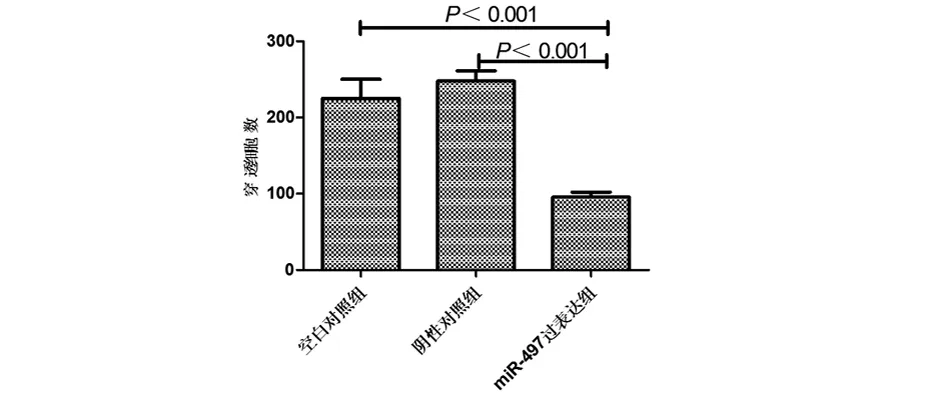
图6 miR-497对HEP-2侵袭能力的影响(结晶紫染色×200)

表6 miR-497对HEP-2侵袭能力的影响 n=3,个,
3 讨论
鼻咽癌因其发病位置比较隐蔽,不容易检查,且早期症状复杂,缺少明显的特征,所以往往被忽视,导致诊断和治疗延误。miRNA是通过碱基不完全互补的方式结合于靶基因上,从而影响肿瘤细胞的凋亡、迁徙与转移,并引发周围细胞的坏死与凋亡[9]。miR-497位于人类染色体17p13.1上,张蔚等[10]发现miR-497在宫颈癌细胞中表达受抑制,miR-497可以通过下调靶基因HPV-16 E6/E7影响癌细胞侵袭。王娟娟[11]采用RT-PCR检测发现miR-497在结肠癌组织中的表达明显低于癌旁组织。管晓翠等[12]研究表明在星形细胞瘤患者癌组织和血清中,miR-497的表达量下降。本研究采用RT-PCR检测其在鼻咽癌组织和癌旁组织中的表达发现,在鼻咽癌组织中表达水平明显低于癌旁组织,提示miR-497在鼻咽癌的发生发展中可能起着重要作用。

图7 miR-497对HEP-2迁移能力的影响

表7 miR-497对HEP-2迁移能力的影响
为了进一步观察miR-497在鼻咽癌中的作用,本研究构建了稳定过表达miR-497的细胞系,结果显示miR-497能够明显抑制鼻咽癌细胞HEP-2的侵袭能力和迁移能力。PlexinA4作为神经受体丛素的一员,能够通过触发Plexins相关的受体型和非受体型发挥生物功能,譬如调节细胞粘附和迁移等[13],有文献报道称PlexinA4在胶质瘤细胞中异常高表达,通过RNA干扰技术下调PlexinA4表达后,神经胶质瘤细胞的增殖能力明显受到抑制,S期细胞数量明显减少[14]。本研究通过免疫组化检测鼻咽鳞状癌和癌旁组织中PlexinA4的表达,结果显示PlexinA4在鼻咽鳞状细胞癌组织中的阳性表达率为86.67%(52/60),明显高于癌旁组织中的阳性表达率33.33%(20/60),差异有统计学意义(χ2=35.556,P=0.000)。qRT-PCR结果也显示鼻咽鳞状细胞癌组织中的PlexinA4 mRNA的表达量显著高于癌旁组织,差异有统计学意义(P<0.001),提示PlexinA4能够促进鼻咽癌的发生发展。
有学者研究发现miR-497和PlexinA4 mRNA在喉鳞癌中的表达呈明显的负相关关系,且统计学结果显示miR-497、PlexinA4 与喉鳞癌的分化程度密切相关[15],为了进一步观察miR-497和PlexinA4的关系,本研究采用生物信息学数据库对miR-497的靶基因进行预测,并采用双荧光素酶实验检测荧光素酶活性比值变化,结果显示miR-497能够明显抑制靶基因PlexinA4在鼻咽癌细胞HEP-2中的翻译水平。
综上所述,miR-497在鼻咽鳞癌中高表达,高表达miR-497能够抑制鼻咽鳞癌细胞系PlexinA4 基因减少及蛋白表达,并通过降低PlexinA4 的表达量来影响细胞转移。可以将miR-497/PlexinA4作为研究的新方向,为新型的生物药品提供理论基础。

