肢带型肌营养不良2D 型1 例临床与基因型分析
徐 敏 郭 虎 高修成 卢孝鹏
南京医科大学附属儿童医院 1.神经内科,2.影像科(江苏南京 210008)
肢带型肌营养不良症2 D 型(limb-girdle muscular dystrophy type 2 D,LGMD 2 D)是一种罕见的常染色体隐性遗传性肌病,由α-sarcoglycan 基因(SGCA)突变引起,于1994 年Roberds 等[1]首次报道。LGMD 2 D 主要表现为肢体和骨盆肌肉无力,血清肌酸激酶水平明显升高,肌电图和肌肉活检可见肌源性损害。本文回顾分析1 例LGMD 2 D 患儿的临床和分子遗传学特征,以提高临床医师对该病的认识。
1 临床资料
患儿,男,6岁8个月,因进行性肌无力13个月于2016年5月至南京医科大学附属儿童医院神经内科就诊。患儿5 岁7 个月出现肌无力、易疲劳、不喜运动、跑步速度慢、爬楼困难、蹲起费劲,症状进行性加重,有时走路脚跟不着地,无感觉异常。患儿系G2P2,足月顺产,14 个月独走,智力发育无异常。父母体健,否认近亲结婚;姐姐11 岁,体健。体格检查:神志清楚,精神反应可,面色正常,心肺腹无异常,四肢肌张力略低,双臂上抬有力(图1A),双侧腓肠肌肥大(图1B),双上肢肌力5级,双下肢近端肌力4-级,远端肌力4级,双侧膝反射减弱,锥体束征阴性,Gower征阳性。实验室检查:天冬氨酸转氨酶(AST)308 U/L,乳酸脱氢酶(LDH)1 375 U/L;磷酸肌酸激酶(CK)高于正常值119倍,达20 602 U/L;肌酸酶同工酶(CK-MB)496 U/L。心脏彩超提示心内结构及心功能未见异常。肺功能检查未见异常。肌电图示右侧腓总神经及左侧股神经复合肌肉动作电位(compound muscle action potential,CMAP)波幅处于下限水平,放松时部分被检肌自发电位阳性,轻收缩时部分被检肌运动单元电位(motor unite potential,MUP)形态部分偏窄或偏窄,伴或不伴多相电位和/或不规则波增多,被检肌重收缩见混合干扰相或干扰混合相,提示肌源性损害。肌肉核磁共振(MRI)检查示双下肢皮下脂肪层及肌肉内见条片状压脂序列高信号,肌肉层著(图2)。
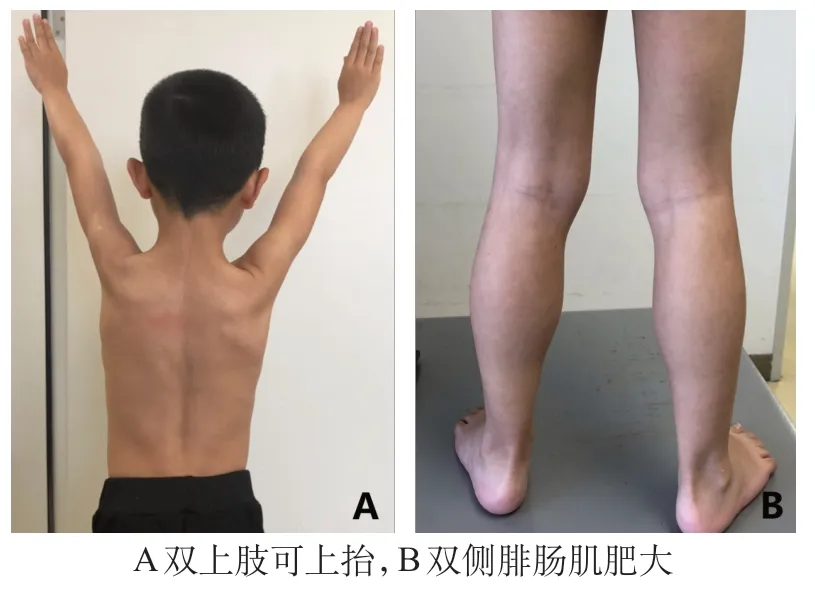
图1 患儿肢体表现
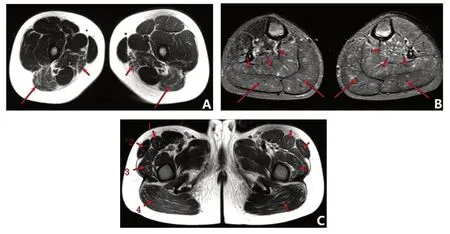
图2 患儿肌肉MRI 表现
为明确病因,经南京医科大学附属儿童医院伦理委员会批准,患儿监护人知情同意,采集患儿及父母外周血各2 mL,送至武汉康圣达医学检验所。首先进行DMD基因多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)检测,结果阴性。进一步行全外显子测序,并采用Sanger测序法进行位点验证及家系验证。结果发现,患儿SGCA基因c.234-235AC>GA纯合突变,该位点目前暂无报道。Mutation Taster预测为A(评分1.0)。参考美国医学遗传学与基因组学学会(ACMG)基因突变解读指南,该位点评级定为致病性。Sanger测序结果显示,父母均为杂合携带者,患儿为纯合突变(图3)。结合患儿临床症状及辅助检查,最终诊断为LGMD2D。
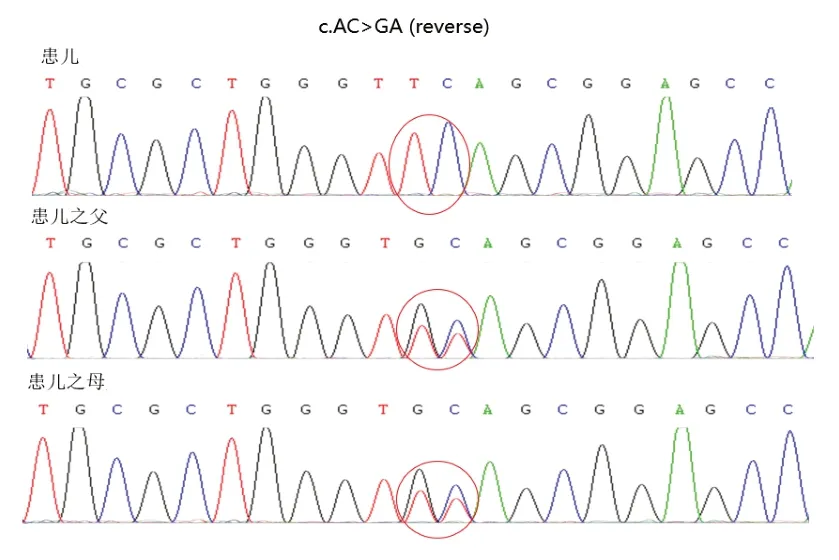
图3 Sanger 测序图
2 讨论
LGMD2D与LGMD2C、2E、2F亚型一起统称为肌聚糖病,分别编码α、γ、β、δ-肌聚糖,肌聚糖α、γ、β、δ 4 个亚单位紧密连接,参与抗肌萎缩蛋白-糖蛋白复合物的构成[2],维持肌肉细胞膜的稳定性。LGMD2D为最常见的肌聚糖病,由SGCA基因突变引起。SCGA基因位于染色体17q21,包含10个外显子,编码387个氨基酸的蛋白质。该基因主要表达在骨骼肌,心肌也有少量表达。SGCA基因突变导致部分或全部的聚糖缺陷,甚至累及肌萎缩蛋白-糖蛋白复合物功能[3],引起肌肉细胞坏死,出现肌无力、肌肉萎缩等临床症状。LGMD2D的临床症状并无特异性,且个体差异大,具有显著的临床和遗传异质性,发病年龄和病情严重程度不同[4],即使同一家族中相同的基因突变,临床症状也会从轻微到严重,严重程度取决于α-肌聚糖蛋白表达水平[5]。有患者仅表现为运动不耐受和横纹肌溶解,或以运动后诱发肌痛和肌红蛋白尿为首发症状[6-7];大部分患儿表现为肢体肌肉和骨盆肌肉无力、萎缩,心肌受累少见[8]。由于肌肉代谢紊乱或肌细胞膜通透性增加,肌酶明显增高。LGMD2D发病率在不同种族差异较大。
本例患儿为男性,儿童期缓慢起病,临床表现为进行性肌无力,以双下肢近端为主,有双侧腓肠肌肥大、Gower 征阳性,CK 显著增高,肌电图提示肌源性损害,肌肉MRI 可见多组肌肉受累,临床表现上与假肥大型肌营养不良症类似。结合患儿性别,首诊时怀疑假肥大型肌营养不良症,首先行DMD基因MLPA 检测未发现异常,进一步全外显子测序发现SGCA基因c.234-235AC>GA纯合突变,最终确诊为LGMD2D。进一步查阅文献发现LGMD 2 D、2 C、2 E、2 F 均可以出现肌酶明显升高,机制相似,临床症状不易与假肥大型肌营养不良症区分,尤其是对于少部分合并腓肠肌肥大的患者。肌酶增高的程度和肌肉MRI 改变可能在鉴别诊断时提供一定帮助。假肥大型肌营养不良症AST/CK/LDH均明显高于LGMD[9];CK在假肥大型肌营养不良症中可达到正常值的25~200 倍,而在LGMD中为正常值的1~80倍[10]。在肌肉MRI表现上假肥大型肌营养不良症臀大肌受影响最大,其次是小腿肌肉;而LGMD2D受影响最大和最早的是大腿内收肌、臀肌和大腿后侧组,其次是小骨盆和闭孔肌、股二头肌长头、股中肌、近端股外侧肌和内侧肌以及其他大腿后侧肌,即使在疾病晚期,小腿肌受累也很轻微[11],这种渐进性的肌肉受累顺序可能构成了典型的LGMD 2 D-F“肌肉受累模式”。另外股四头肌的保留似乎对LGMD 2 C-2 F 非常特异,有助于区分其他LGMD 亚型或假肥大型肌营养不良症。以上这些均有可能为我们从影像学上提供一定的线索,根据肌肉MRI受累的顺序和严重程度,在基因检测前作出初步诊断。基因检测是诊断肌营养不良症各型的金标准,假肥大型肌营养不良症最多见的是DMD基因外显子缺失。DMD基因点突变相对少,检查策略上首先进行DMD基因MLPA检测外显子缺失或重复,无阳性发现时进一步点突变检测。本例患儿基因检测结果提示,进一步点突变检测时应注意同时检测LGM2C-F致病基因,基因Pannel或全外显子测序可以提供帮助。
LGMD 2 D 由SGCA基因突变引起,目前已报道近80 种不同的SGCA突变,最常见是SGCA第3 外显子229位CGC>TGC错义突变[12]。本例患儿发现既往未报道的SGCA基因第3 个外显子存在点突变(c.234-235AC>GA),导致该基因编码的第78位密码子从酪氨酸突变为终止密码子,使得蛋白的翻译提前终止,造成蛋白功能缺失。该位点在HGMD 专业版数据库中无收录,Clinvar 数据库中无收录且位点的人群频率(ESP 6500、1000 g 和EXAC_ALL 的最大值)及在gnomAD数据库的东亚人群中也均无收录。ACMG分级评定为致病性突变。本例患儿此位点为纯合突变,其父母均为杂合突变,突变分别来自父母,符合疾病的常染色体隐性遗传规律。SGCAc.234-235AC>GA(p.Y78X)点突变,扩展了SGCA的突变谱。
目前LGMD 2 D 尚无有效治疗方法,主要是对症治疗及康复训练,以改善症状、延缓病情。干细胞移植和基因治疗尚在研究阶段,部分已在动物模型上取得一定疗效[13-14],将来有可能为此类患者带来治愈希望。
综上,目前LGMD从临床表现及免疫组化均难以区分各亚型,且部分LGMD临床上不易与假肥大型肌营养不良症鉴别,肌酶增高程度及肌肉MRI可能有一定的提示作用,肌肉活检为有创性检查,一般用于组织病理学和免疫标记研究而不能鉴别各型,只有基因检测才能做到精准诊断[15]。2015年美国神经病学学会和美国神经肌肉和电诊断医学协会发布的LGMD 患者诊断和管理指南,也强调通过基因检测来鉴定肌营养不良症亚型,可见基因检测在LGMD患者中的重要作用[16]。LGMD基因诊断的目标是指导个体化的患者管理,尤其是肺和心脏并发症。因此临床上遇到疑似患儿,应尽早行基因检测以便精确诊断,及时干预和管理,必要时提供遗传咨询。

