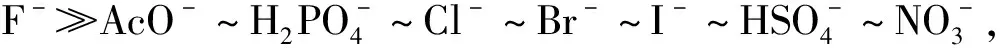一种新型识别F-的硝基脲酰肼荧光化学传感器
李 丹,闫 冰,黄苇苇
(燕山大学 环境与化学工程学院,河北 秦皇岛 066004)
0 引言
阴离子在自然界普遍存在[1-6]。在生物体中,遗传信息DNA的载体是阴离子,大多数酶底物和辅因子(例如5′-三磷酸腺苷,简称ATP)也是阴离子。在卤化物中,氯离子广泛存在于细胞外液中,一旦调节不当便会引发系列疾病,如囊性纤维化[7];碘离子是合成甲状腺激素的必要物质[8];碳酸氢根的存在对于维持体内pH值是非常重要的。尤其是氟离子的检测意义重大,因为它是人体骨骼和牙齿成型所必需的微量元素之一[9-10],但过量摄入氟离子会引起诸如骨质疏松症、胶原蛋白降解等许多问题,被统称为氟中毒病[11-12]。由此可见,氟离子对人体是否有益直接依赖于它的浓度。根据世界卫生组织(WHO)的规定,饮用水中氟离子的最高允许限值为1.5 mg/L。因此,设计具有选择性识别特定阴离子的受体分子吸引了越来越多的科研人员的关注。
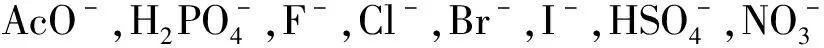
1 受体分子1的合成
1.1 实验材料和仪器
除特别指明外,所用试剂均为市售分析纯,使用之前未做纯化处理。另外,实验中用来配制溶液及清洗仪器所用的水均为蒸馏水。二甲基亚砜(DMSO)使用之前加入少许氧化钙(CaO),室温干燥24 h后,减压蒸馏得到。乙醇使用之前经金属镁条处理,然后蒸馏后得到。四丁基铵盐阴离子使用前用干燥剂五氧化二磷(P2O5)在60 ℃下真空干燥24 h。
本实验过程中所用到的实验仪器主要有XT-4熔点仪(北京泰克仪器有限公司);DHG-101-3A电热恒温鼓风干燥箱(郑州予华仪器制造有限公司);RF-02B旋转蒸发仪(上海普渡生化科技有限公司);Aglient QQQ MS 6460质谱仪(安捷伦公司);UNITY-plus 400 MHz核磁共振波谱(美国Varian公司);FT-IR650红外波谱仪(天津港东仪器有限公司);VarioEL元素分析仪(德国赛明公司);Shimadzu UV2450紫外分光光度计(日本岛津公司);HITACHI F-7000荧光光谱仪(日本日立公司)等。
1.2 受体分子1的合成路线
受体分子1的合成路线如图1所示。参考文献[13-14]方法,在氯化氢气氛下,以蒽为原料与低聚甲醛在1,4-二氧六环中反应得到中间体9,10-二氯甲基蒽M1。M1进一步氧化得到蒽-9,10-二醛M2。以三光气为原料与邻硝基苯胺在乙酸乙酯中反应得到中间体邻硝基异氰酸酯。邻硝基异氰酸酯和水合肼进一步反应得到中间体邻硝基苯基氨基脲M3。M2与M3在乙醇中加热回流得到受体1。
图1 受体1的合成路线
Fig.1 The synthesis route of1
1.3 受体分子1的合成
在加热回流的条件下,将0.234 g M2溶于适量的绝对乙醇中,向该溶液中缓慢滴加0.424 g M3的乙醇溶液。滴完后,滴加几滴冰乙酸,有红色沉淀生成,继续回流2 h。过滤,用热乙醇洗涤,干燥称得橙色固体受体分子1为0.452 g,产率为84 %,m.p.:314~316 ℃。1H NMR(400 MHz,DMSO-d6)δH:7.24(t,2H,Anthracene-H),7.77(d,4H,Anthracene-H),8.17(s,2H,Anthracene-H),8.65(s,4H,Ar-H),8.98(s,2H,Ar-H),9.22(s,2H,C-H),10.88(s,2H,N-H),11.51(s,2H,C-H),11.64(s,2H,N-H);([M+H]+):591.2;C30H22N8O6的元素分析,理论计算值:C,61.01;H,3.75;N,18.97;检测值:C,60.88;H,3.66;N,18.83;IR(KBr):3 435 cm-1:νN-H,3 121 cm-1:νC-H,2 976 cm-1:νC-H,1 711 cm-1:νC=O,1 507 cm-1:νC=N,1 345 cm-1:δC-H,738 cm-1:δAr-H。
2 结果与讨论
2.1 受体分子1与阴离子的紫外-可见光谱分析
图2 受体1加入不同阴离子的UV-vis光谱变化
Fig.2 The UV-vis spectra of different anions for acceptor molecule1
图3 向受体1的DMSO溶液分别加入不同阴离子引起溶液颜色的变化
Fig.3 Color changes of receptor1in DMSO in absence and presence of anions
接着利用紫外吸收方法研究了298 K下,在DMSO溶液中受体分子和F-之间的相互作用。如图4所示,受体分子1(2×10-5M)在275 nm,425 nm处有两个明显的主吸收峰。随着F-的不断加入,275 nm,425 nm处的吸收强度逐渐降低,并且在525 nm处出现一个新的吸收峰,同时在525 nm,325 nm处的吸收强度慢慢增强。这是由于受体分子1中的识别位点-NH本身是弱的电子供体,当F-加入后,F-与受体分子1之间通过氢键结合,使-NH上的电子密度增大,供电子能力增强,这时候,电子在分子内迅速转移到与之相邻的苯环上,使得受体分子1在525 nm吸收峰出现了红移的现象。同时,受体分子1溶液的颜色由浅黄色变为深紫色。此外,从图4还可以清楚地看到在280 nm、355 nm和455 nm处有3个等吸收点。这说明在滴定过程中,1与F-之间形成了具有确定计量比的主客体络合物[15]。
图4 受体1滴定F-的吸收光谱变化
Fig.4 UV-vis spectra changes of solution1upon addition of F-in DMSO
2.2 受体分子1与阴离子的荧光光谱分析
图5为当激发波长λex=400 nm时,在DMSO溶液中,加入F-后,对受体分子1(2×10-5M)的荧光光谱产生的影响。当没有加入F-时,受体分子1表现出较弱的荧光强度,随着F-的不断加入,525 nm处的荧光强度显著增强。这可能是由于受体1与F-结合后,形成的受体与阴离子络合物刚性增加,一方面通过分子运动引起的损失减少,荧光量子产率提高;另一方面分子共面性增加,有利于Frank-Condom跃迁的实现,荧光强度增强。由图5插图还可以看到在紫外灯365 nm的激发下受体1溶液以及1与F-相互作用的荧光照片,可以明显的看出荧光强度增加。
图5 受体1滴定F-的荧光光谱变化
Fig.5 Fluorescence emission changes of receptor1upon the addition of F-
2.3 受体分子1与阴离子的1H NMR滴定分析
采用核磁滴定的方法进一步探究受体分子1识别F-的机理,研究了加入F-前后受体分子1(1.0×10-2M)在DMSO-d6中的质子位移的变化。从图6可以看出,出现在11.64 ppm和10.88 ppm是受体上-NH的质子峰,分别标记为Ha和Hb。当加入0.4摩尔当量的F-时,Ha 和Hb质子峰的信号开始减弱,同时苯环上的-H也略微向高场移动。这是由于1与F-结合后使脲上的-NH的电荷密度增大,同时由于苯环的拉电子效应,促进受体分子内的电子从脲上的-NH向苯环移动,使苯环上的电子密度增大,苯环上氢原子的化学位移向高场移动,这样可以推断受体和F-形成了氢键。随着F-浓度的增大,Ha信号比Hb的信号变化的要明显,最终接近消失,这可能是由于Ha所连接的苯环具有的拉电子效应,使Ha比Hb活泼更易离去,发生去质子化过程。
图6 向受体1加入F-的氢谱图
Fig.61H NMR of adding F-to receptor1in DMSO-d6
2.4 受体分子1与阴离子的结合常数
选取波长为527 nm处的荧光数据进行计算拟合,得到受体分子1与F-的Hill方程为Y=2.019 1X+5.202 6,其中Hill系数为n=2.019 1(n≈2),说明受体1与F-的结合比为1∶2,结合常数lgKass为5.20,见图7。
图7 受体1的荧光强度在525 nm(F525)与不断变化的log[A]的Hill方程
Fig.7 The fluorescence intensity of1at 525 nm(F525)and changing log[A]Hill equation
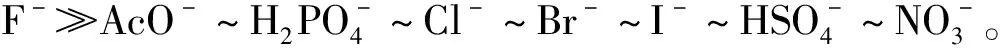
表1 受体1与不同阴离子的结合常数
Tab.1 Binding constants of receptor1with different anions

阴离子lgKassaF-5.20AcO-NDbH2PO-4NDbCl-NDbBr-NDbI-NDbHSO-4NDbNO-3NDb
注:a由荧光光谱数据计算得出;bND光谱变化太小未得到结合常数。
根据以上的实验结果,推测受体分子1与F-的结合方式为图8所示。
图8 受体1与F-在溶液中可能的结合模式
Fig.8 Possible binding modes of receptor1and F-in solution
3 结论