基于ESIPT机理检测Al3+荧光探针分子结构和电子光谱的理论研究
石 英,孙朝范,曹必发,李 尤,尹 航
(吉林大学原子与分子物理研究所,长春 130012)
1 引言
众所周知,铝是地壳中含量最丰富的金属元素,广泛应用于日常生活、无线制造、航空航天等领域[1,2].同时,铝也是对人体健康危害最大的金属元素之一,其可以损伤人体中枢神经系统、骨细胞、造血和抗氧化系统[3].因此,建立一种灵敏、高效的Al3+离子检测方法具有重要的现实意义.
荧光探针技术作为一种有效、简便的金属离子鉴别方法,已广泛应用于生物化学、医学等领域[4].其中,具有激发态分子内质子转移(ESIPT)特性的3 -羟基黄酮(3HF)衍生物已被用作有效检测Al3+离子的荧光探针分子[5,6].Xu 等人[5]设计并合成了一种黄酮类荧光探针分子3 -羟基-3' -甲酰基黄酮(3HFF),以获得DMSO-H2O溶液中HSO3-和Al3+离子的高度选择性接力识别,结果表明HSO3-离子对溶液中Al3+离子的检测至关重要.此外,Wang等人[6]在发现吸电子取代基可以阻止激发态电荷转移引起的互变异构现象的基础上,合成了1 -(4' -甲基-3 -羟基黄酮)碳酸酯(FA)荧光传感器.
此外,除了3HF及其衍生物作为荧光探针的研究外,其ESIPT特性也引起了研究人员的广泛关注[7,8].Ameer-Beg等人[9]采用瞬态吸收光谱法研究了3HF及其4' -取代衍生物的ESIPT性质,结果表明,在乙醇溶剂中较强的溶质-溶剂相互作用会抑制ESIPT过程的发生.此外,Jiang等人[10]采用密度泛函理论(DFT)和含时密度泛函理论(TD-DFT)方法研究了3HF在甲基环己烷溶剂中的ESIPT过程,结果表明激发态质子转移是由分子内电荷转移引起的氢键增强所致.
考虑到3HF独特的荧光探针和ESIPT特性,在本文工作中,我们在3HF的结构中分别引入了吸电子基团氰基和给电子基团氨基,设计了两种新型荧光探针分子(3HF-CY和3HF-AM),其分子结构如图1 所示.利用DFT和TD-DFT方法,系统地计算了与ESIPT过程相关的参数,包括S0和S1态的键长、键角和势能曲线.此外,也计算得到了单独分子和分子@Al3+复合物的吸收和荧光特性,以研究3HF及其衍生物对Al3+离子的检测灵敏度.
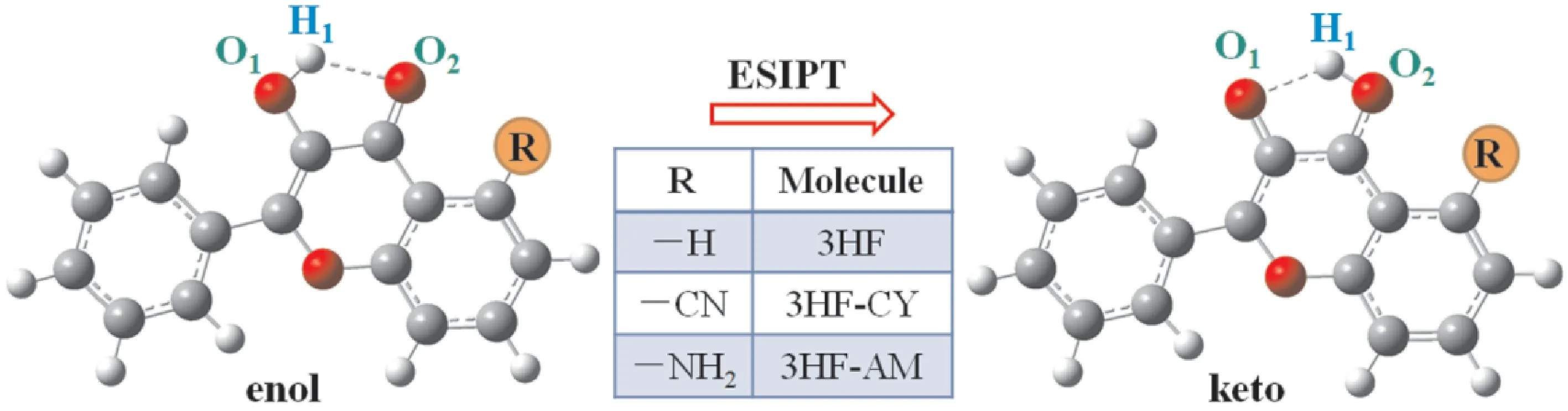
图1 3HF及其衍生物在Enol和Keto构型的分子结构Fig.1 Molecular structures of 3HF and its derivatives at enol and keto forms.
2 计算方法
本文采用DFT[11,12]方法,结合B3LYP[13,14]泛函和6 -31G(d)基组优化了所研究分子的基态结构.基于优化的基态构型,采用TD-DFT[15]方法结合6 -31G(d)基组模拟了分子的吸收光谱.利用积分连续介质模型(IEFPCM)考虑了水的溶剂效应[16,17].考虑到所选泛函的可靠性,采用不同泛函(包括B3LYP、Cam -B3LYP[18]、mPW1PW91[19]、PBEPBE[20]、ωB97XD[21]和M062X[22])模拟了3HF的吸收光谱,得到的吸收峰列于表1 中.如表1 所示,可以发现由B3LYP泛函计算得到的吸收峰与已报道的数值最为一致[6].基于此,利用B3LYP泛函计算了所有分子的吸收光谱性质.此外,利用TD-DFT方法优化了分子的激发态结构,并依据优化后的激发态结构计算了分子的荧光特性.为了研究分子的ESIPT性质,计算得到了与分子内氢键相关的键长和键角以及在S0态和S1态的势能曲线.同时,计算了3HF及其衍生物与Al3+离子复合物的吸收和荧光性质.所有的计算工作都是通过Gaussian 软件完成的[23].

表1 利用不同泛函和6 -31G(d)基组理论计算得到的3HF在水中的吸收峰Table 1 Calculated absorption peaks of 3HF in aqueous solution by using different functionals at 6 -31G(d)basis set
3 结果与讨论
3.1 基态和激发态分子内氢键
计算得到的3HF及其衍生物在S0态和S1态时烯醇式(Enol)和酮式(Keto)构型的分子内氢键键长和键角列于表2.如表所示,对于3HF的Enol构型,O1-H1的长度从S0态的0.987 Å增长到S1态的1.013 Å,H1…O2的长度从S0态的1.951 Å缩短到S1态的1.787 Å.此外,键角δ(O1-H1…O2)从S0态的121°增大到S1态的126°.以上结果表明,O1-H1…O2在S1态比在S0态更稳定,这有利于ESIPT过程的发生[24].对于3HF-CY和3HFAM的Enol构型,除了3HF-AM的H1…O2外,键长和键角的变化趋势与3HF相似,这也表明3HF-CY和3HF-AM的O1-H1…O2在S1态比在S0态更稳定,同样促进了ESIPT过程的发生.

表2 3HF及其衍生物分子Enol和Keto构型在S0和S1态的键长和键角Table 2 Bond lengths(Å)and bond angles(°)of the 3HF and its derivatives molecules at enol and keto forms in S0and S1states
同时,对于3HF的Keto构型,O1…H1的长度从S1态的2.000 Å缩短到S0态的1.806 Å,H1-O2的长度从S1态的0.987 Å延长到S0态的1.009 Å.此外,键角δ(O1…H1-O2)从S1态的118°增加到S0态的125°.上述结果表明,O1…H1-O2在S0态比S1态更稳定,这有利于基态的质子回转[25].与3HF类似,3HF-CY和3HF-AM在Keto构型的键长和键角也有相同的变化趋势,表明3HF-CY和3HF-AM的Keto构型在S0态比在S1态更稳定.
3.2 势能曲线
通过逐渐延长O1-H1键长,扫描得到了3HF及其衍生物在S0态和S1态的势能曲线,如图2 所示,3HF、3HF-CY和3HF-AM在S0态的能垒分别为12.060 Kcal/mol、13.009 Kcal/mol和13.097 Kcal/mol,均大于在S1态的能垒(3HF、3HF-CY和3HF-AM分别为2.305 Kcal/mol、3.790 Kcal/mol和7.575 Kcal/mol).以上结果表明,三个分子在光激发下倾向于发生ESIPT过程,这与S1态分子内氢键的增强有关.另外,3HFCY和3HF-AM在S0态和S1态的能垒比3HF大,说明引入氰基或氨基会抑制质子在基态或激发态的转移.
3.3 吸收和荧光光谱
图3a展示了模拟得到的3HF及其衍生物在水中的吸收光谱,表3 列出了相应的吸收峰和振子强度.如图3a所示,3HF及其衍生物的吸收光谱主要集中在250 nm -500 nm之间.从表3 可以看出,3HF的最大吸收峰位于350.21 nm,与已报道的结果一致[26].3HF-CY在387.81 nm处出现最大吸收峰,与3HF相比红移37.60 nm.结果表明,在3HF中引入吸电子基团氰基可以促进其吸收光谱的红移.而3HF-AM的最大吸收峰(317.69 nm)与3HF相比出现了32.52 nm的蓝移,说明在3HF中引入给电子基团氨基会导致其吸收光谱发生蓝移.
此外,从表3 可以发现,3HF、3HF-CY和3HF-AM的最大吸收峰分别对应于S1、S1 和S2态,这分别源于电子从HOMO→LUMO、HOMO→LUMO和HOMO-1→LUMO的跃迁.上述前线分子轨道的电荷密度分布见图4.如图所示,上述激发态来自分子内电荷转移(ICT).值得注意的是,当ICT现象发生时,羰基氧原子上的电荷密度增多,相邻羟基氧原子上的电荷密度减少,说明ICT过程促进了ESIPT反应的进行[27].
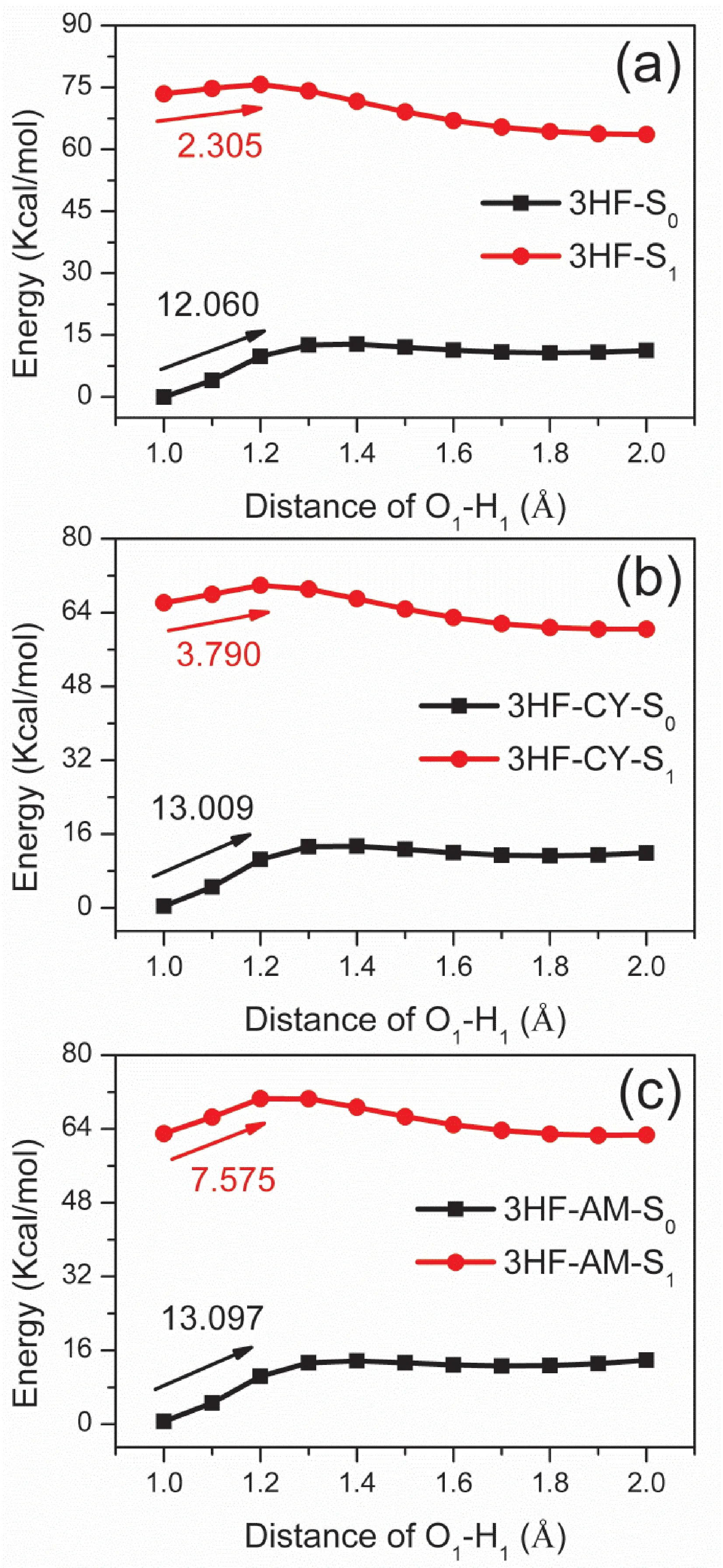
图2 3HF及其衍生物分子在S0和S1态时的势能曲线Fig.2 Potential energy curves for the 3HF and its derivatives molecules at S0and S1states.
基于优化的激发态结构,分别获得了3HF、3HF-CY和3HF-AM在Enol和Keto构型的荧光光谱,见图3b和图3c.此外,表4 列出了对应的荧光峰以及振子强度.由表中数据可以看出,3HF的Enol构型荧光峰位于396.33 nm处,与已报道的结果一致[26],这也证明了所选方法的可靠性.与3HF相比,3HF-CY和3HF-AM的荧光峰分别蓝移了55.84 nm和107.52 nm.与吸收峰相比,3HF、3HF-CY和3HF-AM的荧光峰分别展现出46.12 nm、64.36 nm和186.16 nm的红移.此外,3HF、3HF-CY和3HF-AM在Keto构型的荧光峰分别为531.07 nm、563.92 nm和568.70 nm,与吸收峰相比分别红移180.86 nm、176.11 nm和251.01 nm.
3.4 分子@Al3+复合物的吸收和荧光光谱
根据已报道的工作[28],荧光探针分子的羟基与水中的Al3+离子通过配位发生反应.鉴于此,对分子@Al3+复合物的基态构型进行了优化,并模拟得到了复合物的吸收光谱,见图5a.如图所示,3HF@Al3+复合物的吸收峰位于400.53 nm处,与实验结果一致[5],证明了所选计算方法的可靠性.3HF-CY@Al3+复合物和3HF-AM@Al3+复合物的吸收峰分别出现在426.12 nm和405.23 nm处,与3HF@Al3+复合物的吸收峰相比,分别出现了25.59 nm和4.70 nm的红移.
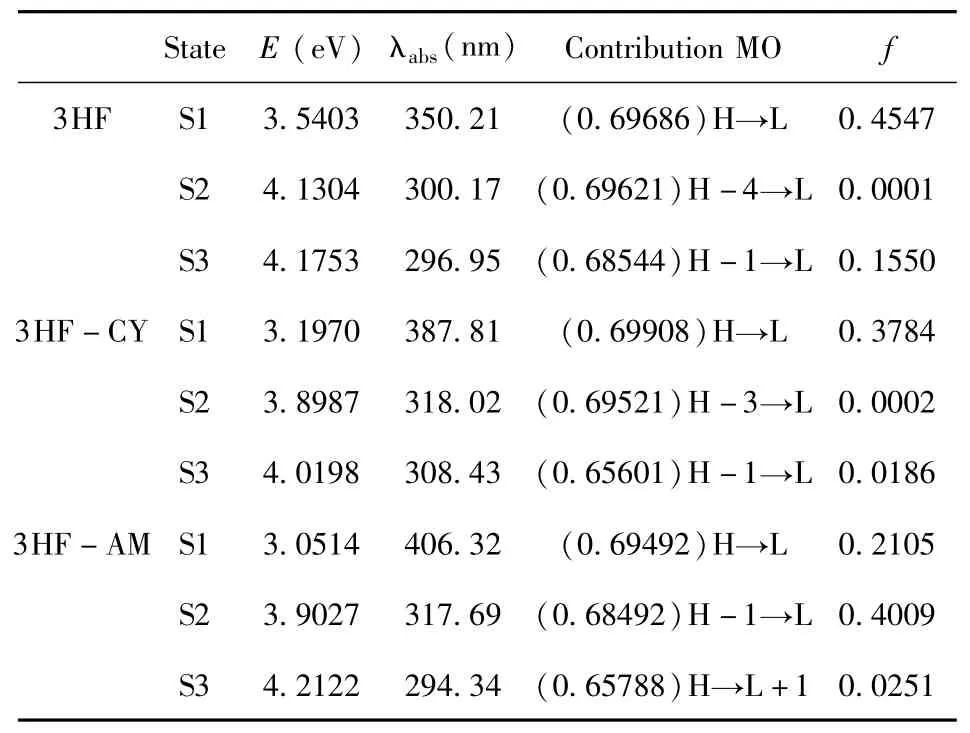
表3 利用TD-DFT/B3LYP/6 -31G(d)方法计算得到的3HF及其衍生物分子在水中的跃迁性质Table 3 Calculated transition properties of the 3HF and its derivatives molecules in aqueous solution by using TD-DFT/B3LYP/6 -31G(d)method
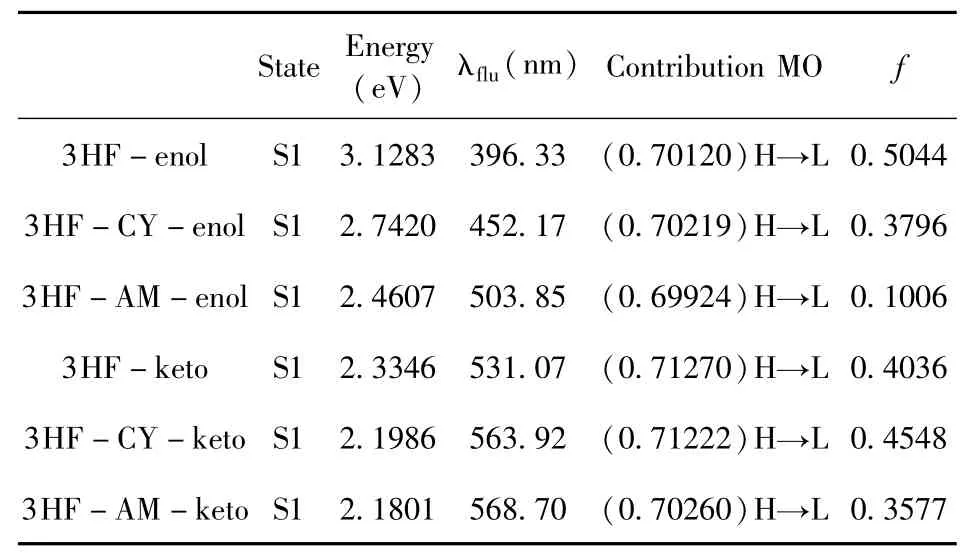
表4 利用TD-DFT/B3LYP/6 -31G(d)方法计算得到的3HF及其衍生物分子在Enol和Keto构型下的荧光性质Table 4 Calculated fluorescence properties of the 3HF and its derivatives molecules at enol and keto forms in aqueous solution by using TD-DFT/B3LYP/6 -31G(d)method
此外,模拟得到的分子@Al3+复合物的荧光光谱如图5b 所示,3HF@Al3+复合物的荧光峰位于424.98 nm处,与实验结果一致[5].3HF-CY@Al3+复合物和3HF-AM@Al3+复合物的荧光峰分别在465.71 nm和427.97 nm处,与单独分子在Enol构型时的荧光峰相比,3HF@Al3+复合物和3HF-CY@Al3+复合物分别红移了28.65 nm和13.54 nm,而3HF-AM@Al3+复合物的荧光峰从503.85 nm向427.97 nm发生了75.88 nm的蓝移.由此看出,在光激发下3HF-AM与水中的Al3+反应后,溶液荧光会由绿色转变为紫色,表明3HF-AM分子可以作为有效检测水中Al3+的荧光探针.

图4 3HF及其衍生物分子在水中的前线分子轨道图Fig.4 The frontier molecular orbitals for the 3HF and its derivatives molecules in aqueous solution.
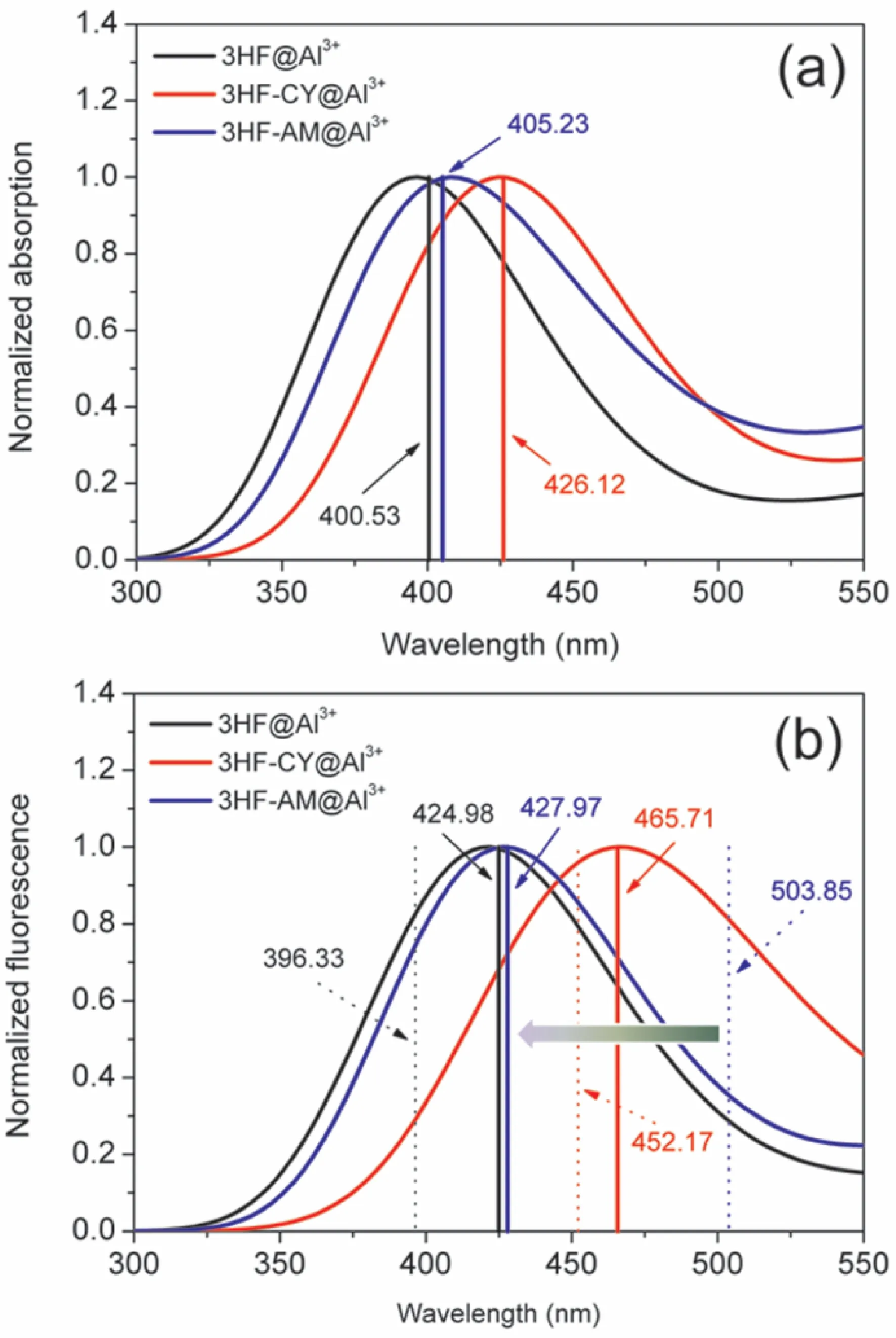
图5 3HF及其衍生物分子@Al3+复合物的归一化(a)吸收和(b)荧光光谱(虚线代表单独分子在Enol构型的荧光峰位置)Fig.5 Normalized(a)absorption and(b)fluorescence spectra of the studied molecules toward Al3+ion in aqueous solution,in which the dotted line represents the fluorescence peak of the 3HF and its derivatives molecules at enol forms.
4 结论
本工作中,利用DFT和TD-DFT方法研究了3 -HF及其两种衍生物(3HF-CY和3HFAM)作为荧光探针分子检测水中Al3+离子的分子结构和电子光谱性质.结果表明,3 -HF及其衍生物在光激发下均易发生ESIPT过程,这源于激发态分子内氢键强度的增强.但是与3HF相比,氰基或氨基的引入会抑制其质子转移过程.模拟的吸收光谱表明,吸电子基团氰基的引入会导致吸收光谱发生红移,而给电子基团氨基的引入则会引起蓝移现象.并且,从单体分子和与Al3+形成复合物的荧光光谱推断出,在光激发下3HFAM与水中的Al3+反应后的溶液荧光会由绿色转变为紫色,意味着3HF-AM分子可以作为有效检测水中Al3+的荧光探针分子.

