石墨烯生物毒性的计算机模拟研究进展
周梦迪,沈嘉炜,梁立军,李嘉辰,金乐红,王琦
(1 杭州师范大学医学院,浙江杭州311121; 2 杭州电子科技大学自动化学院,浙江杭州310018; 3 浙江大学化学系,浙江杭州310027)
引 言
近年来,随着纳米技术的发展,纳米粒子被广泛用于许多研究领域,例如在生物医学领域,纳米粒子可用于医学成像[1]、生物传感[2-4]、药物的靶向运输[5-6]以及癌症的同步诊断和治疗[7-9]等。同时,纳米粒子也已经用于电子元件、涂料、运动器材、化妆品、食品添加剂等许多商业产品[10]。纳米粒子在一维尺度上长度小于100 nm,尺寸很小,容易通过皮肤吸收并被体液携带,进而到达活细胞,穿透细胞膜或在人体累积,从而诱导细胞损伤甚至凋亡。在进入人体和细胞的过程中,纳米材料可能会与蛋白质、脂质或核酸等生物大分子相互作用[11-13],从而导致生物大分子的失活,诱导或产生生物毒性。由于石墨烯在工业上的应用越来越多[14-15],是目前发现的最薄、强度最大、导电导热性能最好的一种纳米材料,因而被称作“黑金”,近年来更被誉为是“新材料之王”。这种典型的二维材料的生物安全性及其在生物医疗方面的应用也越来越受到关注[16-18]。
石墨烯(graphene,GRA)是一种由平整的单层碳原子密集堆积成二维蜂窝晶格的碳纳米材料,可被视为富勒烯、碳纳米管和石墨的基本组成部分[19-21]。氧化石墨烯(graphene oxide,GO)是石墨烯的氧化物,经过氧化处理后,氧化石墨烯仍保持石墨的层状结构,但在每一层的石墨烯单片上引入了许多氧基官能团。这些氧基官能团的引入使得单一的石墨烯结构变得非常复杂。这类物质粒径很小,容易进入生物体,与组织、细胞、细胞器和蛋白质等相互作用,导致组织或细胞的功能紊乱[22]。石墨烯由于其独特的结构、电子特性等已被应用于潜在的生物治疗中[23]。虽然石墨烯已被证明是疾病诊断和治疗的良好候选材料,但人们对石墨烯与生物系统相互作用所产生的生物效应和相应的机制的认识仍然有限。近年来有关石墨烯与生物大分子之间的研究越来越引起关注,例如,计算机模拟研究和实验研究都表明石墨烯可以吸附蛋白质使蛋白质结构发生改变,穿透细胞膜从而吸附细胞膜上的磷脂,吸附DNA破坏DNA的碱基对等[24-26]。
分子动力学模拟(molecular dynamic simulation,MD)自1966 年起发展至今已有五十余年,随着计算方法学的不断提升和计算机计算能力的飞速发展,近年来分子动力学模拟技术已不断地渗透到生物、化学、制药等相关领域并在其中得到广泛应用,目前已成为除理论分析和实验研究以外的第三种分析手段[27-29]。分子动力学模拟作为一种强大的工具不仅能得到原子的运动轨迹,还能像实验一样进行各种观察,特别是在实际实验中无法获得的与原子有关的微观细节,在分子动力学模拟中都能方便地进行观察。相比于实验,利用分子动力学模拟研究化学或生物问题具有以下一些优点:(1)成本较低;(2)降低实验事故发生率,安全性高;(3)有助于更好地理解和获取一些实验上难以得到的分子级别的结构和动力学数据,有效地补充实验数据。因此本文综述了近年来计算机模拟技术,尤其是分子动力学模拟方法在研究石墨烯、氧化石墨烯、石墨烯量子点等纳米材料与细胞膜、蛋白质、DNA 等生物大分子相互作用及其潜在的生物毒性的进展。
1 石墨烯和细胞膜的相互作用
纳米材料能够进入细胞并与细胞发生作用,主要是通过对跨膜过程和细胞分裂、增殖、凋亡等基本生命过程的影响和相关信号传导通路的调控,从而在细胞水平上产生一定的生物效应。最近关于石墨纳米材料如零维富勒烯[30-31]和一维碳纳米管[32-33]与细胞膜相互作用的研究表明,这些材料可以通过直接渗透[34-35](通常是小尺寸纳米颗粒的情况)或通过内吞作用进入细胞[33,36]。据报道,石墨烯具有细胞毒性作用,细胞内活性氧(ROS)的过量产生与其毒性有关[37-38]。一些实验研究也表明石墨烯具有毒性效应。比如Kloepfer 等[39]发现当石墨烯量子点的粒径小于5 nm 时,它可以直接进入大肠杆菌和枯草芽孢杆菌细胞内,并产生毒性效应;Hu 等[40]研究氧化石墨烯的加入对大肠杆菌的影响,发现氧化石墨烯可以切断大肠杆菌的细胞膜,并导致直接的物理膜损伤,从而造成细胞死亡;Liu 等[41]通过体外实验发现氧化石墨烯可以和脂质囊泡相互作用从而损伤细胞膜结构。还有一些团队发现石墨烯和氧化石墨烯对红细胞有溶血作用[42-44],这些溶血作用被证明和石墨烯对细胞膜的破坏作用有关[25,45]。
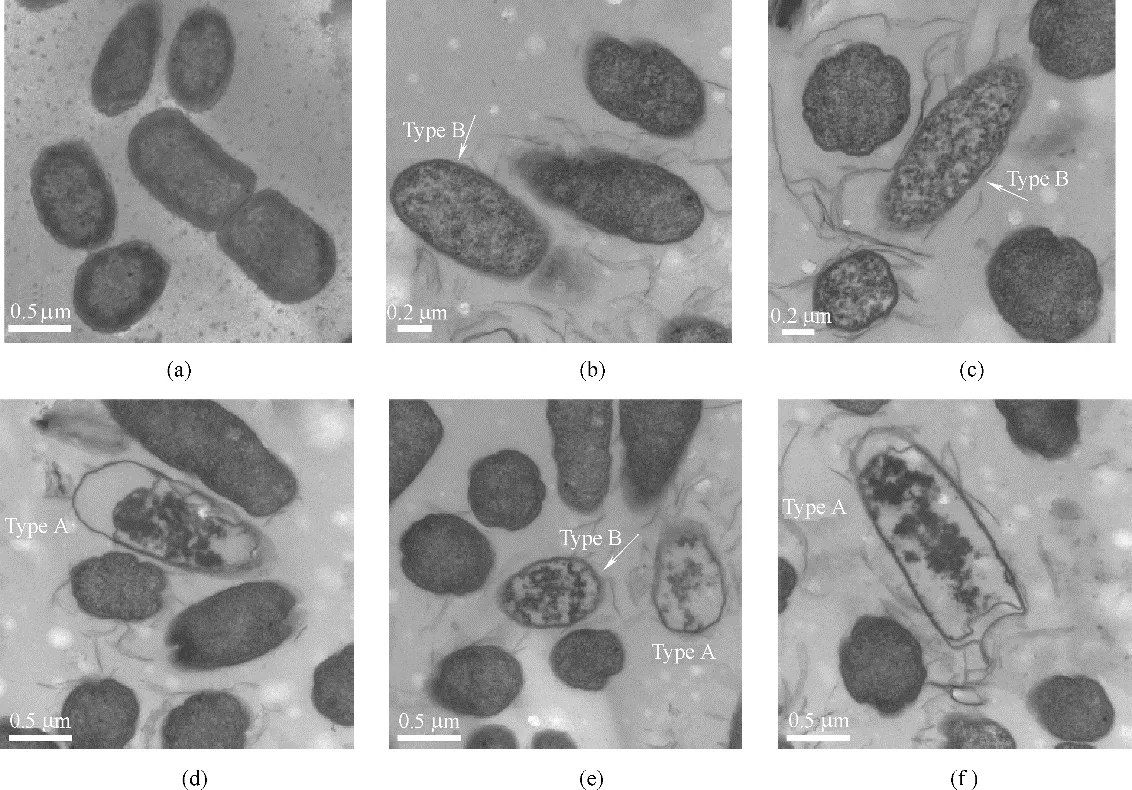
图1 氧化石墨烯作用下的大肠杆菌细胞膜形态学的变化[25]Fig.1 Morphology of Escherichia coil exposed to graphene oxide nanosheets[25]
1.1 石墨烯和大肠杆菌细胞膜相互作用
最近有研究发现石墨烯对大肠杆菌有强烈的抑菌作用,这种细胞毒性被认为是由石墨烯和细菌细胞膜之间的直接相互作用形成的物理损伤所引起的[46-49]。Tu 等[25]通过实验方法发现氧化石墨烯能够破坏大肠杆菌细胞膜的结构,如图1 所示。大肠杆菌细胞形态学变化历经三个阶段。第一阶段,大肠杆菌细胞膜保持初始结构[图1(a)]。第二阶段,大肠杆菌细胞膜部分受损,其中部分细胞膜表面具有较低的磷脂密度即稀疏脂质[如图1(b)、(c)中Type B所示]。第三阶段,发现大肠杆菌细胞失去了细胞完整性,其膜被严重破坏,有些甚至丧失了所有细胞质,即“空巢“[如图1(d)~(f)中的Type A 所示]。这些实验结果表明氧化石墨烯能够破坏细胞膜的结构从而对细胞产生一定的潜在毒性。Tu 等又采用分子动力学模拟技术发现石墨烯能吸附大肠杆菌细胞膜上的磷脂,从而破坏细胞膜的结构。他们发现石墨烯中所有的碳原子都是sp2杂化,由于这一特殊的二级结构,导致石墨烯和细胞膜磷脂之间存在非常强的疏水相互作用。在本次模拟中使用全原子脂质模型模拟大肠杆菌的细胞外膜和细胞内膜,如图2 所示,在石墨烯纳米片自发地进入细胞外膜和细胞内膜这一过程中观察到三种可区分的模式:第一,摆动模式(swing mode),石墨烯纳米片由其最初无偏的取向经过一次摆动,然后在受其约束的原子周围来回摆动,此过程持续一小段时间;第二,插入模式(insertion mode),石墨烯纳米片的尾端最终由于受到来自膜脂质的强范德华力(vdW)的吸引而被膜摄取和拉动;第三,摄取模式(extraction mode),石墨烯纳米片开始摄取细胞膜表面的磷脂分子,破坏细胞膜结构。为进一步研究石墨烯对大肠杆菌的细胞毒性机制,Tu等[25]将石墨烯放置在细胞膜上方,并观察石墨烯和细胞膜相互作用的过程(图3),结果表明石墨烯不但可以插入细胞膜从而进行物理切割,还可以通过疏水作用对细菌膜表面的脂质分子进行破坏性的抽取,进而杀死细菌。他们指出,正是由于石墨烯独特的二维结构使其可以与细菌细胞膜上的磷脂分子发生超强的相互作用,从而导致大量磷脂分子脱离细胞膜并吸附到石墨烯的表面。
1.2 石墨烯和哺乳动物细胞相互作用
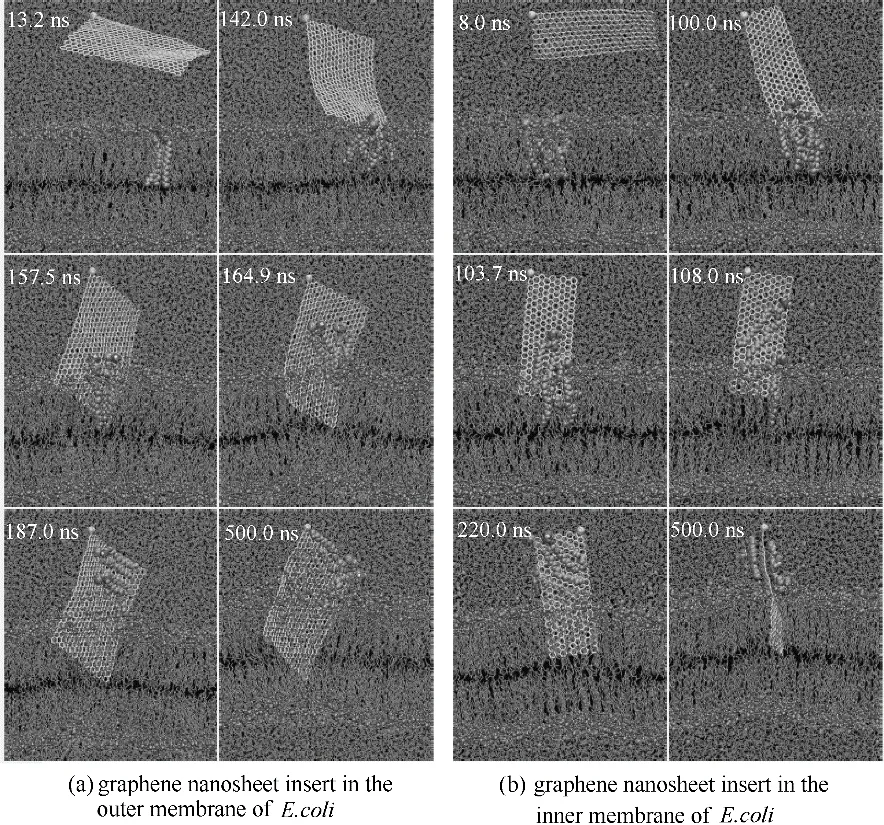
图2 石墨烯纳米片插入细胞膜的过程[25]Fig.2 Graphene nanosheets insertion and lipid extraction[25]
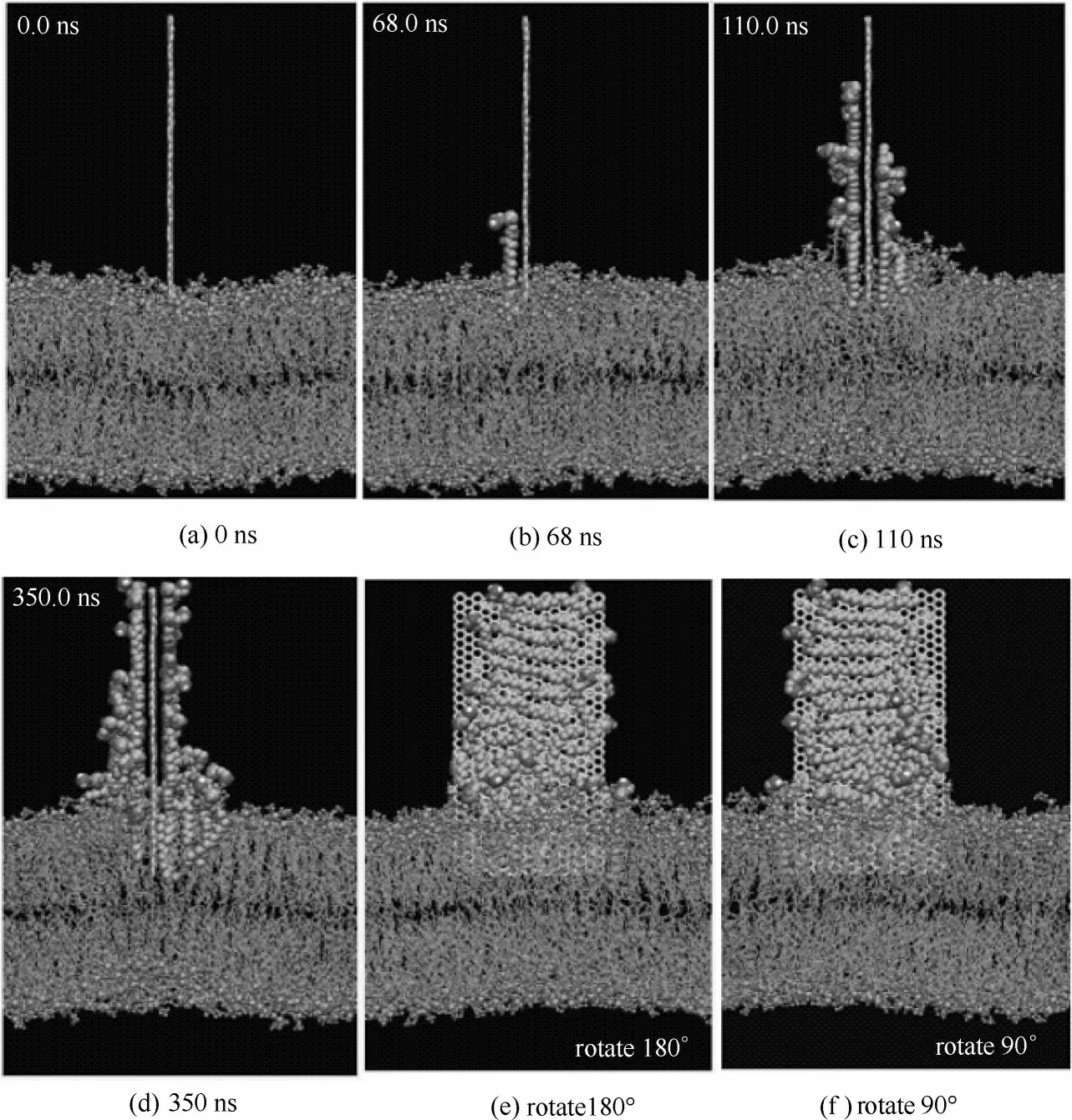
图3 石墨烯吸附磷脂分子的模拟过程[25]Fig.3 Lipids extraction by graphene in docking simulations[25]

图4 石墨烯和磷脂分子相互作用的过程[50]Fig.4 Interaction between grapheme and membranes[50]
石墨烯不仅能摄取细胞膜表面的磷脂分子,改变细胞膜的结构,还可以形成膜孔。Duan 等[50]通过分子动力学模拟方法发现石墨烯可以吸附细胞膜表面的磷脂,并形成水分子可以通过的膜孔,并通过实验加以证明。图4(a)表现的是两个平行的石墨烯片垂直插入细胞膜表面的磷脂双分子层的过程。图4(b)、(c)表明石墨烯片插入细胞膜后,吸收其表面的磷脂分子,并形成水分子孔道。随着模拟时间的延长,孔道中的水分子数量越来越多,吸附在石墨烯表面的磷脂分子也越来越多。因为石墨烯和疏水性的磷脂分子尾部之间存在强大的疏水作用,从而使得磷脂分子从细胞膜中脱离被吸附到石墨烯表面上,并导致细胞膜内部片段之间的负曲率增加。在90 ns 时,细胞膜失去其完整性,并在石墨烯的中心位置形成孔。
为了进一步说明膜孔形成的机制,Duan等又计算了石墨烯和细胞膜之间的范德华力(vdW),如图5(a)所示。模拟过程分为三个阶段,第一阶段,磷脂分子快速地吸附在石墨烯表面,导致石墨烯和细胞膜之间的vdW作用骤减,随着细胞膜进入亚稳态,该过程开始显著减慢;第二阶段,细胞膜内膜的张力和石墨烯介导的分开细胞膜的拉力大致平衡,从而使细胞膜的曲率保持在相对稳定的水平;第三阶段,热力学波动导致细胞膜张力最终屈服于石墨烯分散的拉力,导致石墨烯进一步提取脂质分子、膜孔形成以及vdW作用的又一次急剧下降。他们又通过计算磷原子的密度进一步说明膜孔形成的机制,如图5(b)所示。第一阶段,磷原子的密度沿整个轴线相对均匀分布,就如同未受干扰的细胞膜所预期的分布。然而,到50 ns时,可以看到密度分布形成了一个深谷,在深谷区域发现了磷原子密度最大程度地耗尽(第二阶段)。通过吸引纳米片相邻的脂质分子将该间隙区域中的脂质拉向石墨烯,进一步刺激提取过程。在第三阶段的开始,间隙区域中的脂质分子之间形成的网格消散并且在膜中形成孔。
石墨烯侵入细胞膜除了能吸附细胞膜表面的磷脂分子外,还可以通过尖角穿孔的方式进入细胞膜。Li等[43]使用全原子分子动力学模拟发现石墨烯的尖角最初被放置在穿过磷脂双分子层的角穿孔构型中,然后观察到石墨烯自发地向下移动,进一步穿透到磷脂双分子层中,如图6(a)所示。他们还计算了石墨烯尖角插入细胞膜过程中的能垒变化,如图6(b)显示石墨烯尖角穿透磷脂双分子层顶部亲水头部区域的能垒约为5kBT。在此后不久,由于磷脂分子的疏水性尾部和石墨烯之间的疏水作用致使总的能量开始减少。进一步的研究表明,与石墨烯角穿入磷脂双分子层相关的自由能变化可以用四个参数的简单数学模型来描述:hT(磷脂分子尾部的厚度),hH(磷脂分子头部的厚度),γH(磷脂分子头部基团和石墨烯表面之间的能量),γT(磷脂分子尾部和石墨烯表面之间的能量),如图6(c)所示。该模型预测,随着石墨烯穿透磷脂双分子层距离h的变化,能量在0 <h≤hH的范围内增加,并且在hH+ 2hT<h≤2hH+ 2hT和2hH+ 2hT<h的情况下减少。能垒计算公式为E=2(1-γH/γT)h2HγHtanα,其中α是石墨烯的半内角。当石墨烯的内角为45°时,预计穿孔的能垒约为7kBT,这和之前全原子模拟计算的石墨烯和细胞膜之间的能垒为5kBT非常接近。这些分析的数据都表明石墨烯可以通过尖角插入细胞膜,从而破坏细胞膜的结构。
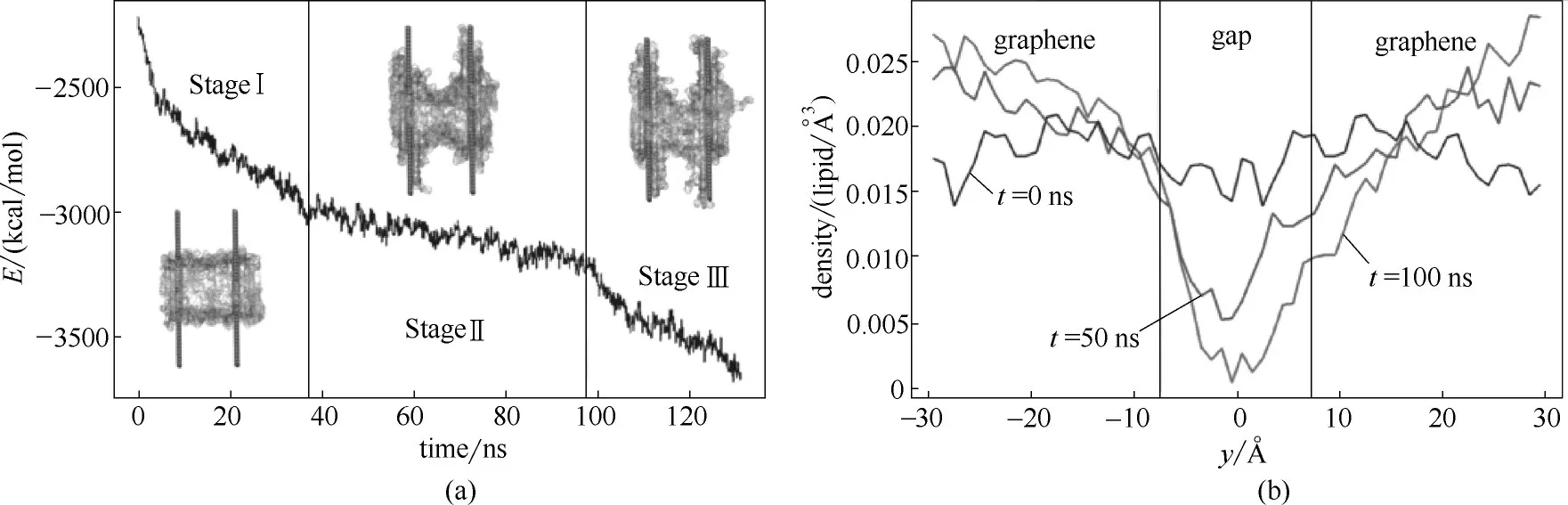
图5 石墨烯和细胞膜之间的范德华力(vdW)和磷原子的密度分布[50]Fig.5 (a)vdW energy profile for interactions between lipids and graphenes;(b)lipid density projected onto the y-axis at different stages of pore formation[50]
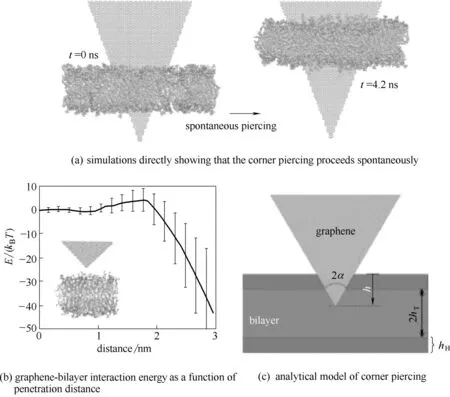
图6 石墨烯尖角通过细胞膜的全原子分子动力学模拟研究[43]Fig.6 All-atom molecular dynamical simulations of corner piercing of a monolayer graphene across a lipid bilayer[43]
1.3 石墨烯量子点和细胞膜的相互作用

图7 100 ns分子动力学模拟后不同浓度的GQD7穿越细胞膜的瞬时结构[55]Fig.7 Final structures and distribution of GQDs in lipid membrane at different concentrations after 100 ns molecular dynamics simulation[55]
石墨烯量子点(graphene quantum dots,GQDs)是来源于石墨烯的一种零维纳米材料,因其具有优异的物理、电化学性质而被应用于各个领域[51-52]。研究发现GQDs 的细胞毒性不同于石墨烯和氧化石墨烯。Zhang 等[53]发现GQDs 的细胞毒性低于微米尺寸的氧化石墨烯。然而也有实验表明,GQDs 可以造成人体细胞的死亡,并且高浓度的GQDs 具有一定的毒性[54]。本课题组[55]通过分子动力学模拟研究发现高浓度的GQDs 能够引起细胞膜磷脂双分子层结构的改变。图7 显示了同一尺寸、不同浓度的GQD7 进入细胞膜后的分布情况,在四种不同浓度的体系中,GQD7 都能够在细胞膜内部分散开来,并且绝大多数GQD7单分散在细胞膜两侧。为了进一步观察GQD7 穿膜的过程,将数量为36 个分子的GQD7 体系模拟时间延长至200 ns(图8)。图8(a)显示大部分的GQDs 在进入细胞膜之前就呈现聚集状态,这和C60进入细胞膜的过程是相似的[56]。此后,在20 ns 和60 ns [图8(b), (c)] 阶段,GQDs 还是有一部分聚集在一起,这一点可以在图9 的团簇分析中得到证实。然而,在110 ns时团簇中的大部分GQDs开始平行于细胞膜表面。图10分析了GQDs表面和细胞膜xy平面的角度变化,从图中可以看出GQDs表面和细胞膜xy平面的平均夹角分布在45°~60°之间。与此同时,随着模拟时间的延长,数量为36 个分子的GQD7的最大团簇数量从33个降到10个,这表明在渗透进入细胞膜后,GQD7 的聚集体趋向于在细胞膜的两侧解离并分散到能量最小的位置。由此可估测所有的GQD7分子在足够长的模拟时间内可以单分散在细胞膜内部。这些结果表明高浓度的GQD7 倾向于通过聚集体进入细胞膜中,并在进入细胞膜后单分散开,进而影响磷脂分子的结构甚至可能影响细胞信号的传导。
2 石墨烯与蛋白质的相互作用
蛋白质是生命活动的主要体现者,人类蛋白质组中的蛋白种类估计有100多万种。石墨烯纳米材料与细胞内生物分子(如DNA、蛋白质)之间的相互作用会干扰生物功能,导致细胞毒性作用[35]。有研究发现,石墨烯对多肽、蛋白片段、蛋白的结构都有一定的破坏力。比如Matesanz 等[57]发现氧化石墨烯纳米片可以通过定位肌动蛋白丝来诱导细胞周期改变。Wang 等[58]设计了不同表面的石墨烯,如纯石墨烯、疏水性石墨烯、氧化石墨烯、表面N 掺杂的石墨烯、表面受限制的石墨烯等,利用分子动力学模拟来研究FPA(Fibrinopeptide-A,纤维蛋白肽A)蛋白与这些石墨烯的相互作用。结果表明它们都能或多或少地改变FPA 的形态,但用氧和氮原子修饰的石墨烯表面可以更有效地与FPA 或其他一些生物分子相互作用,从而改变它们的形态和电学性质,包括疏水性。
2.1 有缺陷的石墨烯和蛋白质相互作用

图8 浓度为36个分子的GQD7穿越细胞膜的过程[55]Fig.8 Aggregated structures and distribution of GQD7-36 during simulation[55]
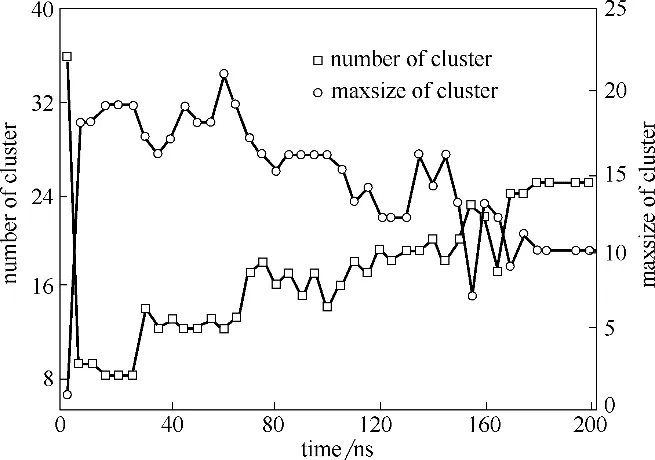
图9 数量为36个分子的GQD7系统中的团簇分析[55]Fig.9 Number of cluster and maxsize of cluster in GQD7-36 system as a function of simulation time[55]
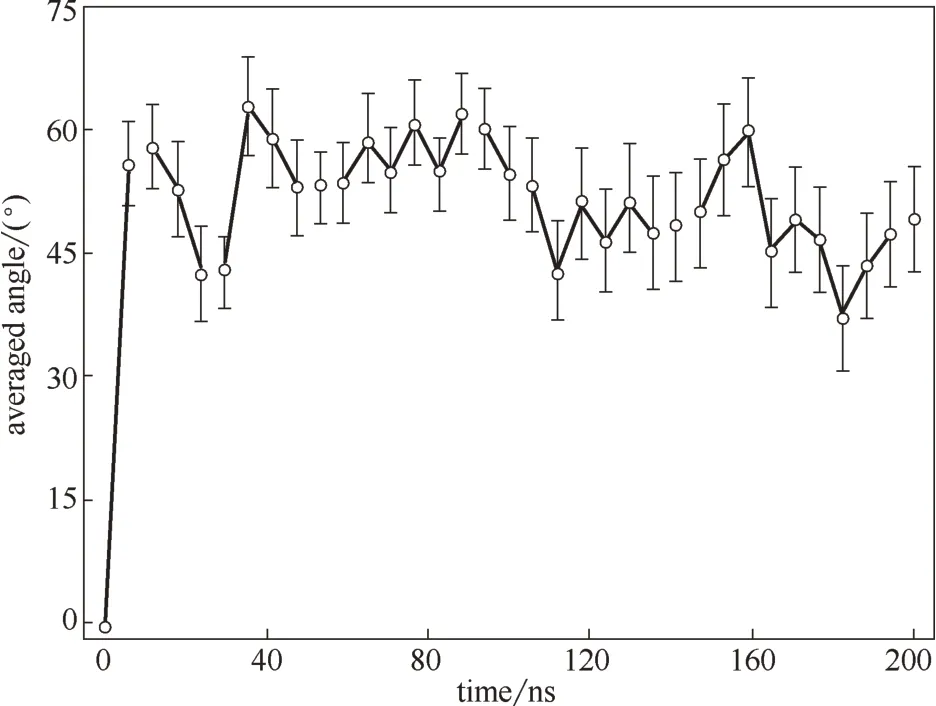
图10 浓度为36个分子的GQD7和细胞膜之间的角度变化[55]Fig.10 Angle distribution of GQD7 in lipid membrane during simulation[55]
由于石墨烯在生产过程中容易受到操作手段及环境等影响,不可避免地会生成一些不完整的、有缺陷的石墨烯。虽然有缺陷的石墨烯可以用于DNA 测序、气体分离、海水淡化等方面[59-62],但是有研究发现,这种有缺陷的石墨烯也会和生物大分子发生相互作用并对其结构造成一定的影响。比如Li等[63]采用分子动力学方法将完整的石墨烯和有缺陷的石墨烯做了比较,发现相较于完整的石墨烯,有缺陷的石墨烯对蛋白质的结构影响更大。图11(a)、(b)显示了YAP65WW 蛋白的均方根位移(RMSD)随时间的变化,可以发现蛋白质和有缺陷的石墨烯结合后其结构变化更为明显,而完整的石墨烯在吸附蛋白质后,蛋白质的RMSD 几乎没有变化。为了进一步说明YAP65WW蛋白吸附在两种石墨烯表面的过程,Li 等又分析了蛋白质和两种石墨烯之间接触的重原子数量随时间的分布,如图11(c)、(d)所示。图11(c)显示蛋白质和有缺陷的石墨烯之间的原子数量变化分为三个阶段:第一阶段在开始的几个纳秒之间,原子数量从20增加到50;第二阶段,原子数量从50 增加到80;最后原子数量增加到110,并且图中也显示在最后阶段,YAP65WW 蛋白完全地展开在有缺陷的石墨烯表面上,蛋白质结构破坏较大。而图11(d)表明蛋白质和完整的石墨烯之间接触的原子数量变化只有两个阶段,第一阶段原子数量从20 增加到40,第二阶段从60 增加到80。并且在图中也能看见蛋白质在完整的石墨烯表面有一部分呈现折叠状态,并没有完全地展开。这些模拟结果表明,蛋白质更易在有缺陷的石墨烯表面吸附并展开,其结构破坏更大。
2.2 纯石墨烯和蛋白质的相互作用

图11 分子动力学模拟中石墨烯和YAP65WW蛋白质之间相互作用时蛋白质RMSD的变化及两者间接触的原子数量的变化[63]Fig.11 Time evolution of root-mean-squared deviation(RMSD)of YAP65WW and contact number of heavy atoms between YAP65WW and graphene[63]
研究发现石墨烯能插入一些蛋白质复合物,破坏其整体结构,从而使其蛋白质的功能丧失。例如Luan等[64]使用全原子分子动力学模拟方法将石墨烯与蛋白质混合,通过探讨蛋白质之间的相互作用揭示石墨烯的潜在毒性。如图12(a) 分析了在4 次独立的模拟过程中蛋白质二聚体之间的接触面积随时间的变化,研究发现在没有插入石墨烯的初始阶段,蛋白质二聚体之间的接触面积在300~350 Å2(1 Å=0.1 nm)之间,插入石墨烯之后,蛋白质二聚体之间的接触面积逐渐减少至零,说明疏水性的石墨烯可以插入蛋白质二聚体的疏水界面中,从而破坏蛋白质-蛋白质相互作用。图12(b)~(e)描述的是石墨烯片侵入二聚体之间的过程。这一过程是通过石墨烯片和蛋白质之间的范德华力(vdW)作用的,由于石墨烯表面是疏水性的,石墨烯和水分子之间的相互作用小于其和蛋白质之间的相互作用,因此蛋白质表面的疏水残基会吸附到石墨烯表面[26]。石墨烯片通过旋转的方式侵入二聚体之间,并且在2 ns时石墨烯开始接触其中一个蛋白质单体,而石墨烯片的一个边缘保留在二聚体界面附近。在30 ns时,石墨烯和蛋白质单体之间接触的面积增多。在30~40 ns阶段,由于石墨烯表面和二聚体界面上的非极性残基之间的疏水作用,蛋白质单体开始围绕其中心轴开始旋转。与此同时,另一个蛋白质单体界面上的非极性残基开始与石墨烯片的另一边接触。56 ns 时,石墨烯片已经完全侵入二聚体之间,并将二聚体分开。图12(f)~(i)显示了石墨烯侵入蛋白质二聚体之间的另一种方式。模拟开始时石墨烯片位于二聚体的对侧,石墨烯表面可以与两个单体上的疏水残基接触。结果发现石墨烯片快速地插入二聚体的疏水表面,并且在3 ns 内将二聚体分开。总之,这两种模拟都能表明石墨烯片可以通过与蛋白质之间的疏水作用快速地进入蛋白质二聚体内并将其分开,破坏其结构,从而造成蛋白质功能紊乱。

图12 (a)蛋白质二聚体之间的接触面积随石墨烯插入时间的变化;(b)~(i)石墨烯插入蛋白质二聚体之间的过程[64]Fig.12 (a)Time-dependent contact areas of dimer during insertion of a graphene sheet;(b)—(i)Snapshots of insertion process of graphene sheet into dimer[64]

图13 蛋白质吸附在石墨烯表面的过程及相关分析[26]Fig.13 Representative trajectory and analysis of HP35 adsorbing onto graphene[26]
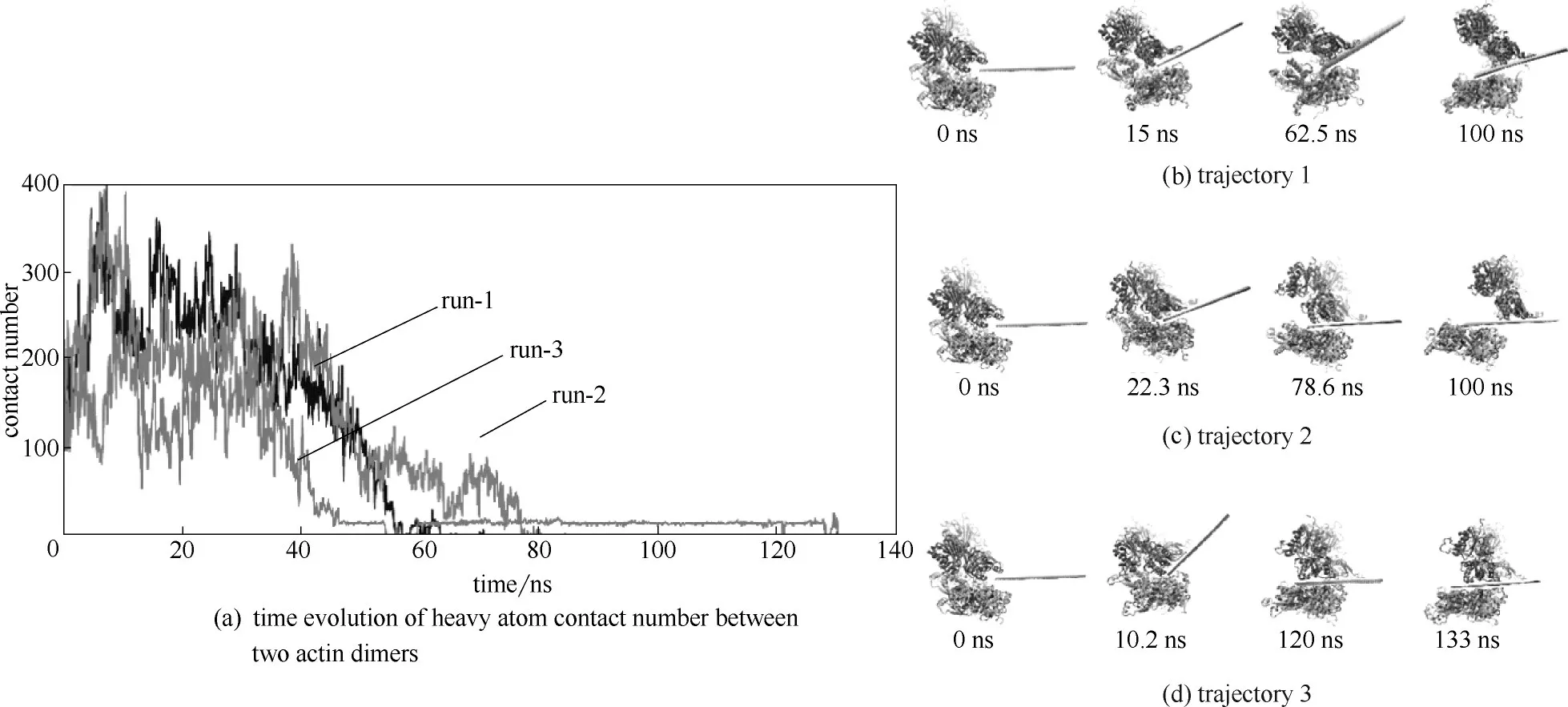
图14 氧化墨烯和蛋白质的相互作用[65]Fig.14 Insertion process of GO nanosheet into interstrand gap of actin tetramer[65]
石墨烯除了可以插入蛋白质之间,还可以通过与蛋白质表面的残基相互作用从而吸附蛋白质,改变蛋白质的结构。Zuo 等[26]利用分子动力学模拟还发现石墨烯可以通过π-π 相互作用与绒毛蛋白(HP)的芳香族残基相结合,从而破坏蛋白质的二级结构。如图13(a)所示,在模拟时间500 ns 内HP 蛋白逐渐吸附到石墨烯表面。在3 ns 时,F35 残基吸附在石墨烯表面,此时HP 蛋白与石墨烯表面的接触面积增加到250 Å2[图13(b)];在t=7 ns 时,W23 残基开始吸附在石墨烯表面,且HP 蛋白与石墨烯表面的接触面积从250 Å2增加到300 Å2,同时HP 蛋白的第三条α 螺旋也开始吸附到石墨烯表面;在t=145 ns 时,F10 残基吸附到石墨烯表面,蛋白质与石墨烯之间的接触面积从300 Å2增加到750 Å2,并且HP 蛋白的第二条α 螺旋开始吸附到石墨烯表面。图13(c)进一步说明了HP蛋白吸附在石墨烯表面上的过程:在没有石墨烯插入的情况下,HP 蛋白的RMSD 是1.8 Å,此时HP蛋白处于稳定的环境并且α螺旋上有23 或24 个残基;然而当石墨烯插入HP 蛋白后,其RMSD 从1.8 Å 增加到7.5 Å,且α 螺旋上的残基数下降到10 个。HP 蛋白的三条α 螺旋中,第三条α 螺旋大部分被破坏,部分转变成310螺旋和β转角,第一条α 螺旋也有一部分转变成β 折叠,第二条α螺旋几乎没有变化。这三条螺旋表现不同可能因为其螺旋上组成的氨基酸残基不同。为了进一步研究残基对HP 蛋白质吸附的影响,Zuo 等分析了残基距离石墨烯表面的距离,如图13(d)所示。观察发现,F35、W23、F10 残基通过和石墨烯之间的强烈的π-π 相互作用,先后分别吸附在石墨烯表面。因此,这些研究发现蛋白质的氨基酸残基可以控制蛋白质吸附在石墨烯表面的过程,在吸附过程中其二级结构遭到了破坏。
2.3 氧化石墨烯和蛋白质的相互作用
氧化石墨烯和石墨烯都会破坏蛋白片段的二级结构,但石墨烯的破坏力较强,且在石墨烯表面螺旋结构会转变为β折叠。为进一步研究氧化石墨烯插入蛋白质之间的过程,Tian 等[65]利用分子动力学模拟研究发现氧化石墨烯纳米片能够吸附肌动蛋白单体,从而改变其二级结构。图14(a)显示了肌动蛋白四聚体和氧化石墨烯之间的三次独立的动力学模拟过程,研究发现插入氧化石墨烯后,随着模拟时间的延长,肌动蛋白四聚体之间的重原子接触数量急剧减少。图14(b)~(d) 显示了氧化石墨烯片插入两个蛋白质二聚体之间的过程,发现在前两次模拟过程中,当时间为100 ns时,肌动蛋白四聚体被氧化石墨烯片分开,这两个蛋白质二聚体在氧化石墨烯表面表现出异步的移动方式。在第三次模拟过程中,在120 ns时,氧化石墨烯也会插入两个蛋白质二聚体之间,破坏其结构。这些结果表明氧化石墨烯纳米片通过范德华相互作用能插入肌动蛋白四聚体之间的链间间隙,破坏四聚体结构,从而在很大程度上破坏肌动蛋白的整体结构。
2.4 石墨烯量子点和蛋白质的相互作用

图15 HP35吸附在不同大小的GQDs表面上的RMSD随模拟时间的变化[67]Fig.15 Time evolution of RMSD of HP35 protein on GQDs with different size[67]

图16 HP35蛋白吸附在不同大小的GQDs表面上的二级结构变化[67](其中二级结构根据DSSP算法得到[68])Fig.16 Time evolution of the secondary structure of HP35 upon binding to the surface of GOQDs with different size[67](here,the secondary structures are determined by DSSP program[68])
石墨烯量子点的潜在生物毒性不容忽视,研究发现石墨烯量子点能够和蛋白质等生物大分子相互作用。比如Fang 等[66]采用实验和分子动力学模拟相结合的方法,发现GQDs 可以通过识别结合位点吸附泛素蛋白。本课题组[67]运用分子动力学模拟方法研究了不同尺寸的石墨烯量子点(GQDs)对蛋白质HP35 吸附的结构影响。研究发现GQDs 的尺寸越大,残基的吸附能力越强,吸附在GQDs 上的残基数量也越多,而且对蛋白质的二级结构破坏也越大,进而对蛋白质产生一定的毒性。如图15 所示,通过计算RMSD 来分析蛋白质的结构变化,在四个不同尺寸的GQDs体系中RMSD值分别稳定在0.16、0.24、0.24、0.36 nm,其 中 图15(d) 显 示HP35-GQD275这一体系的第三条轨迹在47 ns内RMSD值从0.2 nm 增加到0.78 nm,第四条轨迹在183 ns 之内RMSD 值从0.2 nm 增加到0.56 nm,与其他三个体系相比,变化最为明显。为了验证RMSD这一结果,又做了蛋白质的二级结构分析,如图16所示。在图16(d)中,发现HP35-GQD275的结构变化最为明显,其中第三条α 螺旋部分转变为310螺旋、转角及卷曲,第一条α 螺旋部分转变为转角,但是其他三个体系[图16(a)、(b)、(c)]的蛋白质的二级结构改变就相对较小。通过计算RMSD 和对蛋白质进行二级结构分析,发现GQDs的大小对蛋白质吸附在GQDs表面上起着重要的作用,并且随着GQDs 尺寸的增加,蛋白质的结构变化更明显。图17 详细介绍了蛋白质在最大尺寸GQDs 上的吸附过程,在第47 ns 时,位于第三条α 螺旋的最末端芳香族残基W23 开始吸附在GQD275 表面[图17(a)],与 此同时,W23 残基与GQD275 表面之间的最短距离是0.36 nm[图17(b)]。在第57 ns 时,芳香族残基F10 也吸附在GQD275 表面[图17(a)],此时F10 残基与GQD275 表面之间的最短距离也是0.36 nm。这些最短距离和文献中描述芳香族残基与石墨材料之间的最短距离约为0.4 nm大致相近[26]。
3 石墨烯与DNA的相互作用
DNA 是染色体的主要组成成分,同时也是主要遗传物质。DNA 分子的双螺旋结构是相对稳定的。这是因为在DNA 分子双螺旋结构的内侧,通过氢键形成的碱基对使两条脱氧核苷酸长链稳固地并联起来。另外,碱基对之间纵向的相互作用力也进一步加固了DNA 分子的稳定性。生物分子(如DNA、蛋白质、细胞膜)与纳米级材料的结合为高级复合纳米材料的设计提供了机会。由于碳基纳米材料独特的物理化学结构、力学性能等,现已被广泛用于生物传感、生物医疗等各个领域[69-71]。比如氧化石墨烯因其具有良好的吸附性,可与DNA 结合用于生物传感器[72-73]。含有纳米孔的石墨烯表面可作为DNA 测序的潜在材料,其中石墨烯表面的工程化形态将调节DNA 的迁移和易位[74-77]。比如,Jagota 等[78]模拟了单链DNA 在石墨烯和碳纳米管上的二级结构变化,他们发现可以通过链间氢键建立一类DNA结构(β折叠和β桶),并且单链DNA在石墨表面上呈平面形式。
3.1 纯石墨烯和DNA相互作用
Zhao[79]使用分子动力学模拟研究了DNA 片段与水溶液中石墨烯表面的相互作用,发现双链DNA在石墨烯表面吸附过程中结构会被破坏。图18 显示了DNA 片段可以快速调整它们的几何取向,并在石墨烯表面上形成两种不同的自组装结构。第一种自组装结构表现为DNA 片段1,3 和4 能够旋转并稳定在“站立”状态。DNA 双螺旋的轴在30 ns 内逐渐从平行几何形状转变为垂直几何形状,这导致旋转的DNA 片段在表面上形成森林状结构。在观察到的第二种类型的自组装结构中,DNA 片段2 位于石墨烯表面上并保持其原始取向。在50 ns 模拟时间内都保持稳定的结构没有发生移动。促使形成这两种模式背后的驱动力是疏水性DNA 碱基对与石墨烯碳环之间的π-π 堆积作用。特别是当DNA在第二类自组装中与石墨烯表面稳定结合时,DNA的末端碱基对由于严重变形而断裂,从而对DNA 产生潜在的细胞毒性。
3.2 氧化石墨烯和DNA的相互作用
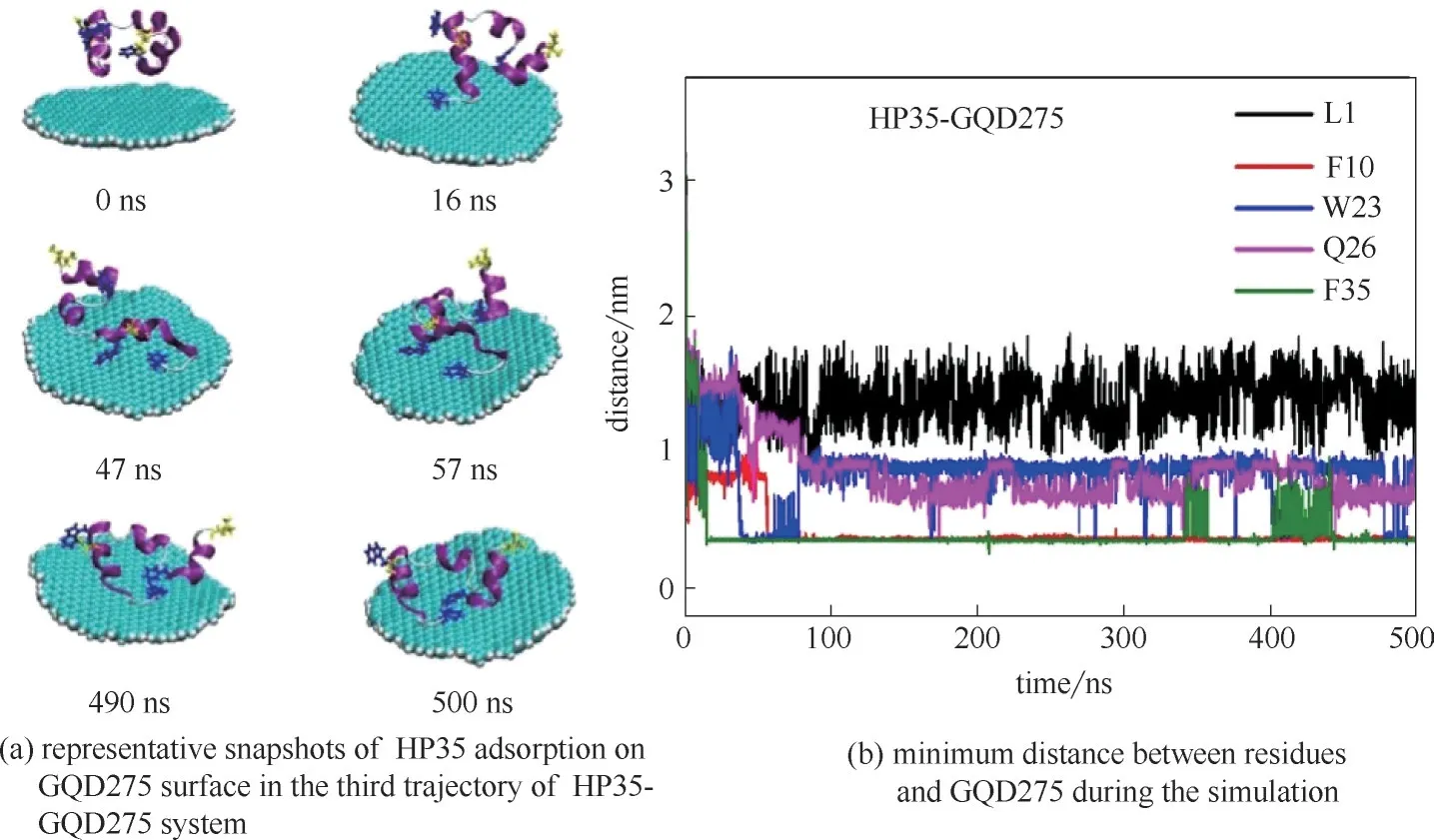
图17 HP35吸附到石墨烯量子点表面的过程[67]Fig.17 Adsorption progress of HP35 on graphene quantum dots[67]

图18 DNA吸附在石墨烯表面的过程[79]Fig.18 Self-assembly of DNA segments on graphene layers[79]
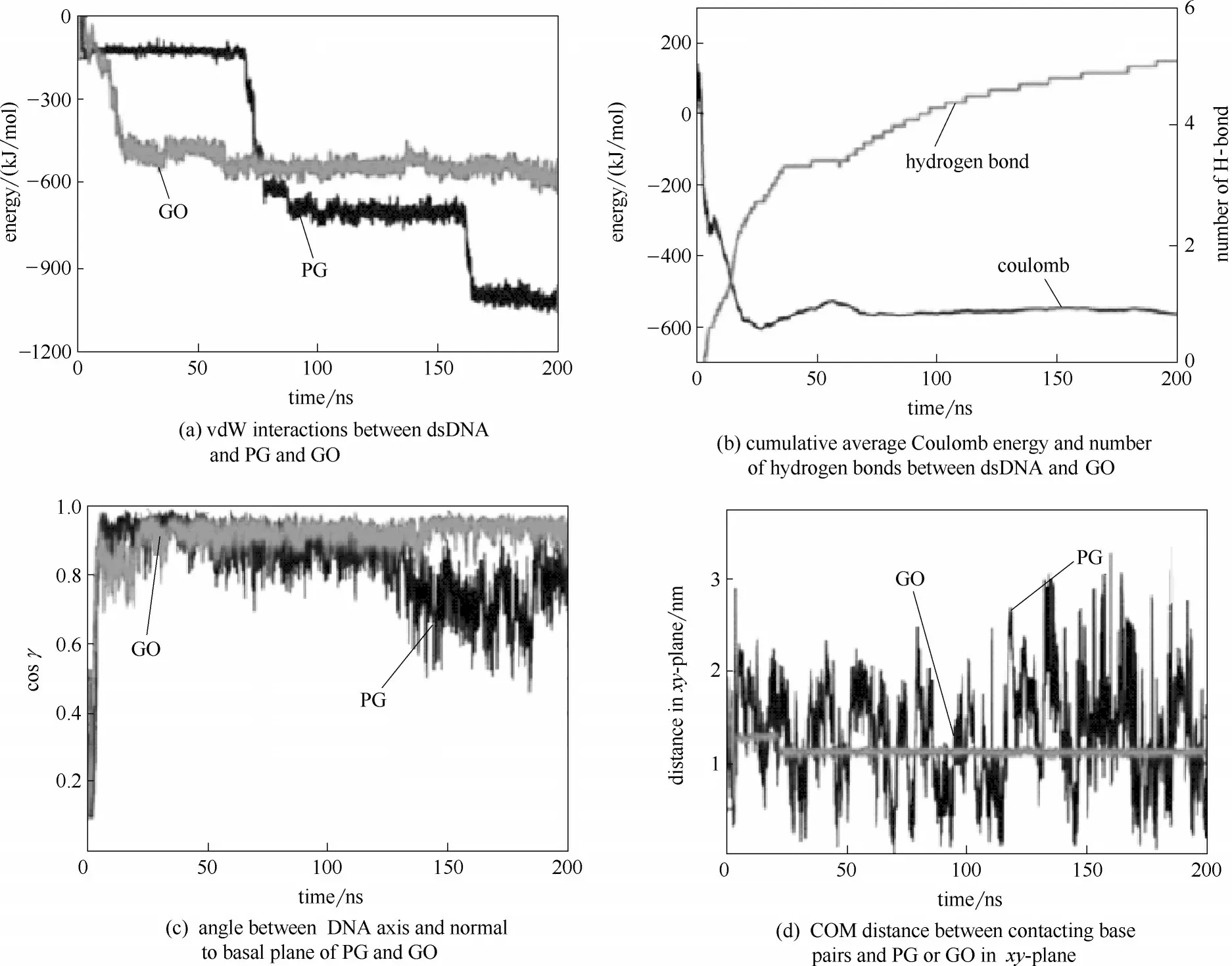
图19 双链DNA吸附在石墨烯和氧化石墨烯表面的相关分析[80]Fig.19 Interaction between DNA and graphene and graphene oxide[80]
有研究表明石墨烯、C60、碳纳米管等碳基纳米材料与DNA 的相互作用,会破坏DNA 的碱基对,从而破坏DNA 的结构,进而可能影响DNA 的功能。Chen 等[80]研究了短链DNA 在石墨烯和氧化石墨烯上的吸附方式,发现单链DNA 倾向于平躺在石墨烯和氧化石墨烯表面,而双链DNA 则是垂直于石墨烯和氧化石墨烯表面,从而减少了其与碳表面之间的接触面积,使得石墨烯和氧化石墨烯的吸附能力也减弱。如图19(c) 所示,γ=0 (cosγ= 1) 表明双链DNA 以垂直方式吸附在石墨烯和氧化石墨烯表面。图19(d) 表明双链DNA 可以在石墨烯表面自由移动,而在25 ns 时,双链DNA 在氧化石墨烯表面的结合位点开始不再改变,并紧紧吸附在氧化石墨烯表面上。图19(a)、(b)表明双链DNA 和石墨烯、氧化石墨烯的相互作用主要靠范德华力和氢键。本次模拟结果表明,氧化石墨烯更倾向于吸附单链DNA 而不是双链DNA。通过比较双链DNA 在石墨烯和氧化石墨烯上的结合位点,还发现氧化石墨烯具有更好的吸附能力。因此,氧化石墨烯通过吸附DNA 与DNA发生相互作用从而破坏DNA的碱基对,进而破坏DNA的结构,给DNA带来潜在的生物毒性。
3.3 氮化石墨烯和DNA的相互作用
Gu 等[24]通过分子动力学模拟和琼脂糖凝胶电泳分析,研究了双链DNA 与新近合成的氮化石墨烯(C2N)相互作用的结构和动力学性质变化,发现双链DNA 以垂直的方式吸附在C2N 表面上。图20 显示双链DNA 吸附在石墨烯过程中其界面处的端基对会发生变性,即碱基间氢键断裂,释放的碱基与石墨烯原子直接结合,在此期间DNA 和石墨烯表面接触的原子数目也相应地增加。相比较而言,DNA 吸附在C2N 表面上的强度比较温和,DNA 结构破坏程度也较石墨烯低。上述研究表明,双链DNA 和单链DNA在石墨烯表面有不同的吸附方式,双链DNA垂直于石墨烯表面而单链DNA 平行于石墨烯表面,因此石墨烯更倾向于吸附双链DNA。在吸附过程中,双链DNA 碱基对之间的氢键(特别是AT 间的氢键)断裂,释放的碱基与石墨烯原子直接结合,破坏DNA 碱基对的结构。因此石墨烯对DNA 具有一定的潜在毒性。
4 结论与展望
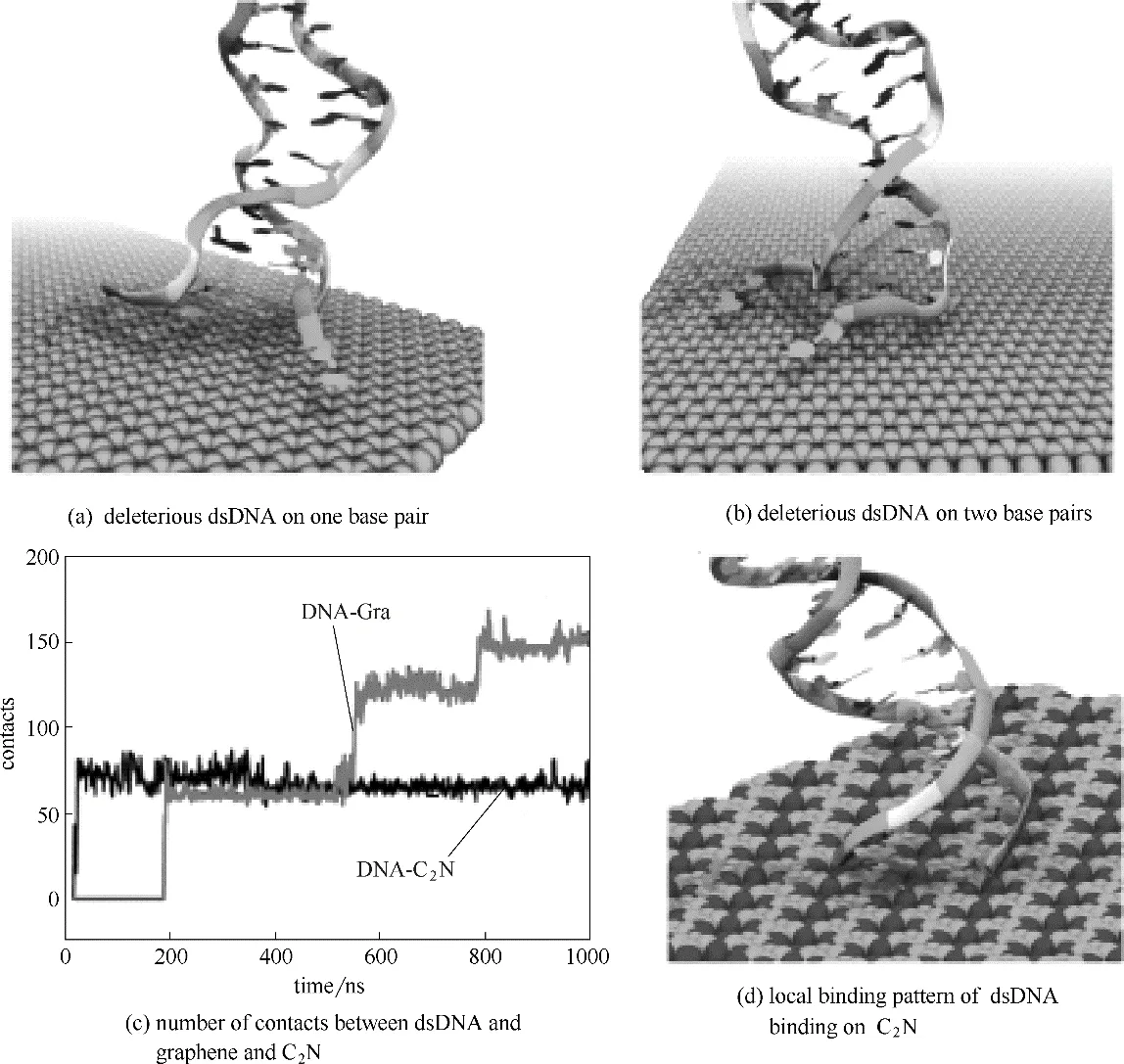
图20 双链DNA吸附在石墨烯表面及C2N表面上的过程[24]Fig.20 Interaction between dsDNA and graphene and C2N[24]
虽然石墨烯等纳米材料具有独特的物理、化学性质,并在生物医药研究领域广泛应用,但是其生物安全性应引起人们的重视。本文总结了当前已报道的石墨烯及其衍生物在生物毒性方面的计算机模拟研究,研究表明石墨烯及其衍生物具有潜在的生物毒性:石墨烯可以吸取细胞膜表面的磷脂分子,破坏细胞膜的完整性;石墨烯通过π-π 相互作用能够破坏蛋白质二级结构和DNA 碱基对等。石墨烯及其衍生物自身的物理化学性质对其生物效应有着决定性影响,这些性质包括尺寸、形状、表面电荷、化学组成、表面修饰等。有关这些因素对生物膜毒性影响的研究还比较少,因此,进一步研究石墨烯及其衍生物的物理化学性质对生物膜毒性的影响十分必要。除此之外,生物环境中的盐浓度、温度、pH 等对石墨烯及其衍生物的生物毒性的影响也不是特别清楚,石墨烯及其衍生物对具体哪些蛋白质、生物膜的毒性影响仍然不清楚,即蛋白质、生物膜的种类对石墨烯及其衍生物的生物毒性的影响机制尚不明确。目前国内外对石墨烯与生物体相互作用的机制研究尚处于初级阶段,石墨烯作用于生物体后引发的生理、生化反应及机制尚未有深入的研究,因此,相关领域的研究人员应进一步加强石墨烯及其衍生物的生物安全性研究,强化石墨烯及其衍生物对生物体作用的机制研究。

