离子液体气体干燥技术的研究进展
桂成敏,朱瑞松,张傑,雷志刚
(北京化工大学,化工资源有效利用国家重点实验室,北京100029)
引 言
在应对气候变化和推进绿色发展的全球大背景下,由于气体能源具有低碳环保的优点,我国进一步加大天然气、氢气等清洁能源的开发力度,逐渐弱化对石油和煤炭的依赖[1]。近几年全国天然气消费量稳步增长,在2018 年消费增长率突破15%,为2013年以来的最高值[2]。在日益繁荣的气体工业中,水分的存在会给气体生产带来巨大危害,它容易吸附尘埃从而堵塞气体管道和阀门,当形成酸性水合物时则会对设备和管线造成腐蚀[3-4]。为此,开发绿色高效的气体脱水技术对安全生产和资源有效利用具有重要意义。
目前大规模气体干燥多采用溶剂吸收法,常用脱水剂有浓硫酸、二甘醇和三甘醇(triethylene glycol,TEG)等[5]。浓硫酸腐蚀性强并且废硫酸回收难、污染大,而二甘醇由于其蒸气压较高存在溶剂损失大的问题[6]。TEG 在吸收塔易产生发泡现象,而且回收塔塔底再沸器温度需要严格控制,否则超过204℃TEG 就会分解[7]。相比于传统脱水剂,ILs具有可忽略的挥发性、热力学与化学稳定性以及无毒性等优点[8]。除了无挥发性损失外,由于ILs 的回收流程简单,使用ILs 可以降低工艺能耗。据流程模拟计算,在相同的流程条件下对CO2进行干燥,使用[BMIM][BF4]比使用TEG能降低设备8.13%的热负荷和16.58%的冷负荷[9]。因此,研究ILs用于气体脱水过程进而开发新型气体干燥工艺是解决现有干燥问题的重要途径。
在ILs 用于气体干燥的研究中备受关注的领域有预测型热力学模型的构建,脱水机理的揭示和脱水流程的开发。发展较早的UNIFAC 模型被扩展到ILs 体系能够较好地预测体系相平衡,而COSMO 模型则被广泛应用于ILs 的筛选[10-12]。近年来出现的人工智能网络模型在气体-ILs 体系的研究中取得了可观的成果,但其预测准确性仍需要进一步提高[13]。在脱水机理方面的研究主要是对ILs-H2O 体系内的氢键、范德华力等弱相互作用进行分析。研究机理的手段从传统的热力学方法发展到了量子化学方法和分子动力学方法,为细致描述ILs 与水之间的相互作用提供了有利条件[14]。关于ILs 脱水流程国内外学者提出了多种工艺方案,它们的共同点是工艺流程处于实验室规模的验证阶段,并且相比于使用传统干燥剂的脱水流程,设备投资和能耗均能够大幅降低[9,15-16]。
关于ILs 脱水工艺流程的研究最近几年才被提出来,所以到目前为止还没有系统论述ILs 脱水工艺的文章。本文重点从热力学模型、溶解度测量方法、脱水机理和工艺流程四个方面对ILs 脱水工艺进行综述,总结了ILs 脱水领域最新的研究成果,分析了此领域的研究热点和尚未解决的问题,最后对未来研究方向作出展望。
1 预测型分子热力学模型
1.1 UNIFAC模型
UNIFAC 模型被广泛应用于预测流体的汽液相平衡,它将活度系数表达为组成和温度的函数。该模型的核心在于基团贡献法,即每种物质都可分为不同的基团,而不同的基团对活度系数的贡献不一样。


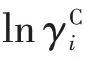
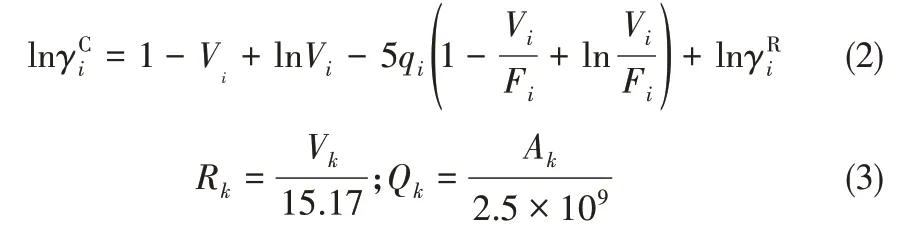
Fi和Vi分别是表面分数和体积分数,它们由范德华体积ri和表面积qi构成



式中,Xm为基团m在混合物中的分率;T是热力学温度;αnm是与温度有关的基团n和基团m之间的相互作用参数,并且αnm≠αmn。该模型不需要三元(或更高)参数来描述组分的汽液相平衡。

图1 离子液体基团划分方法Fig.1 Ionic liquid group division method
1.1.2 ILs 基团拆分方法 基于基团贡献法的UNIFAC 模型基团拆分方法主要有三种,接下来以[BMIM][PF6]为例依次介绍这三种方法。如图1(a)所示,方法一是将IL 拆分为阴离子[PF6]-和阳离子[BMIM]+两个基团,这种方法得到的基团数目很少,但是当阴离子或者阳离子较为复杂时往往不能很好地体现ILs 的性质[18]。方法二如图1(b)所示,先把阴阳离子拆开,再将它们拆分为更小的独立的基团。在此方法中由于每个基团都带电荷,必须加入Debye-Hückel 长程静电项[19-20]。方法三则是把ILs拆分为小的独立的基团,再将阴阳离子主要骨架合并为一个电中性基团[21-24],如图1(c)所示,IL 被拆分为3 个乙基基团、1 个甲基基团和一个电中性基团,这个电中性基团由咪唑环和[PF6]-构成。这种方法由Lei等[25]提出,很好地解决了基团带电荷的问题。
1.1.3 模型参数获取方法 当基团参数体积参数Rk和表面积参数Qk不能直接从文献获得时,可以通过以下两种方式获得。第一种是利用Domańska等[26]提出的摩尔体积计算关联式计算,在已知离子液体摩尔体积和体积因子的条件下可以很方便求出基团的体积和表面积参数;第二种方法是通过COSMO-RS、Gaussian 09 等商用软件计算。计算的关键步骤是基团结构的优化,得到最优结构的基团后,利用这些软件可以算出ILs 各个基团的表面积和体积。
基团相互作用参数αnm和αmn一般通过拟合实验的汽液相平衡数据获得,当没有相关的实验值时,可以借助热力学预测软件算出体系的溶解度或者无限稀释活度系数等热力学数据。关于ILs 的基团参数如图2 所示。理论上,获得了UNIFAC 方法各个基团所有相应的模型参数,对于其他由这些基团构成的ILs 和溶质的热力学参数都可以通过计算得到。由于一些模型参数来自于实验测量,因而比纯预测型的COSMO-RS 模型对物质的热力学性质的预测准确性要高一些[27]。
1.2 COSMO-RS模型
COSMO-RS 模型是由Klamt 等[37]提出的一种基于量子化学计算的预测型热力学方法。这种运算方法分别在1999 年和2009 年被嵌入到商业软件COSMOtherm和ADF COSMO-RS 中。图3 显示的是ADF COSMO-RS 中COSMO-RS-Lei 2018 模 型 操 作界面。在没有实验数据的情况下,利用这些软件程序可以对众多纯物质或者混合物的性质进行预测,它的计算原理如图4所示。利用COSMO-RS可以对各种不同物质的脱水性能进行预测,评价其气体脱水性能优良的参数有亨利系数和选择性。图5是利用COSMO-RS 方法计算出的三种不同类型的干燥剂对水的亨利系数和水相对于甲烷在干燥剂中的选择性,从中可以观察到[EMIM][Ac]的亨利系数最小而选择性最大,说明它相对于固体无机盐KSCN和传统有机溶剂TEG 都具有更好的甲烷气体干燥性能。



对于ILs 中气体溶解度的预测虽然定性上符合实验数据,但是定量上可能存在巨大的偏差。Manan 等[41]用COSMO-RS 模型对CO2、SO2等15 种气体在27 种ILs 中的溶解度进行了预测,然后将预测值与IUPAC 数据库实验值相比较,发现模型只是定性上预测了ILs 中气体溶解度,一些溶解度预测值偏差甚至超过了100%(摩尔分数)。当COSMO预测的偏差较大时可以通过调整内部参数来提高其准确性。前面提到的商用软件ADF COSMO-RS 中有三个可调参数:失配能量系数、氢键系数和有效片段表面积常数。从文献中获得气体在ILs 中无限稀释活度系数值,用它们来校准这三个可调参数可以在一定程度上提高预测准确性。在298.2~333.2 K范 围 内,Han 等[42]用COSMO-RS 方 法 对CO2在[BMIM][BF4]和[BMIM][PF6]中的溶解度进行预测,与实验值相比平均相对偏差(ARD)分别是71.45%和39.24%,而用上述方法调整了参数后ARD分别降低为16.41%和5.39%。
综上,COSMO-RS 模型可以对ILs-H2O 热力学性质以及气体在ILs 中溶解度进行定性预测,说明它具备筛选ILs 的能力,这可以为研究工作节省大量的时间和精力。

图2 UNIFAC基团相互作用参数表(已知参数:黑色[28],绿色[17],红色[25],黄色[29-32],紫色[33],灰色[34],蓝色[35],棕色[36];未知参数:白色)Fig.2 UNIFAC group interaction parameter table(Parameters available:black[28],green[17],red[25],yellow[29-32],purple[33],gray[34],blue[35],brown[36];parameters unavailable:white)

图3 ADF软件中COSMO-RS-Lei 2018模型操作界面Fig.3 COSMO-RS-Lei 2018 model user interface in ADF software

图4 COSMO-RS模型计算原理[37]Fig.4 COSMO-RS model calculation principle[37]
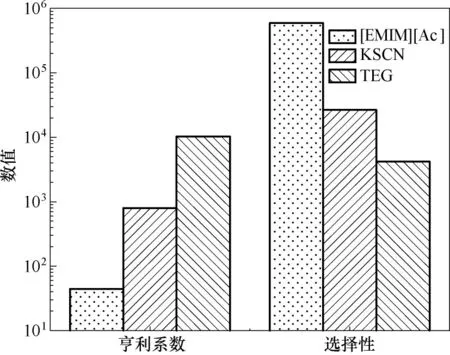
图5 COSMO-RS方法计算出的亨利系数和选择性Fig.5 Henry coefficient and selectivity calculated by COSMORS model
1.3 GC-EOS模型
GC-EOS 模型建立在普遍化的范德华方程和局部组合混合规则上,同时适用于极性体系和非极性体系。Bianca 等[43]首次将GC-EOS 模型扩展到预测气体在ILs 中的溶解度,在其研究中,将CO2在二元均相离子液体混合物中的溶解度数据拟合得到的GC-EOS 参数可以较好地预测高压下ILs 二元混合物的汽液相平衡。Pereda 等[44]将该方程进一步推广应用于描述甲烷、乙烷和氢气等气体在咪唑类离子液体中的溶解度数据,通过拟合从而得到方程中ILs的临界直径、摩尔体积等参数。将新得到的参数应用于预测丙烷、丁烷和己烷等烷烃与不同碳支链长度咪唑类ILs 所组成系统的热力学平衡性质,结果显示GC-EOS 对汽液相平衡给出了较为准确的预测。Bermejo 等[29]将GC-EOS 方程应用于多种气体在烷基硫酸根类ILs 中的相平衡的描述,结果发现该方程对CO2、CO、H2在IL 中的泡点的预测值与实验值的相对偏差大部分都小于10%,而对甲烷和乙烷在IL 中的溶解度的预测效果很不理想。Kühne等[45]将GC-EOS 模型用于预测IL-CO2-有机溶剂三元相平衡,结果发现,GC-EOS 不仅可以定性预测汽液相平衡,还能预测液液相变。在Mota 等[46]的研究中,将PR-EOS 方 程(Peng-Robinson Equation of State)与GC-EOS 方程进行比较,对于CO2在低黏度的离子液体[HMIM][TCB]的汽液相平衡的描述,当参数足够时,前者的准确性更强,GC-EOS 模型对参数的依赖性更弱一些,当参数很少时往往准确性好于前者。

图6 气体溶解度测量装置Fig.6 Gas solubility measuring device
2 气体在ILs 中溶解度的实验测量方法
2.1 质量测量法
质量测量法基于纯液体溶剂和达到汽液相平衡时液相的质量差别来计算气体溶质在ILs 中的溶解度。质量测量法的实验装置如图6(a)所示。其主体是一个恒温高压平衡釜,反应釜的热量由釜外硅油(高温介质)或乙醇(低温介质)提供,温度和压力通过温度和压力传感器提供给自动指示仪表实时显示。平衡釜有三个通道,气体取样口在装置顶部,连接气相色谱检测气体成分;气体进口通道在釜上部,它与高压钢瓶连接,用于进气;液体取样口靠釜底部,可用于釜内液体取样。当釜内加入待测离子液体并且通过检测平衡釜密封性良好后,可以打开气瓶通气至指定压力,关闭阀门后开启釜内搅拌装置,等待至装置达到汽液相平衡。当ILs 吸收至饱和时,即可取出釜内富含气体的液相通过质量差法进行测量,从而得出所取出的液相中气体溶质的浓度。
这种溶解度测量方法温度范围一般为-60~100℃,压力上限在200 bar(1 bar=105Pa)左右。它适合气体在ILs 溶解度较高的情形,当气体在ILs 中溶解度小于3%(摩尔分数)时,通过质量差法计算样品中气体溶解度将会变得困难,测量数据的准确性不好[50]。
2.2 等体积饱和测量法
典型的等体积饱和测量法的装置如图6(b)所示,装置主体由等温平衡釜和气体储存器组成,依靠气体管线和阀门连接在一起。在实验前需要测量出平衡釜体积、气体储存器和管线的总体积。平衡釜的体积可以通过向其中注入蒸馏水测量出,测量气体储存器和管线的总体积时可向其中注入氮气,然后使用PVT 关联式算出[51]。实验开始时将已知质量和体积的ILs 注入平衡釜中,并且将平衡釜连上真空泵去除其中的气体。随之关闭阀3,打开阀1 和阀2 向气体储存器中通气,记录通气平衡时储存器的压力。然后关闭阀1打开阀2,使得气体储存器中气体与平衡釜内ILs 接触,在期间可通过剧烈搅拌釜内液体以缩短平衡时间。随着气体逐渐溶解,气体储存器内压力下降最后趋于固定值,根据储存器中的初始气体浓度与平衡时浓度之间的差值可以计算溶解气体的量[48,52]。
与质量测量法相比,等体积饱和测量法装置设计更加简单,测量准确性也较高,但是吸收达到平衡所需时间比较长。值得注意的是,当气体溶解后会改变ILs 的体积,体积如果变化不大时可以忽略,较大时则需通过其他方法矫正[53-54]。
2.3 半无限体积法
半无限体积法实验装置如图6(c)所示,主要包括参考体积部分和微型体积部分。参考体积部分用来充入气体溶质,而微型体积部分注入ILs。在装置进料完成后的20 min 内进行扩散测量,通过使用水浴对ILs 进行严格温度控制(0.02℃)以防止ILs 黏度的变化对计算结果造成干扰。扩散一段时间后,打开搅拌器,以便更快达到汽液平衡。在实验过程中测量出微型体积内初始压力和平衡压力,由此压力差计算气体溶解度。
这种测量方法最初是由Camper 等[49]提出的,他们测量了乙烷、乙烯、丙烷、丙烯和二氧化碳在[EMIM][TF2N]中的溶解度。He 等[55]利用此方法测量了在30~70℃,0.1~1.4 bar范围内制冷剂在三种咪唑类ILs中的溶解度,结果发现溶质在[HMIM][TF2N]中的溶解度比在[HMIM][TFO]和[HMIM][BF4]中的溶解度要大,这与文献[56]报道值一致。
3 ILs脱水机理与工艺
3.1 ILs脱水动力学
评价吸收过程的三个动力学参数是吸收速率、饱和吸收量和吸收达到平衡所需要的时间。关于ILs 吸收水的动力学模型的研究目前只停留在静态吸湿实验。在Francesco 等[57]的研究中提出了水溶解于ILs 是三个步骤同时进行的结果:(1)水分子吸附到ILs 表面;(2)由于扩散水分子从表面迁移到溶液内部;(3)形成水-离子络合物。由此,提出了吸收动力学方程如下

式中,x是溶液中水的摩尔分数;x∞是摩尔比的稳态值,代表达到平衡时每个IL 分子吸收多少个水分子;e 为自然常数,其值约为2.71828;β是吸收速率常数,表示达到平衡的速度。
从以上三个步骤出发可以看出ILs 本身性质对吸收的影响。第一步吸附过程与吸收速率有关,ILs暴露于表面的基团对水的亲和性越强,吸收速率越快。含咪唑盐倾向于使烷基远离表面取向,从而使其他亲水基团能与气相中水分子有更多的接触,这在一定程度上加快了吸收水分。在扩散阶段,扩散速率受ILs 的黏度影响,而黏度与水含量存在密切关系。最后一步决定了ILs 的饱和吸水容量,短链的ILs 较容易形成三维网状结构,从而饱和吸水量要大于长链的ILs。吸收达到平衡所需要的时间受吸收速率和饱和吸收量共同影响。
除ILs 本身外,气体湿度和吸收温度对吸收过程也有很大的影响[58]。气体湿度越大,吸收容量和吸收速率都会增大,但是吸收容量增大的比值要大于吸收速率,所以最终导致吸收达到平衡的时间变长。在一定的温度范围内,温度的升高会提高ILs对水分的吸收速率和饱和吸收量,并且吸收过程更容易达到平衡。对于ILs,温度的升高会导致气体动能的增加,同时也降低了ILs 的黏度。黏度的降低对吸收的促进作用大于分子动能增加对吸收的抑制作用,从而使得吸收速率加快。黏度的降低也会导致饱和吸收量的增加和达到平衡所需时间的缩短,达到吸收平衡所需时间由吸收速率和饱和吸收量共同决定,这说明温度升高对吸收速率的影响要大于对吸收容量的影响。
3.2 ILs脱水机理
根据与水分子亲和力强弱可把ILs 分为亲水性ILs 和疏水性ILs。ILs 的亲水性受阴阳离子共同影响,一般而言,阳离子上烷基链长度越长,其吸水能力越弱,可以通过增加阳离子上亲水性官能团增强它的亲水性。在[BMIM]+作为阳离子的ILs 中,阴离子吸水速率存在如下规律:[Ac]->[Cl]->[Br]->[TFA]->[NO3]->[TFO]->[BF4]->[TF2N]->[CHO]->[PF6]-,一般卤化物、硝酸盐、甲酸盐类阴离子能增强其亲水性,而[PF6]-、[TF2N]-等疏水性阴离子则会降低其亲水性[59]。ILs 与水的亲和性大多来源于ILs 的阴、阳离子与水分子之间产生了氢键。为了研究氢键在[EMIM][TF2N]-H2O 体系多种弱相互作用间的关系,Yu 等[60]对其混合焓进行分析,发现对混合焓贡献最大的是氢键相互作用,而静电相互作用和范德华相互作用几乎可以忽略。
Han 等[38]为了考察[EMIM][TF2N]+H2O+CO2体系的氢键作用,通过COSMO-RS 方法计算出体系的分子表面屏蔽电荷密度分布(σ-profile),发现H2O 的σ-profile 的分布范围很广,在0.018 e/Å2(1 Å=0.1 nm)处出现一个强峰,说明水分子可作为氢键受体。在对称位置σ=-0.018 e/Å2处同样出现一个强峰,说明水分子可作为氢键供体。[TF2N]-在0.011 e/Å2出现一个强峰,这是由含氧基团引起的,说明阴离子具有强的氢键受体能力,它能与水分子形成强的氢键。待干燥的CO2主要集中在非极性区域。[EMIM]+在-20.0082 e/Å2区域有一个弱峰,说明其具有弱的氢键供体能力,这在Wang 等[61]的研究中得到了进一步证明,他们通过Gaussian 03 程序对水分子与[BMIM]+间的相互作用能量进行分析,结果表明水分子中氧原子与咪唑环上碳原子间可形成较强的氢键,综上,[EMIM][TF2N]的亲水性来源于[TF2N]-与水分子形成的强氢键,而[EMIM][TF2N]与CO2之间氢键相互作用很弱使得吸收过程中能大大降低CO2在吸收剂中的损失。
3.3 水对ILs的影响
水与ILs 的相互作用比较复杂,它不仅与阴阳离子种类以及配对方式有关,还与水含量有关[62]。对于可以与水互溶的ILs,在含水量较少时,水分子在IL 的阴阳离子周围形成一个独特的溶剂化外壳并削弱它们的相互作用。随着水的比例增加,水分子之间相互连接形成巨大的渗透网络,使得离子液体阴阳离子对解离程度加深。可见,H2O 的加入会改变ILs 的原有结构和相互作用,这些分子内部的变化会改变ILs 的热力学性质。吸收过程中传质效率、设备投资和能耗与吸收剂的黏度和气体吸收率息息相关。
H2O 的加入可以降低ILs的黏度,并且随着体系H2O 摩尔分数的增加黏度下降得更明显。2000 年,Seddon 等[63]报道了对于20℃的H2O-[BMIM][BF4]体系,体系黏度随着水的摩尔分数增加而呈抛物线形下降。当水的摩尔分数从0升至0.1时,体系的黏度从150 mPa·s 降低至110 mPa·s,摩尔分数增加至0.6时,体系黏度只有10 mPa·s。文中对原因进行了讨论,提出IL 黏度的降低是由于水的加入减小了离子间静电相互作用。Domańska 等[64]测量了298.15~348.15 K 范围内[BMIM][SCN]的黏度随H2O 浓度的变化,结果发现,在较低温度下,体系的黏度对水含量变化更敏感,而高温下由于纯[BMIM][SCN]与H2O的黏度差异不大,随着体系中水摩尔分数增加黏度下降不显著。Tanner 等[65]在对胆碱和香草叶酸基的ILs 的研究中发现,在纯IL 中加入水时物系黏度几乎直线下降,但是在IL摩尔分数为0.3~0.5时体系黏度基本没有变化,这与其他ILs 黏度的连续变化趋势不同,可能是由于水的加入体系内其他相互作用(静电相互作用和离子配对作用除外)对黏度有影响。
H2O 一般通过分解效应、稀释效应和加强效应对ILs 中待干燥气体溶解度造成影响。分解效应是指H2O 使得ILs 发生化学分解,如氯铝酸盐类ILs 遇到水分易发生分解,[PF6]-类ILs 接触水分甚至会释放有毒的氟化氢气体。稀释效应是指H2O与待干燥气体竞争ILs 的结合位点,从而降低气体溶解度。在[EMIM][TF2N]中添加质量分数2%的水后CO 和H2的溶解度相比于纯IL 分别下降了40%和25%左右[50]。在[EMIM][CF3SO3]中添加质量分数10%的水较于纯IL,CO2溶解度下降了10%左右,类似地在[BMIM][Ac]中添加水也能大幅度降低CO2的溶解度[66-67]。加强效应则是H2O 增强了某些气体的化学吸收。当水存在时,可能会促进CO2与氨基络合生成氨基甲酸酯,从而使CO2溶解度增加[68]。在一些情况下H2O对气体在ILs中的溶解度基本没有影响,这可能是稀释效应和加强效应相互抵消的结果。
3.4 ILs脱水工艺
ILs 脱水工艺流程如图7 所示。ILs 和待干燥气体在吸收塔中逆流接触,塔底富水的ILs 通过换热器加热后通往闪蒸罐进行再生,罐顶含有水分的混合气体经冷却后送往回收中心,罐底的ILs 预热塔釜液后经过冷却器冷却至指定温度送往塔顶继续进行吸收。全流程较短,主要设备是吸收塔,可对其工艺参数进行优化调节。一般而言,吸收塔理论板数越多,吸收剂进料量越大,操作压力越高,塔顶出口气体水含量越少[69],同时要考虑操作费用、能耗和塔壁强度随着这些操作参数的变化,不断进行优化才能找到满足产品要求的最佳操作条件。
ILs脱水工艺延续了传统气体吸收工艺特色,但是相对传统的有机溶剂干燥过程有独特的优点。首先,设备投资和能耗可以降低很多。其吸收剂再生过程只在闪蒸罐进行闪蒸,而传统的有机溶剂如TEG 等则需要在精馏塔中进行蒸馏才能循环回吸收塔再次进行吸收[70],精馏塔的造价远高于闪蒸罐,由于再沸器和冷凝器使得三甘醇干燥工艺能耗超过了ILs 干燥工艺。其次,ILs 脱水工艺的气体干燥效果较好。很多ILs 亲水性非常强,水在一些ILs 中的亨利系数甚至小于0.001,在理论板数较少的情况下,天然气经ILs干燥后含水量往往能达到600×10-6(摩尔分数,下同)左右,而TEG 在相同流程条件下只能达到1600×10-6[71]。此外,ILs 损失量少。ILs 在常温下基本不挥发,在吸收塔中相对传统有机溶剂损失量少得多[72]。表1 是在化工软件Aspen 中对CH4和CO2干燥过程的流程模拟结果,由表可知在相同的气体进料条件下,使用[EMIM][TF2N]作为吸收剂相对TEG 流程产品气体含水量更低,设备的热负荷和冷负荷也大幅度下降。
ILs干燥气体工艺除了可以在吸收塔中进行,还可与其他技术结合。很多ILs 黏度比较大,在普通板式塔或填料塔中传质效率不高且压降比较大。Wu 等[73]讨论了在旋转填料床(RPB)中利用离子液体[BMIM][Ac]干燥空气的可能性。加入RPB 的ILs在离心力作用下被填充网撕裂为细小的液滴和薄膜,促进了传质。研究结果显示经ILs 干燥后空气露点相比于用TEG 干燥有了大幅度提高,说明ILs干燥效果优于TEG。
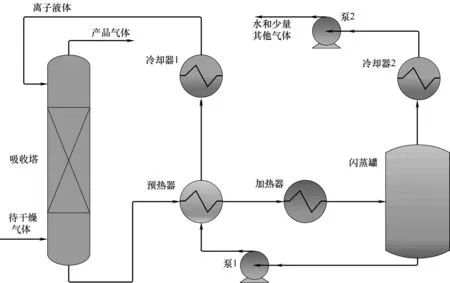
图7 ILs用于气体脱水工艺流程Fig.7 Flow diagram of ILs for gas dehydration process

表1 CH4和CO2干燥过程的流程模拟结果[38,71]Table 1 Process simulation results for CH4 and CO2 drying processes[38,71]
4 总结与展望
目前,ILs用于气体脱水领域遇到的问题主要集中在:现有的关于ILs 的热力学模型适用范围较窄,有些模型对关键组分与ILs 之间的热力学性质预测不准;不同的溶解度实验方法对同一体系的研究结果存在一些差异,还未系统研究评定各方法的准确性;现在报道的脱水工艺使用的ILs 种类较少,阳离子仅限于咪唑类离子,阴离子为[TF2N]-、[BF4]-等常见阴离子;现在很多研究对气体的最终干燥效果考虑得比较多,忽略了如比热容、黏度、表面张力、热传导性等性质,而这些热力学性质不仅影响吸收的传递效果,还对流程的设备投资和能耗有重要影响。以后的研究可以从这几个方面进行展开:(1)将多种预测型分子热力学模型进行结合以提高其应用范围和预测准确性(例如将COSMO-UNIFAC模型嵌入著名的Aspen Plus和ADF模拟软件之中);(2)建立吸收塔内ILs 吸收水分的传质动力学模型;(3)针对溶质和水的性质给ILs 增加功能化基团以增强脱水性,或者将ILs 与金属有机骨架材料(MOF)、有机金属骨架材料(COF)等新型材料结合使其获得更好的分离性能;(4)借助量子力学和分子动力学方法探究ILs 与水分子之间独特的相互作用;(5)设计脱水工艺时将ILs 的黏度、比热容、表面张力等热力学性质纳入能耗和费用计算之中。
符 号 说 明
e——自然常数,其值约为2.71828
Fi——UNIFAC基团i的表面分数
Q——基团表面积参数
q——范德华表面积参数
R——基团体积参数
r——范德华体积参数
T——热力学温度,K
Vi——UNIFAC基团i的体积分数
vk——基团k在分子中的数目
Xm——基团m在混合物中的分率
xi——组分i摩尔分数
x∞——摩尔分数稳定值
β——吸收速率常数
Гk——组分k的剩余活度系数
γi——组分i的活度系数
θ——基团表面积分数
Ψnm——基团n和基团m的相互关联参数上角标
bin——二元体系
tern——三元体系
离子液体阴阳离子名称
[Ac]-——acetate
[BF4]-——tetrafluoroborate
[BMIM]+——1-butyl-3-methyl-imidazolium
[CF3SO3]-——mesylate
[CHO]-——cholate
[EMIM]+——1-ethyl-3-methyl-imidazolium
[HMIM]+——1-(2-hydroxyethyl)-3-methyl-imidazolium
[OMIM]+——1-octyl-3-methyl-imidazolium
[P4444]+——tetrabutylphosphonium
[PF6]-——hexafluorophosphate
[SCN]-——thiocyanate
[TCB]-——tetracyanoborate
[TFA]-——trifluoroacetate
[TF2N]-——bis(trifluoromethylsulfonyl)-amide
[TFO]-——trifuoromethanesulfonate
[TMPP]-——bis(2,4,4-trimethylpentyl)phosphinate

