从免疫炎性损伤角度探讨5种清热解毒药物抗流感的机制及其临床意义*
李雅莉 徐红日 曹鸿云 王虹虹 程 淼 王成祥李 猛 刘国星 刘 畅 刘 通 韩思维
(1.北京中医药大学,北京 100029;2.北京中医药大学第三附属医院,北京 100029;3.北京中医药大学东直门医院,北京 100700;4.陕西省中医院,陕西 西安 710003)
流行性感冒,可参照中医时行感冒辨证论治。自2009年新型甲型H1N1流感大流行以来,治疗流感的新型药物与疫苗的研究受到越发广泛的关注。近年来开展了大量的中医药治疗流感的实验研究,筛选出了多种具有显著抗流感作用的单味中药及中药复方[1],证明了中医药治疗流感的作用不仅能直接抗流感病毒[2-4],还可以调节流感病毒感染机体的免疫功能[5-6]。
众所周知,流感病毒感染机体后可导致急性免疫炎性损伤。感染免疫调控网络中的炎性细胞因子参与其中。肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)等为代表的促炎性细胞因子的过度释放可导致靶器官严重的炎性损伤,引发一系列脏器功能损伤,甚至多脏器功能衰竭。前期研究中发现,笔者所在医院治疗流感的有效处方益气清瘟解毒合剂所含清热解毒中药在流感病毒感染后导致的急性外感热病的极期,能够清除炎性细胞因子,并截断扭转,证实了急性外感热病极期把住气分关的重要性,这有利于防止“逆传心包”等危重证候(并发症)的发生,同时有利于缩短病程[7-8]。清热解毒代表药物如黄芩、板蓝根、白头翁、虎杖、白花蛇舌草在流感病毒感染不同时相各自发挥什么样的免疫调节作用?其作用强度分别如何?上述清热解毒代表药物抗流感的作用在流感整个病程中的哪一时相各自发挥得最好?为进一步探讨和回答上述问题,本课题组设计和完成了相关研究。现将其研究结果报告如下。
1 材料与方法
1.1 实验动物 BALB/cAnN小鼠,动物级别为SPF/VAF,雄性,体质量18~22 g,共224只,购自北京维通利华实验技术有限公司,合格证号:SCXK(京)2007-0001。购进动物后适应性饲养3 d。
1.2 试药与仪器 黄芩、板蓝根、白头翁、虎杖、白花蛇舌草,5种药物采用水煮提取工艺制成颗粒剂,制造工艺由北京康仁堂药业有限公司协助完成。药物颗粒量及含生药量情况:黄芩1 g,相当于饮片量10 g;板蓝根1 g,相当于饮片量10 g;白头翁0.5 g,相当于饮片量10 g;虎杖0.5 g,相当于饮片量10 g;白花蛇舌草1 g,相当于饮片量20 g。乙醚、0.9%氯化钠注射液(中国大冢制药有限公司);小鼠TNF-α、IL-1、IL-6、IL-10、γ干扰素(IFN-γ)ELISA试剂盒,购于尚柏生物医学技术(北京)有限公司。YX型实验动物洁净柜(北京文慧净化设备厂);电子天平(JA3003,上海越平科学仪器有限公司);低温离心机(Heraeus Labofuge 400R);微量可调移液器(DRAGON);组织匀浆机;酶标仪(Multiskan MK3,THERMO)。
1.3 病毒株 流感病毒亚洲甲型鼠肺适应株(FM1),由教育部重点实验室北京中医药大学中医药防治病毒性疾病实验室提供。鸡胚传代后,血凝滴度为1∶512,小鼠LD50为10-5.4,-75℃冻存备用。
1.4 分组与造模 将小鼠随机分为空白对照组、模型对照组、黄芩组、板蓝根组、白头翁组、虎杖组、白花蛇舌草组,每组32只。各组按流感病毒感染后第1日、3日、5日、7日不同时相随机分为4小组,每小组8只。造模方法:用乙醚轻度麻醉小鼠后,空白对照组以0.9%氯化钠注射液滴鼻,每次25 μL。其余各组以25 μL FM1株病毒液滴鼻,感染浓度为10-4。
1.5 给药方法 感染流感病毒30 min后给药,按标准体质量换算成小鼠的每日用药剂量,每日灌胃1次,每次给药0.1 mL/10 g;正常空白组以及病毒感染模型对照组根据体质量灌服等量0.9%氯化钠注射液,每日灌胃1次,每次给0.9%氯化钠注射液0.1 mL/10 g。
1.6 标本采集与检测 于感染流感病毒后第1日、3日、5日、7日摘眼球放血处死小鼠,留取小鼠血液,分离血清,-20℃冰箱中保存待检。采用双抗体夹心ELISA法检测小鼠血清TNF-α、IL-1、IL-6、IL-10、IFN-γ含量。检测程序按照试剂盒说明书进行。以A450值为纵坐标,以标准品浓度为横坐标,绘制标准曲线。根据小鼠血清的A450值计算出相应细胞因子的浓度。
1.7 统计学处理 应用SPSS19.0统计软件。计量资料以()表示,采用单因素方差分析检验组间以及组内差异。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血清TNF-α含量比较 见表1。模型组血清TNF-α含量在造模后各时相与空白对照组比较均升高,在感染后第3~5日与空白对照组比较,差异有统计学意义(P<0.05)。黄芩组、板蓝根组、白头翁组在流感病毒感染各时相血清TNF-α含量均降低,并于感染后第3日,黄芩组、板蓝根组血清TNF-α含量显著低于模型对照组(P<0.01),白头翁组血清TNF-α含量明显低于模型对照组(P<0.05);虎杖组血清TNF-α含量在感染后第1~5日有降低趋势,但与模型对照组比较,差异无统计学意义(P>0.05);白花蛇舌草组血清TNF-α含量在感染后各时相与模型对照组比较,差异无统计学意义(P>0.05)。
表1 各组小鼠血清TNF-α含量比较(±s)
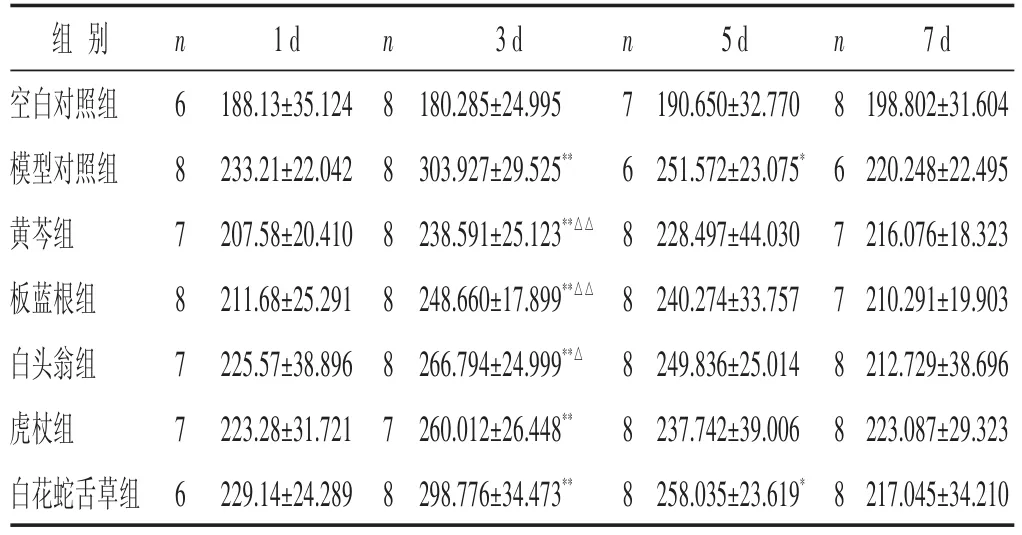
表1 各组小鼠血清TNF-α含量比较(±s)
与空白对照组比较,*P<0.05,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01。下同
组别空白对照组模型对照组黄芩组板蓝根组白头翁组虎杖组白花蛇舌草组n 6 8 7 8 7 7 6 1 d 188.13±35.124 233.21±22.042 207.58±20.410 211.68±25.291 225.57±38.896 223.28±31.721 229.14±24.289 n 8 8 8 8 8 7 8 3 d 180.285±24.995 303.927±29.525**238.591±25.123**△△248.660±17.899**△△266.794±24.999**△260.012±26.448**298.776±34.473**n 7 6 8 8 8 8 8 5 d 190.650±32.770 251.572±23.075*228.497±44.030 240.274±33.757 249.836±25.014 237.742±39.006 258.035±23.619*n 8 6 7 7 8 8 8 7 d 198.802±31.604 220.248±22.495 216.076±18.323 210.291±19.903 212.729±38.696 223.087±29.323 217.045±34.210
2.2 各组小鼠血清IL-1含量比较 见表2。模型组血清IL-1含量在造模后各时相与空白对照组比较均升高,在感染后第1~5日与空白对照组比较,差异有统计学意义(P<0.01)。黄芩组、白头翁组在感染后各时相血清IL-1含量均降低,此两组在感染后第3日小鼠血清IL-1含量明显低于模型对照组(P<0.05);板蓝根组、虎杖组血清IL-1含量在感染后各时相有降低趋势,但差异无统计学意义(P>0.05);白花蛇舌草组血清IL-1含量在感染后各时相与模型对照组比较,差异无统计学意义(P>0.05)。
表2 各组小鼠血清IL-1含量比较(±s)
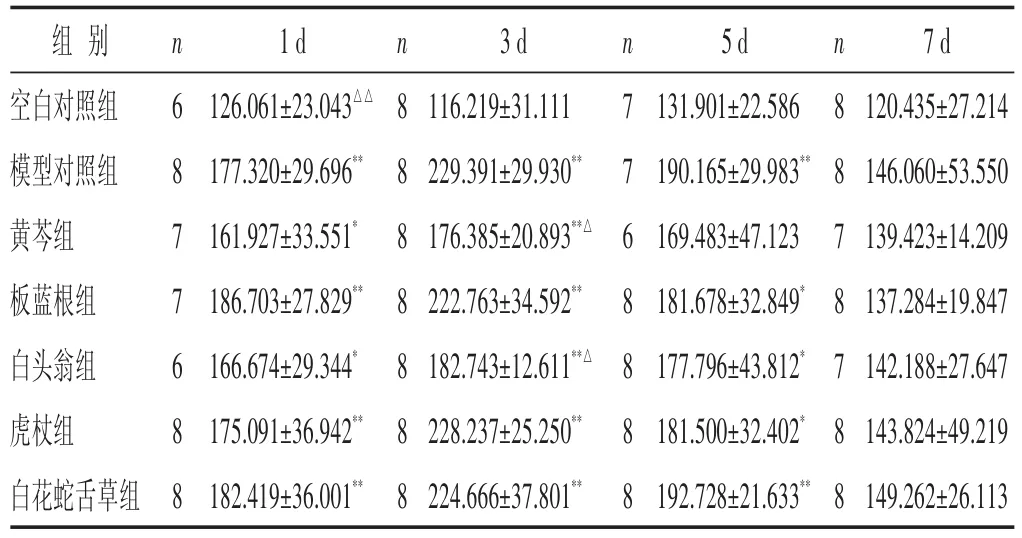
表2 各组小鼠血清IL-1含量比较(±s)
组别空白对照组模型对照组黄芩组板蓝根组白头翁组虎杖组白花蛇舌草组n 6 8 7 7 6 8 8 1 d 126.061±23.043△△177.320±29.696**161.927±33.551*186.703±27.829**166.674±29.344*175.091±36.942**182.419±36.001**n 8 8 8 8 8 8 8 3 d 116.219±31.111 229.391±29.930**176.385±20.893**△222.763±34.592**182.743±12.611**△228.237±25.250**224.666±37.801**n 7 7 6 8 8 8 8 5 d 131.901±22.586 190.165±29.983**169.483±47.123 181.678±32.849*177.796±43.812*181.500±32.402*192.728±21.633**n 8 8 7 8 7 8 8 7 d 120.435±27.214 146.060±53.550 139.423±14.209 137.284±19.847 142.188±27.647 143.824±49.219 149.262±26.113
2.3 各组小鼠血清IL-6含量比较 见表3。模型组造模后各时相血清IL-6含量与空白对照组比较均升高,在感染后第3~5日与空白对照组比较,差异有统计学意义(P<0.05或P<0.01)。黄芩组、板蓝根组在流感病毒感染后各时相血清IL-6的含量均降低,且第3~5日小鼠血清IL-6含量明显低于模型对照组(P<0.05);白头翁组在流感病毒感染后第3日小鼠血清IL-6含量明显低于模型对照组(P<0.05);虎杖组在感染后第1日、第5~7日与模型对照组比较,血清IL-6含量有下降趋势,但差异无统计学意义(P>0.05);白花蛇舌草组在感染后第3日血清IL-6含量明显降低,与模型对照组差异有统计学意义(P<0.05)。
表3 各组小鼠血清IL-6含量比较(±s)
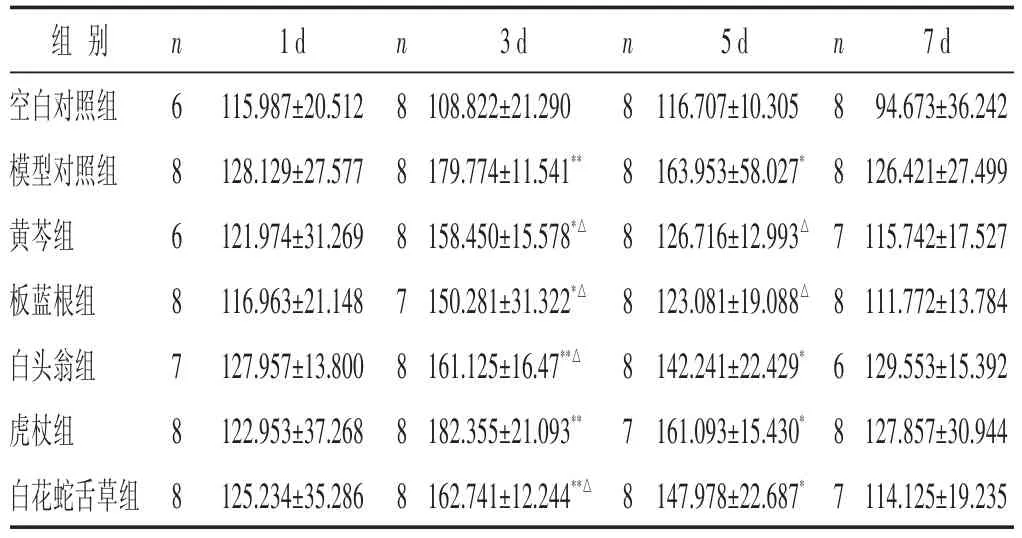
表3 各组小鼠血清IL-6含量比较(±s)
组别空白对照组模型对照组黄芩组板蓝根组白头翁组虎杖组白花蛇舌草组n 6 8 6 8 7 8 8 1 d 115.987±20.512 128.129±27.577 121.974±31.269 116.963±21.148 127.957±13.800 122.953±37.268 125.234±35.286 n 8 8 8 7 8 8 8 3 d 108.822±21.290 179.774±11.541**158.450±15.578*△150.281±31.322*△161.125±16.47**△182.355±21.093**162.741±12.244**△n 8 8 8 8 8 7 8 5 d 116.707±10.305 163.953±58.027*126.716±12.993△123.081±19.088△142.241±22.429*161.093±15.430*147.978±22.687*n 8 8 7 8 6 8 7 7 d 94.673±36.242 126.421±27.499 115.742±17.527 111.772±13.784 129.553±15.392 127.857±30.944 114.125±19.235
2.4 各组小鼠血清IL-10含量比较 见表4。模型组小鼠血清IL-10含量在造模后各时相与空白对照组比较逐渐升高,感染后第5~7日与空白对照组比较明显升高(P<0.05)。黄芩组在感染后第1~5日血清IL-10的含量均升高,且第5日小鼠血清IL-10含量明显高于模型对照组(P<0.05);板蓝根组、虎杖组在流感病毒感染后第1日小鼠血清IL-10的含量明显高于模型对照组(P<0.01),在感染后第3~7日血清IL-10含量与模型对照组比较,差异无统计学意义(P<0.05);白头翁组在感染后第3日小鼠血清IL-10的含量明显高于模型对照组(P<0.05);白花蛇舌草组在感染后第1~3日与模型对照组比较血清IL-10的含量有升高趋势,但差异无统计学意义(P>0.05)。
表4 各组小鼠血清IL-10含量比较(±s)
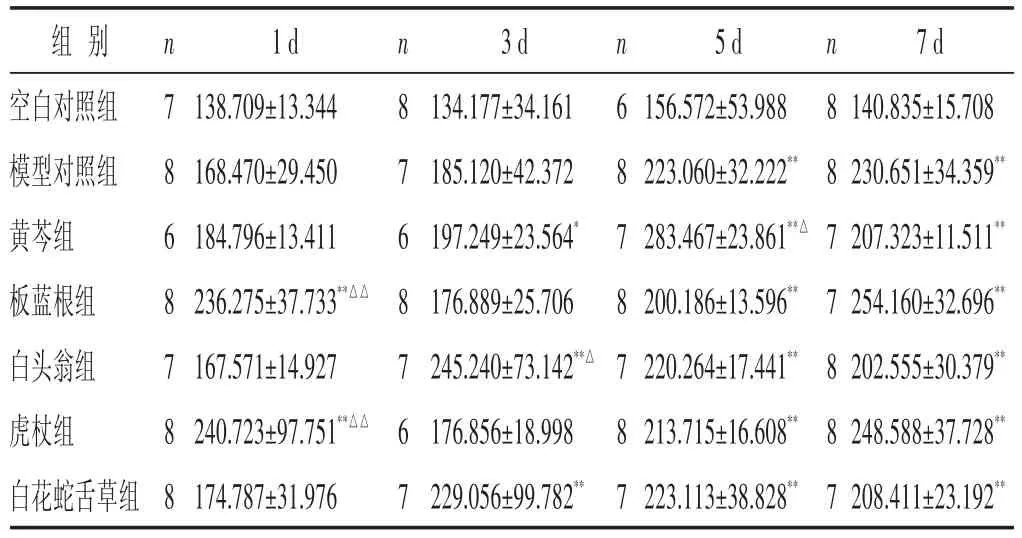
表4 各组小鼠血清IL-10含量比较(±s)
组别空白对照组模型对照组黄芩组板蓝根组白头翁组虎杖组白花蛇舌草组n 7 8 6 8 7 8 8 1 d 138.709±13.344 168.470±29.450 184.796±13.411 236.275±37.733**△△167.571±14.927 240.723±97.751**△△174.787±31.976 n 8 7 6 8 7 6 7 3 d 134.177±34.161 185.120±42.372 197.249±23.564*176.889±25.706 245.240±73.142**△176.856±18.998 229.056±99.782**n 6 8 7 8 7 8 7 5 d 156.572±53.988 223.060±32.222**283.467±23.861**△200.186±13.596**220.264±17.441**213.715±16.608**223.113±38.828**n 8 8 7 7 8 8 7 7 d 140.835±15.708 230.651±34.359**207.323±11.511**254.160±32.696**202.555±30.379**248.588±37.728**208.411±23.192**
2.5 各组小鼠血清IFN-γ含量比较 见表5。模型组血清IFN-γ含量在感染后各时相与空白对照组比较均升高,感染后第5日达峰,与空白对照组比较,有显著性差异(P<0.05)。黄芩组在感染后各时相血清IFN-γ含量与模型对照组比较均有升高趋势,但差异无统计学意义(P>0.05);板蓝根组在流感病毒感染后第3~5日,血清IFN-γ含量与模型对照组比较明显升高(P<0.05);白头翁组在感染后第5~7日血清IFN-γ含量与模型对照组比较有升高趋势,但差异无统计学意义(P>0.05);虎杖组、白花蛇舌草组在感染后第5日血清IFN-γ含量与模型对照组比较明显升高(P<0.05)。
表5 各组小鼠血清IFN-γ含量比较(±s)
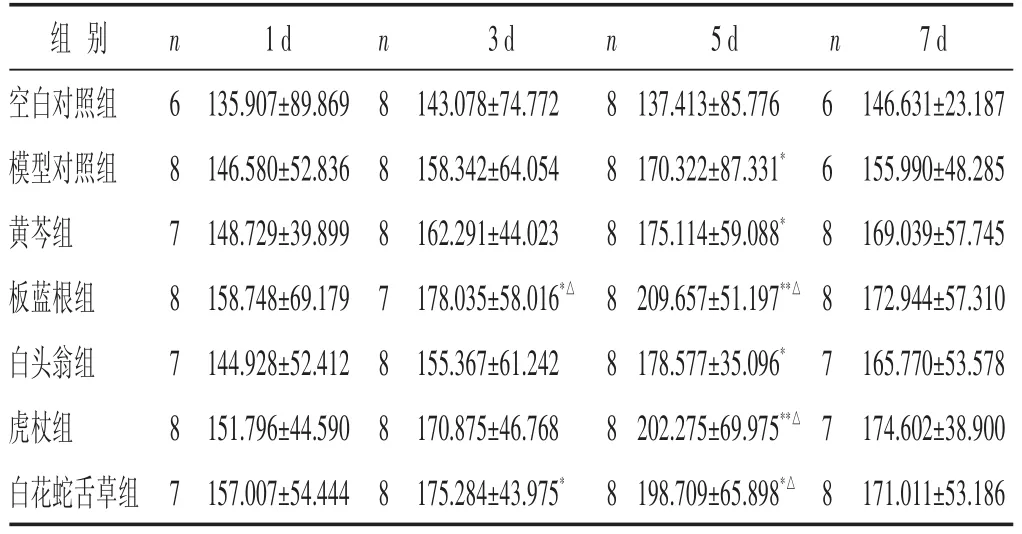
表5 各组小鼠血清IFN-γ含量比较(±s)
组别空白对照组模型对照组黄芩组板蓝根组白头翁组虎杖组白花蛇舌草组n 6 8 7 8 7 8 7 1 d 135.907±89.869 146.580±52.836 148.729±39.899 158.748±69.179 144.928±52.412 151.796±44.590 157.007±54.444 n 8 8 8 7 8 8 8 3 d 143.078±74.772 158.342±64.054 162.291±44.023 178.035±58.016*△155.367±61.242 170.875±46.768 175.284±43.975*n 8 8 8 8 8 8 8 5 d 137.413±85.776 170.322±87.331*175.114±59.088*209.657±51.197**△178.577±35.096*202.275±69.975**△198.709±65.898*△n 6 6 8 8 7 7 8 7 d 146.631±23.187 155.990±48.285 169.039±57.745 172.944±57.310 165.770±53.578 174.602±38.900 171.011±53.186
3 讨 论
流感病毒感染人体后,介导机体免疫系统产生大量的促炎性细胞因子,可诱发细胞因子风暴,导致全身炎症反应综合征(SIRS),造成靶器官广泛的病理损伤,出现ARDS、休克及多脏器功能衰竭[9-10]。流感病毒侵入机体后,激活单核-巨噬细胞释放TNF-α、IL-1、IL-6、IL-10等炎性细胞因子。前三者协同作用诱导免疫细胞表达,促进炎症的发生,引起严重组织损伤与血液循环障碍,引起休克和脏器功能衰竭[11-12]。IL-10可抑制抗原提呈及促炎介质生成,从而抑制过强的免疫反应及由此导致的组织损伤,同时IL-10可增强“清道夫”的功能,并有助于诱导免疫耐受[13]。
在流感病毒FM1感染后第1日,板蓝根和虎杖能够明显升高血清IL-10的含量,说明板蓝根、虎杖可能在感染初期抑制促炎性细胞因子的过度释放,诱导机体免疫耐受,从而减轻细胞因子风暴所造成的组织损伤。
在流感病毒FM1感染后第3日,模型对照组血清TNF-α、IL-1、IL-6的含量达峰值,而黄芩组、板蓝根组、白头翁组在此时相能够显著降低血清TNF-α的含量,黄芩组和白头翁组在此时相能够明显降低血清IL-1的含量,黄芩组、板蓝根组、白头翁组、白花蛇舌草组在此时相能够明显降低血清IL-6的含量,白头翁组在此时相能够显著升高血清IL-10的含量。实验结果说明,黄芩能够在感染后第3日,即急性外感热病极期,可显著降低血清促炎性细胞因子TNF-α、IL-1、IL-6的含量,抑制全身炎症反应,有利于防止严重并发症的发生。板蓝根在流感病毒感染后第3日,可显著降低血清促炎性细胞因子TNF-α、IL-6的含量,同时显著增加血清IFN-γ含量,并且在感染后第1日可显著增加血清抗炎性细胞因子IL-10的含量,说明板蓝根不仅可在感染初期发挥抗病毒作用,并在急性外感热病极期可显著抑制血清促炎性细胞因子的大量分泌,有利于抑制过度的免疫炎性损伤。白头翁能够在流感病毒感染第3日,显著降低血清促炎性细胞因子TNF-α、IL-1、IL-6的含量,显著增加血清抗炎性细胞因子IL-10的含量,提示在急性外感热病极期,白头翁能够显著抑制全身炎症反应,有利于抑制过度的免疫炎性损伤。白花蛇舌草能够在流感病毒感染第3日,显著降低血清中促炎性细胞因子IL-6的含量,有利于抑制过度的免疫炎性损伤。
流感病毒FM1感染后第5日,模型对照组血清TNF-α、IL-1、IL-6含量逐渐下降,IL-10、IFN-γ逐渐升高。在此时相,黄芩和板蓝根可明显降低血清IL-6的含量,黄芩亦可显著升高血清IL-10的含量,板蓝根、虎杖、白花蛇舌草可明显升高血清IFN-γ的含量。由此可知,在流感病毒FM1感染后第5日,黄芩和板蓝根仍然能够显著降低血清中促炎性细胞因子的含量,有利于抑制全身炎症反应,抑制过度的炎性损伤。黄芩在此时相还能显著增加血清中IL-10的含量,更加有利于抑制靶器官过度的炎性损伤。在此时相,板蓝根、虎杖、白花蛇舌草依然具有抑制流感病毒的复制和扩散的作用,具有抗病毒作用。
在流感病毒FM1感染后第7日,即急性外感热病后期,感染机体的细胞因子重新趋于稳态,免疫调控网络中的细胞因子和炎症介质逐渐恢复平衡状态,清热解毒代表中药与模型对照组之间无显著性差异。
综上所述,流感病毒感染机体后,不同清热解毒类中药对感染免疫调控的作用不尽相同。黄芩味苦,性寒,归肺、胆、胃、大肠经,具有清热燥湿、泻火解毒、止血、安胎等功效。现代药理学研究亦证明,黄芩含有黄酮类化合物、挥发油及多糖等多种成分,具有抗炎、抗菌、抗病毒、抗肿瘤、抗过敏等药理作用[14]。黄芩在感染后第3~5日,即急性外感热病极期,能够显著抑制免疫炎性损伤,该作用在诸清热解毒类药物中最为显著。板蓝根味苦,性寒,有清热解毒、凉血利咽之功,其主要化学成分板蓝根多糖、凝集素等具有抗流感病毒、抗菌、消炎等作用[15-16]。本实验结果表明,板蓝根在流感病毒感染后早期即可显著抑制炎性反应,在流感病毒感染后3~5 d,即急性外感热病极期,具有显著的抑制流感病毒的作用,且能够较显著地抑制免疫炎性损伤。白头翁性平,味微苦辛,具有清热解毒、止咳化痰、活血散瘀之功。现代药理研究显示,白头翁含有三萜酸、木脂素、香豆素等化学成分,具有抗炎、抑菌、抗氧化等作用[17]。本实验结果显示,白头翁在流感病毒感染后第3日能够显著抑制免疫炎性损伤。虎杖苦寒,具有清热解毒、利胆退黄、活血祛瘀、祛痰止咳等功效,主要含有蒽醌类、二苯乙烯类、黄酮类、香豆素类以及一些脂肪酸类化合物[18]。现代药理学研究表明,虎杖具有抗炎、抗病毒等作用[10]。本实验结果可知,虎杖在流感病毒感染第1日,即在急性外感热病初期具有抑制免疫炎性损伤的作用,在流感病毒感染第5日具有抑制流感病毒的作用。白花蛇舌草微苦、甘寒,具有清热解毒、利湿通淋等作用,其化学成分主要有萜类、黄酮类、蒽醌类、多糖类等化合物,有抗肿瘤、抗炎、抗菌等药理作用[19]。本实验结果示,白花蛇舌草在流感病毒感染第3日具有抑制免疫炎性损伤的作用,而在感染后第5日具有抗病毒作用。

