高速逆流色谱分离纯化裂壶藻油脂中的DHA
吴兵兵 荣 辉 杨贤庆 陈胜军 吴燕燕 邓建朝 胡 晓
(1 中国水产科学研究院南海水产研究所 国家水产品加工技术研发中心农业农村部水产品加工重点实验室 广州510300
2 上海海洋大学食品学院 上海201306)
二十二碳六烯酸(docosahexenoic acid,DHA),俗称脑黄金,是ω-3系长链多不饱和脂肪酸,是人体大脑的重要组成部分,对于神经系统具有重要功能[1-2]。1972年英国Michel[3]教授提出,缺乏DHA等多不饱和脂肪酸,将会造成大脑发育的障碍。有研究表明,DHA可以促进婴幼儿视力以及脑细胞的发育,显著提高婴幼儿的智力发育水平,提高青少年记忆力[4-6]。此外,DHA对成年人也具有重要的保健作用。它能够降血压、降血脂、降胆固醇,延缓衰老,同时在预防老年痴呆、抗癌、抑制肿瘤、抗炎症等方面也有明显的作用[7-9]。DHA相关研究越来越受到人们的关注。目前DHA的来源主要是鱼油和微藻油。天然鱼油中DHA以甘油三酯形式存在,由于含量偏低,约12%,因此工业上大多采用转酯化的方法将鱼油转酯化成鱼油乙酯以丰富鱼油中DHA的含量[10-11]。另外,鱼油通常具有较难去除的鱼腥味,使一些人不爱食用。目前作为生产DHA原料的藻种有隐甲藻、裂壶藻等。这些天然微藻中DHA也是以甘油三酯的形式存在,含量较高,其中裂壶藻DHA含量高达40%以上[12]。微藻油没有腥味,部分微藻中脂肪酸组成较为简单,有利于DHA的进一步分离纯化。相关产油微藻的筛选及培养、油脂提取以及微藻油的分离纯化成为人们的研究热点[13-14]。
美国Ito教授在上世纪八十年代初发明了高速逆流色谱(High-speed countercurrent chromatography,HSCCC)[15-16],很快便被广泛应用在生物化学、医药学、食品、地质、环境、农业、材料、化工、海洋生物等众多领域。HSCCC采用的固定相和流动相均为液体,没有不可逆吸附,物质的分离是依据其在互不相溶的两相液体中的分配系数的差异而实现,具有分离纯度高,样品回收率高,适用范围广等优点[17]。近年来随着仪器、设备的不断改进和完善,相关研究的不断深入,HSCCC被应用到大分子物质的分离纯化中,如蛋白质、脂肪酸、色素等[18-19]。Cao等[20]利用HSCCC对葡萄籽中的油脂成分进行分离,最终得到纯度达99%的亚油酸;孙磊等[21]利用HSCCC技术对共轭亚油酸(CLA)及其异构体进行分离,采用的溶剂系统为正己烷-乙腈(1∶1,V/V),最终得到的共轭亚油酸的比例分别高达97.05%和97.73%。由此可见,利用HSCCC可对脂肪酸进行分离纯化。本研究利用HSCCC分离纯化裂壶藻中DHA,为其的进一步开发利用提供技术支持。
1 材料与方法
1.1 材料和设备
裂壶藻:由本实验室利用松花粉垂钓法对采自广州南沙红树林腐烂树叶进行分离纯化获得,经鉴定为裂壶藻,保存于本实验室藻种库中。
正庚烷、甲醇、乙酸乙酯、乙醚、硫酸、甲酸均为分析纯级,乙腈为色谱纯级,广州华屿欣实验器材有限公司;DHA标准品,美国Nu-chekperp有限公司;所用水均为超纯水。
TBE-300B高速逆流色谱仪,上海同田生物技术有限公司;LC-20AD高效液相色谱仪,日本岛津公司;GCMS-QP2010 Plus气相色谱-质谱联用仪,日本岛津公司;UV1000紫外-可见光检测器,上海三为科学仪器有限公司;HWS-24电热恒温水浴锅,上海一恒科学仪器有限公司;EYELAN-1000旋转蒸发仪,日本EYELA有限公司;SQ510C立式压力蒸汽灭菌器,日本YAMATO公司;ZQTY-70F台式全温震荡培养箱,上海知楚仪器有限公司;Avanti J-26XP高效离心机,贝克曼库尔特有限公司;SW-CJ-1FD超净工作台,苏州净化设备有限公司;Alpha1-4冷冻干燥机,德国Christ有限公司;DC-0506低温恒温水槽,南京舜玛仪器有限公司。
1.2 裂壶藻的培养和收集
培养基(1L):葡萄糖25 g,酵母提取物5 g,细菌学蛋白胨10 g,海水晶30 g。
培养条件:温度28℃,转速180 r/min,培养时间96 h,pH 6.8。
将培养液在8 000 r/min,温度4℃的条件下离心10min,收集底部藻泥,在-20℃条件下预冻12 h,然后利用冷冻干燥机在-45℃条件下处理24 h,得到裂壶藻藻粉。
1.3 微藻油的提取和皂化处理
称量5 g裂壶藻干藻粉,采用氯仿-甲醇法[22]提取油脂。
称量500mg裂壶藻油,加入25mL 0.5mol/L氢氧化钾-甲醇溶液在70℃下水浴处理1.5 h,用体积分数为20%的硫酸水溶液调pH值至3,得到酸性混合液[23]。用等体积的乙醚萃取酸性混合液3次,收集乙醚相,旋转蒸发除去乙醚,用20mL两相溶剂(上、下相比例为1∶1)溶解得到脂肪酸粗品,待HSCCC分离。同时取少量脂肪酸粗品进行HPLC分析。
1.4 HSCCC溶剂体系的选择
应用HPLC测定目标组分DHA在两相溶剂体系中的分配系数K值,根据K值来选择合适的溶剂体系。将DHA标准品溶解在两相溶剂体系中,取上相和下相分别进行HPLC检测。以上相中DHA峰面积与下相中DHA峰面积比计算K值。待测溶剂体系为正庚烷-乙酸乙酯-甲醇-水(5∶1∶5∶1,8∶1∶8∶1,10∶1∶10∶1,12∶1∶12∶1,15∶1∶15∶1,V/V/V/V),正庚烷-甲醇-水(5∶3∶1,5∶4∶1,5∶5∶1,5∶6∶1,5∶7∶1,V/V/V)。
1.5 HSCCC分离纯化DHA
以10mL/min速度将上相泵入螺线管,充满后,将螺线管的转速调到正转900 r/min,以2mL/min泵入下相,平衡后,取少量DHA标准品溶于溶剂体系中作为样品,经进样阀注入螺线管,采用紫外检测器在210 nm处检测,确定DHA的出峰时间。参考1.3节对油脂进行皂化处理。在一定的参数条件下利用HSCCC进行分离,将与DHA标准品出峰时间一致的峰所对应的物质收集后进行HPLC检测,确定其纯度和回收率。随后,将收集的样品利用HSCCC进行二次分离,进一步提高其纯度。收集后利用HPLC检测确定其纯度和回收率。
1.6 单因素条件对DHA纯度的影响
通过单因素试验考察各因素(固定水平温度15℃、流速3mL/min、转速900 r/min、进样量180 mg)对DHA纯度的影响。各因素设置为:温度:5,10,15,20,25℃;流速:2,2.5,3,3.5,4mL/min;转速:800,850,900,950,1 000 r/min;进样量:36,108,180,252,360mg。通过外接低温恒温水槽控制温度。研究某一单因素时,其余因素均取固定水平值,以HPLC检测收集DHA的纯度作为试验指标。
1.7 HSCCC分离条件的响应面分析
根据Box-Benhnken的中心组合试验原理[24],采用响应面法在三因子三水平上对裂壶藻油中DHA的HSCCC分离纯化条件进行优化,试验因子和水平见表1。
1.8 HPLC检测分析
收集分离纯化后的DHA样品进行HPLC检测,采用面积归一法确定其纯度。HPLC色谱柱为Athena C18-WP,100A(4.6mm×250 mm)分析色谱柱,流动相A为超纯水(含0.05%的甲酸),流动相B为乙腈。洗脱方法为先用50%乙腈梯度洗脱20min至l00%,再用100%乙腈洗l5min。温度35℃,紫外检测波长210 nm,进样量20μL,流速1 mL/min。
1.9 脂肪酸的GC-MS分析
GC条件:DB-5MS色谱柱(30 m×0.25 mm,0.25μm);进样口温度230℃;升温程序:110℃保持4min,以10℃/min升温到160℃,保持1min,最后以5℃/min升到240℃,保持15min;载气为氦气,流量为1.52mL/min;采用恒线速度,分流比为1∶30;进样量1μL。
MS条件[25]:离子源温度200℃;电子能量70 eV;质量扫描范围m/z 40~550;溶剂延长时间3 min。
1.10 回收率的测定
以DHA标准品标定脂肪酸粗品中的DHA含量,计算HSCCC分离得到的DHA的回收率[26]。


式中,Sn——脂肪酸粗品液相中DHA的峰面积(mAU);Se——DHA标准品的峰面积(mAU);Ce——DHA标准品对应液相的进样质量浓度(μg/mL);Cn——脂肪酸粗品对应液相的进样质量浓度(μg/mL);SS——经HSCCC分离纯化的DHA样品对应液相的DHA的峰面积(mAU);CS——经HSCCC分离纯化的DHA样品的质量浓度(μg/mL);VS——HSCCC分离所得DHA样品的体积(mL);Vn——一次进样的脂肪酸粗品体积(mL);Pn——DHA的回收率(%)。
1.11 数据处理
每组试验做3次,数据以平均值表示。用Excel 2010软件绘制表格,响应面实验设计及分析用Design Expert 8.0.6软件。
2 结果与讨论
2.1 裂壶藻的收集及藻油的提取和皂化
将裂壶藻培养96 h后,离心,收集底部藻泥,真空冷冻干燥后获藻粉200 g。采用氯仿-甲醇法提取油脂,由5 g裂壶藻粉提取的油脂量为2.08 g,含油率为41.7%。所提油脂经皂化后进行HPLC分析,结果见图1。与DHA标准品的HPLC图谱进行对比,确定保留时间为17.29 min的峰是DHA峰。将1 000mg微藻油经皂化处理除乙醚,得到脂肪酸粗品,约180mg。

图1 脂肪酸粗品的HPLC分析图Fig.1 HPLC spectrum of fatty acids extracts
2.2 HSCCC溶剂体系的选择
由于脂肪酸极性较弱,因此选择正庚烷-水这一弱极性基本溶剂体系。同时在上、下两相中加入极性位于正庚烷和水之间的惰性溶剂来调节溶剂系统的极性。参考曹学丽[20]和Bousquet[27]的方法,选择的两相溶剂体系为正庚烷-乙酸乙酯-甲醇-水和正庚烷-甲醇-水,测定不同体积比下的K值,见表2。有研究表明K值合适的范围为0.5~2[27]。选择正庚烷-乙酸乙酯-甲醇-水(体积比15∶1∶15∶1)为第1步HSCCC的两相溶剂体系,K值为0.84;正庚烷-甲醇-水(5∶6∶1,体积比)为第2步HSCCC的两相溶剂体系,K值为0.88。
在HSCCC溶剂体系中,固定相的保留率一般应大于50%[28]。本研究第1步HSCCC两相溶剂体系的保留率为71.43%,第2步HSCCC两相溶剂体系的保留率为66.07%,均符合要求。

表2 DHA在不同体积比溶剂体系的K值Table2 The K values of DHA in different solvent systems
2.3 单因素试验结果及分析
2.3.1 温度对DHA纯度的影响 温度对DHA纯度的影响见图2。当温度小于15℃时,随着温度的升高,分离所得DHA纯度不断增高,随后再升高温度,DHA纯度下降。这是因为对于HSCCC来说,分离温度越高,固定相保留率越高,分离效果越好,而分离温度过高时,导致溶剂的黏度降低,使分离效果变差。选择合适温度15℃。
2.3.2 流速对DHA纯度的影响 图3显示流速对DHA纯度的影响。当流速在2~3mL/min范围逐渐递增时,分离所得DHA纯度提高,随后继续增大流速,DHA纯度降低。这是因为流速低,固定相保留率高,有利于分离,出峰时波动较小,而当流速过低时,使目标物质的洗脱时间长,导致流动相的消耗量增大。当流速高时,固定相的保留率降低,不利于分离,而分离时间缩短,减弱峰的扩散作用,因此也可能实现目标物质的分离。综合实验结果等选择合适的流速为3mL/min。

图2 温度对DHA纯度的影响Fig.2 Effect of temperature on the purity of docosahexenoic acid

图3 流速对DHA纯度的影响Fig.3 Effect of flow velocity on the purity of docosahexenoic acid
2.3.3 转速对DHA纯度的影响 转速对DHA纯度的影响如图4所示。当转速在800~900 r/min范围逐渐升高时,分离所得DHA纯度提高;随后再提高转速,DHA纯度降低。这是因为转速越高,固定相保留率越高,分离效果越好。然而转速过高时,使仪器损耗较大,从而影响分离效果。选择合适转速900 r/min。
2.3.4 进样量对DHA纯度的影响 取一定量的裂壶藻油脂按1.3节方法进行皂化处理。分别称取36,108,180,252,360 mg的脂肪酸粗品用20 mL溶剂体系溶解得到一定浓度脂肪酸粗品,然后利用HSCCC进行DHA的分离纯化。进样量与分离所得DHA纯度关系如图5所示。进样量与分离所得DHA纯度的关系不显著。当进样量低于108 mg,即皂化油脂量小于300mg时,紫外检测器的响应值较低,峰高较小,峰较为平滑;当进样量大于360mg,即皂化油脂量大于1 000mg时,紫外检测器响应值较高,峰高较大,超出紫外检测器的检测范围,峰尖出现水平线。为了便于后续相关试验,选择进样量为180mg,即500mg油脂皂化后溶于20mL溶剂体系中进行相关试验。
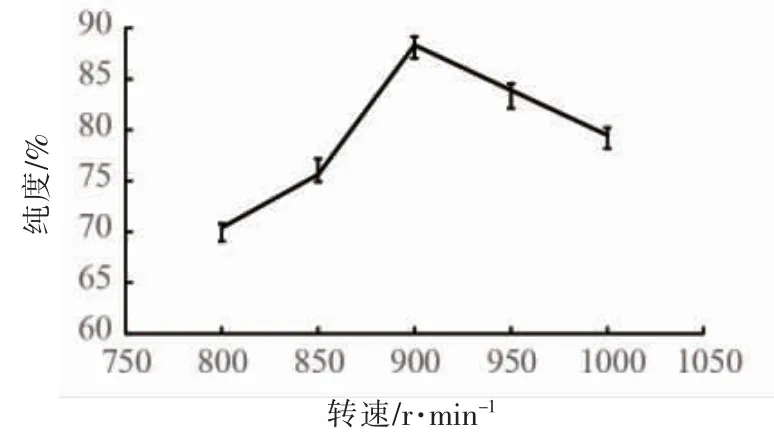
图4 转速对DHA纯度的影响Fig.4 Effect of revolution speed on the purity of docosahexenoic acid

图5 进样量对DHA纯度的影响Fig.5 Effect of sample size on the purity of docosahexenoic acid
2.4 响应面分析
2.4.1 响应面试验结果 依据Box-Benhnken中心组合试验原理,以温度、流速、转速为自变量,DHA的纯度为因变量,进行响应面试验,所得结果见表3。

表3 响应面分析试验结果Table3 Experiment results of response surface methodology
2.4.2 回归方程及参数分析 利用Design Expert 8.0.6对表2数据进行多元回归拟合分析,得到二次回归模型:Y=89.22-2.86A+1.82B+2.43C-1.64AB+2.75AC+1.86BC-3.77A2-5.97B2-6.42C2。
回归与方差分析结果见表4。模型的P值<0.0001,表明该回归模型极显著;失拟项(P=0.8309>0.05)不显著,表明未知因素对试验结果的干扰较小。该模型R2=0.9765,R2Adj=0.9464,这表明可以解释响应值DHA纯度的变化,模型的拟合程度良好,试验误差小,能较好地反映DHA纯度与温度、转速、流速之间的关系,可用此模型进行分析和预测。根据表3中的F值得到各因素对DHA纯度的影响排序为A>C>B。根据P值变化可知B2、C2对DHA纯度的影响极显著,AC、BC、A2对DHA纯度的影响显著。

表4 回归方程方差分析表Table4 Analysis of Regression equation variance table
2.4.3 响应面优化及分析 一般来说,HSCCC流动相流速越低,转速越高,分离温度越高,固定相的保留率越高,分离效果越好。然而,转速过高时对仪器的损耗较大,耗能高,影响仪器寿命。低转速虽然可以使固定相的保留率较高,但会使目标物质的洗脱时间过长,流动相消耗量高。分离温度过高会使溶液的黏度降低,从而影响分离效果。
用Design-expert 8.0.6对表3数据进行二次多元回归拟合,交互作用显著的响应面图见图6~8。对比分析曲线的陡峭及平滑程度,可知,温度对DHA纯度的影响大于流速(图6)。由图7可知,温度对DHA纯度的影响大于转速。由图8可知,转速对DHA纯度的影响大于流速,这和方差的分析结果相符合。

图6 温度和流速的交互作用对DHA纯度影响的响应面图Fig.6 Response surface plot of interactiion between column temperature and flow velocity

图7 温度和转速的交互作用对DHA纯度的影响Fig.7 Response surface plot of interactiion between column temperature and flow velocity

图8 流速和转速的交互作用对DHA纯度的影响Fig.8 Response surface plot of interactiion between flow velocity and revolution speed
根据模型分析,确定HSCCC分离纯化DHA的最佳条件为温度13.1℃、流速3.23mL/min、转速907 r/min,在此条件下DHA纯度的预测值为90.13%。实际条件为:温度13℃、流速3mL/min、转速910 r/min。
2.5 HSCCC分离纯化DHA
2.5.1 第1步HSCCC分离纯化DHA 将皂化处理后所得脂肪酸粗品在上述优化条件下进行第1步HSCCC分离纯化,结果如图9所示。通过与DHA标准品的出峰时间相比对,确定第1个峰为目标物DHA。收集DHA组分,进行液相检测,结果如图10所示。通过面积归一法计算其HPLC纯度为90.06%,依据本文1.9节方法计算回收率为95.27%。

图9 第1步HSCCC分离DHA色谱图Fig.9 Separation profiles of DHA by the first step HSCCC

图10 第1步HSCCC分离获得DHA的HPLC色谱图Fig.10 HPLC analysis of DHA separated by the first step HSCCC
2.5.2 第2步HSCCC分离纯化DHA 影响HSCCC分离纯化裂壶藻油脂中DHA的主要干扰物质为液相图谱中在23.54min出峰的物质。通常情况下目标物质的分配系数K值与干扰物质的K值的比值α应大于1[27],才能对目标物质进行较好的分离纯化。通过HPLC检测确定23.54min位置的物质在第2步溶剂体系中的K值为2.32。第2步HSCCC分离所得峰1与峰2的K值的比值α=2.64,符合要求。将第1步收集到的DHA样品用旋转蒸发仪去除溶剂,然后用20mL第2步中的溶剂体系(上、下相体积比1∶1)溶解,过滤后进行第2次HSCCC分离,结果如图11所示。收集第2个峰组分,进行液相检测,结果如图12所示。通过面积归一法计算其HPLC纯度为99.61%,依据1.9节方法计算回收率为93.81%。
2.6 分离获得DHA的GC-MS分析
将HSCCC分离获得的高纯度DHA样品进行GC-MS分析,所得质谱图13。利用GC-MS软件中NIST0.5谱库数据库进行检索,通过与标准谱图比较,确定分离所得物质为DHA。
2.7 讨论
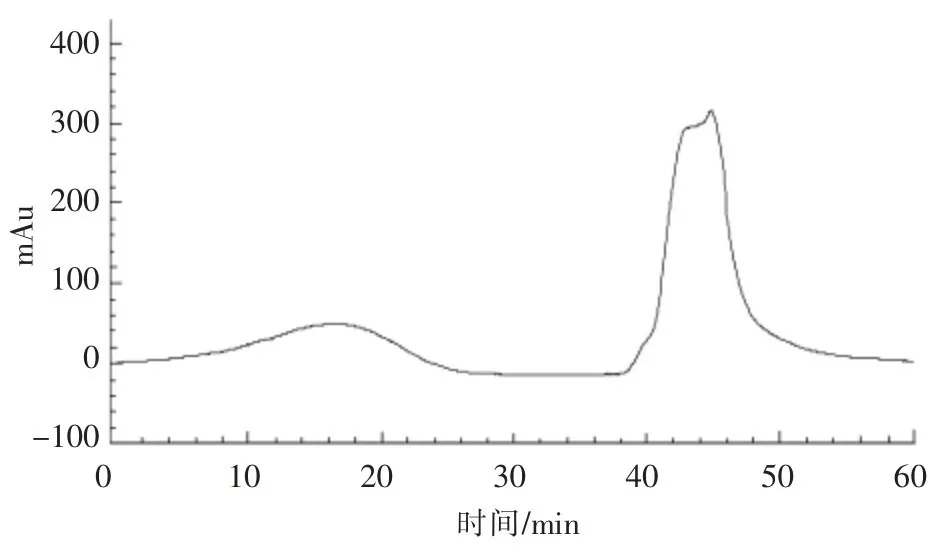
图11 第2步利用HSCCC分离DHA色谱图Fig.11 Separation profiles of DHA by the second step HSCCC
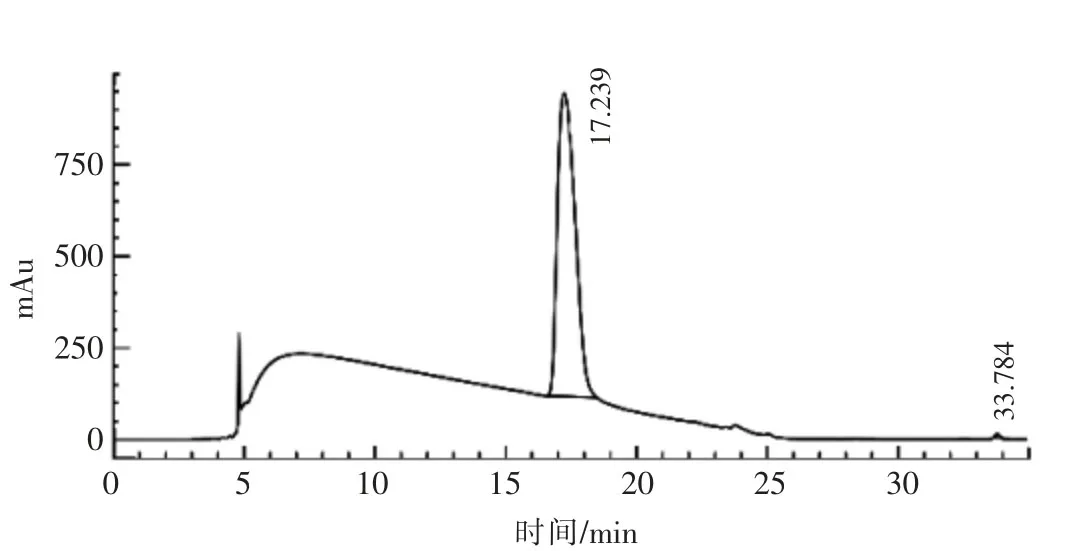
图12 第2步利用HSCCC分离获得的DHA的HPLC色谱图Fig.12 HPLC analysis of DHA separated by the second step HSCCC
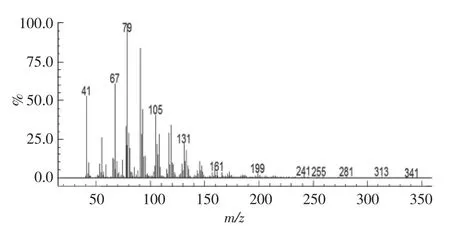
图13 HSCCC分离获得的DHA的GC-MS图Fig.13 GC-MS profiles of DHA separated by HSCCC
采用裂壶藻作为DHA的生产原料,是因为裂壶藻油脂的脂肪酸组成较为简单,DHA含量高。该藻种对环境要求不高,生长迅速,发酵后获得的生物量高。裂壶藻的筛选培养以及发酵生产的研究较为成熟,均已工业化生产。吕小义等[29]对裂壶藻的发酵生产进行了研究,最终获得藻体湿重达200 g/L,说明裂壶藻是适宜的DHA生产原料。
目前,脂肪酸分离纯化方法有溶剂萃取法、低温结晶法、尿素包合法、分子蒸馏法、超临界二氧化碳萃取法、脂肪酶浓缩法等[30-32]。本研究利用HSCCC两步分离纯化DHA。HSCCC分离纯化DHA相较于以上的方法具有以下优点:操作简单,可直接进样,所得DHA纯度高,能在线检测,可直接和质谱仪或红外色谱仪联用进行分析,应用范围广。利用HSCCC分离纯化化合物的关键点在于溶剂体系的选择。张荣劲[33]对HSCCC分离纯化天然物质进行综述,按照溶剂体系的极性不同进行分类,对溶剂体系的选择有一定的指导意义。本研究采用正庚烷-乙酸乙酯-甲醇-水(体积比15∶1∶15∶1)作为第1步HSCCC溶剂体系,采用正庚烷-甲醇-水(体积比5∶6∶1)作为第2步溶剂体系,并用响应面分析法优化HSCCC分离纯化DHA的关键参数。最终得到DHA纯度分别为90.06%,99.61%,回收率分别为95.27%,93.81%。
因气相色谱检测需进行甲脂化处理,无法与HSCCC相连进行在线检测。查阅相关文献,因脂肪酸在210 nm处有吸收[34],故本试验采用紫外检测器在210 nm处检测,样品无需进行衍生处理,可直接检测。通过紫外检测器和HPLC联用可以检测样品的纯度和计算回收率。
3 结论
两步HSCCC分离纯化裂壶藻油脂中的DHA,经筛选,第1步的溶剂体系为正庚烷-乙酸乙酯-甲醇-水(15∶1∶15∶1,V/V/V/V),第2步溶剂体系为正庚烷-甲醇-水(5∶6∶1,V/V/V)。采用单因素试验和响应面分析法对HSCCC分离纯化DHA的关键参数进行优化,得到最佳条件为:进样量180mg、温度13℃、流速3mL/min、转速910 r/min。在该条件下分离纯化所得DHA纯度分别为90.06%,99.61%,回收率分别为为95.27%,93.81%。本研究说明利用HSCCC可对DHA进行很好的分离纯化,为DHA产品的进一步开发利用提供支持。

