嗜热真菌单宁酶的克隆表达及在柿子汁中的应用
黄 蕾 卢海强 谷新晰 李 晨 康红艳 王妙姝 田洪涛,2*
(1 河北农业大学食品科技学院 河北保定071000
2 国家北方山区农业工程技术研究中心 河北保定071000
3 河北新希望天香乳业有限公司 河北保定071030)
单宁酶(Tannase EC 3.1.1.20),又称鞣酸酶,是一种单宁酰基水解酶,可以水解单宁中的酯键与缩酚羧键,生成葡萄糖、没食子酸及其相应的醇类等化合物[1-2]。单宁酶广泛分布在自然界中,如动物、植物及微生物,目前,生产用单宁酶主要来自微生物的曲霉属[3]。美国食品药品监督管理局(FDA)已将单宁酶作为一种安全的食品添加剂[4],并被茶、饮料以及酿酒工程中用来澄清液体[5-6]等。此外,其还被应用于化工、医药及饲料等工业领域。
目前,单宁酶的生产成本限制了单宁酶的实际应用[7]。利用生物技术提高单宁酶的产量是降低生产成本的可行途径。1996年,Hatamoto等[8]首次对米曲霉中的单宁酶进行异源表达。到目前为止,共有4种来源的单宁酶实现了克隆表达,包括真菌来源的米曲霉[9]和黑曲霉[10],原核微生物来源的植物乳杆菌[11]和葡萄球菌[12]。尚未报道有嗜热真菌来源的单宁酶被表达。单宁酶的产量较低的问题仍未有效解决。采用基因工程技术提高单宁酶产量具有重要意义。
柿树在我国山区种植广泛,是当地农民重要的经济来源。柿子营养丰富,具有很高的食用和药用价值。然而,目前柿子加工品种单调,主要是鲜食或经初级加工的柿饼。限制其无法深加工的重要原因是:柿子中含有较高的单宁,利用单宁酶降解单宁已成为公认的有效方法,然而采用单宁酶来加工生产的柿子汁中的抗氧化活性是否会受到影响,并无相关研究。
本研究以课题组前期分离获得的一株产单宁酶的嗜热烟曲霉菌株A.fumigates.HBFH5为研究对象,克隆该菌单宁酶基因并在巴斯德毕赤酵母(P.pastoris)GS115中进行高效表达,通过对重组AfTanA的酶学性质分析及其在柿子汁中的应用试验,探讨重组单宁酶AfTanA在柿子汁中的应用潜力,为单宁酶在柿饮料行业中的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
嗜热真菌HBFH5分离自浓香型大曲中,保藏于本实验室;巴斯德毕赤酵母GS115和质粒pPIC9k,本实验保存;大肠杆菌感受态细胞Trans I-T1,北京全式金生物技术有限公司;质粒pMDTM19-T,Easy Taq DNA聚合酶,dNTPs(2.5 mmol/L),T4 DNA连接酶和限制性内切酶Spe I,Not I和Sal I,TaKaRa公司;根据毕赤酵母表达手册制备最小葡萄糖(MD)琼脂板、缓冲复合甘油培养基(BMGY)和缓冲复合甲醇培养基(BMMY);其它化学试剂为进口或国产分析纯级;引物合成和核酸测序由上海生工生物工程股份有限公司完成。
1.2 仪器与设备
Biometra Tprofessional PCR仪,德国Biometra公司;DYY-6C型电泳仪,北京六一仪器厂;JY04S-3E型凝胶成像系统,君意电泳;TU-1810紫外分光光度计,北京普析通用仪器有限公司;Sigma 3K15高速台式离心机,德国Sigma公司。
1.3 方法
1.3.1 单宁酶基因的克隆 嗜热真菌HBFH5孢子接种于200mL PDB培养基中,45℃培养48 h,离心收集菌体,采用CTAB法提取HBFH5总基因组DNA。参照已报道单宁酶基因序列信息(XP_746534.1),设计单宁酶(afTanA)表达引物:afTan A-PF:5′-GGACTAGTGCATCTCTCG CTGACGTGTGC-3′(Spa I);afTanA-PR:5′-GCGGCCGCTCAGTAGACAG GGACCTTGAAAGC-3′(Not I)。
PCR反应体系(50μL):基因组1μL,引物各1μL,Easy Taq DNA聚合酶1μL,10×Buffer 5 μL,dNTP 4μL,ddH2O 37μL。PCR反应参数:95℃5min;95℃30s,55℃30 s,72℃2min,30个循环;72℃10min。
参照胶回收试剂盒说明书步骤回收PCR产物,将目的基因连接到pMDTM19-T上,并转化至TransI-T1感受态中。采用通用引物(M13F和M13R)对克隆子进行菌液PCR,将阳性克隆子送至上海生工生物工程股份有限公司测序。
1.3.2 序列信息分析 通过对测序基因序列进行分析,用含阳性基因序列的质粒做后续试验。使用Vector NTI软件分析测序结果,使用BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列一致性分析,使用ExPASy(http://web.expasy.org/protparam/)预测单宁酶的分子质量和等电点,使用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,使用NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)服务器预测可能的N-糖基化位点。蛋白二级结构利用Predict protein工具进行分析(https://www.predictprotein.org/),使用I-TASSER预测单宁酶Af-TanA的3D结构,C-score对预测模型排序,选择最优模型。
1.3.3 重组菌株的构建 对质粒pMDTM19T-af-TanA和pPIC-9k进行双酶切,利用胶回收试剂盒对目的酶切产物进行回收,并进行afTanA和pPIC-9k的连接反应,构建重组质粒pPIC9k-af-TanA。采用5’AOX和3’AOX通用引物对转化子进行验证,将阳性转化子送至上海生工生物工程股份有限公司测序。
利用质粒提取试剂盒,提取质粒pPIC9k-af-TanA,使用限制性酶Sal I将pPIC9k-afTanA线性化,电转化至GS115感受态,参照毕赤酵母表达手册进行阳性克隆子的筛选。
1.3.4 重组菌株诱导表达及SDS-PAGE分析挑取单阳性转化子至50mL YPD培养基中,30℃,250 r/min培养12 h。以1%的接种量接种于200mL BMGY中,在摇床中30℃,250~300 r/min生长至OD600值2~6(16~18 h),室温8 000 g离心5min,收集细胞,去除上清,100mL BMMY重悬细胞,放入摇床继续培养至48 h,维持甲醇终含量为0.5%,离心收集发酵液,即粗酶液,测定其活力,进行SDS-PAGE分析。
1.3.5 单宁酶酶学性质分析 单宁酶酶活测定参考Sharma的方法[13]并加以改进。取100μL适当稀释酶液与400μL没食子酸丙酯溶液(1.25mmol/L,pH5.0)混匀,反应10min,加入300μL罗丹宁终止反应,加入200μL KOH(0.5mol/L)显色。对照组则在加入KOH后补加100μL稀释酶液,显色稳定后在520 nm处测定吸光值。
酶活单位(IU):每分钟生成1μmol没食子酸所需酶量为一个酶活力单位(IU)。
1.3.5.1 pH对重组酶AfTanA的影响 分别在pH 3.0~7.0条件下,测定重组酶AfTanA的酶活力,分析其最适作用pH值。将重组酶AfTanA在pH 2.0~12.0的条件下37℃处理1 h,对照为未处理的酶,按照标准酶活力测定方法测定酶活力,分析其pH耐受性。缓冲液为pH2.0~7.0的100 mmol/L柠檬酸-柠檬酸三钠和pH8.0~12.0的100 mmol/L甘氨酸-NaOH。
1.3.5.2 温度对重组酶AfTanA的影响 在最适pH值,温度0~70℃条件下测定重组酶AfTanA的酶活力,分析其最适反应温度。将重组酶在50,60,70℃下孵育0,5,10,20,30min和60min后,测定酶活力,分析其热稳定性。
1.3.5.3 金属离子对重组酶AfTanA的影响 在标准反应条件下分别测定终浓度为1mmol/L和5mmol/L的金属 离子(Fe3+、Cu2+、K+、Zn2+、Na+、Mg2+、Ca2+、Li+和Mn2+)条件下的单宁酶酶活力。
1.3.5.4 单宁酶反应动力学分析 配制底物浓度分别为0.2,0.4,0.6,0.8,1.0mmol/L的PG溶液,在最适条件下反应5min,测定520 nm处的吸光值,计算酶活性和反应速率,利用米氏方程双倒数法求得Km及Vmax值。
1.3.6 柿汁及其单宁酶水解产物的抗氧化性检测
按照柿子∶水=1∶4的质量比压榨,经胶体磨处理得柿子汁样品。
DPPH自由基清除率的测定[14]:取2 mL DPPH-乙醇溶液(0.2mmol/L),分别与2mL重组酶AfTanA酶解前、后的柿汁混匀,室温条件下避光反应30min,以95%乙醇调零,测定5l7 nm处的吸光值Ax。以蒸馏水代替样品溶液作为空白对照得A0,以无水乙醇调零。
DPPH自由基清除率(%)=(A0-Ax)/A0×100
ABTS自由基清除率的测定[15]:于0.1mL柿汁中加入1.9mL ABTS工作液,震荡混匀,避光反应6min,测定734 nm处的吸光度Ax。以0.1mL的蒸馏水代替样品作为空白对照得A0,蒸馏水调零。
ABTS自由基清除率(%)=(A0-Ax)/A0×100
OH·清除率的测定[16]:于试管中加入1mL FeSO4(2.25mmol/L)、1mL水杨酸-乙醇(9mmol/L)溶液、1mL柿汁和1mL 8.8mmol/L H2O2,37℃反应30min,在波长510 nm处测其吸光度Ax;用水代替柿汁,测空白A0;再用2mL水代替水杨酸-乙醇和H2O2,测柿汁本底值Ax0。
OH·清除率(%)=[A0-(Ax-Ax0)]/A0×100
1.3.7 数据分析及处理 每次试验平行测定3次,利用spss19.0软件对结果进行统计分析。
2 结果与分析
2.1 单宁酶基因重组菌株的构建
2.1.1 单宁酶afTanA基因序列分析 烟曲霉(A.fumigatus.HBFH5)来源的单宁酶afTanA基因由1 767 bp核苷酸组成,无内含子,编码588个氨基酸和一个终止密码子。理论分子质量为63.64 ku,等电点为4.86,含有由18个氨基酸组成的前体信号肽。氨基酸组成分析发现,AfTanA中带电氨基酸含量26.22%,酸性氨基酸含量9.79%,碱性氨基酸含量6.12%,极性氨基酸含量35.66%,疏水氨基酸含量30.42%。经I-TASSER服务器三维结构建模,获得1个模型,其质量评估系数值为0.13,结构相似度系数为0.73±0.11,建模数据可用。重组单宁酶AfTanA存在1个Kex2酶切位点(Lys315-Arg316),位于Lid Domain区域的Loop中,预测其催化活性位点为Ser202、Asp455和His501。其α螺旋结构占21.9%,β折叠结构占10.02%,Loop结构占68.08%。经序列一致性分析,单宁酶Af-TanA氨基酸序列与米曲霉来源的单宁酶(XP_001826685.1)一致性为80%,与黑曲霉GH1(AKM52312)一致性为77%,与青霉属来源的单宁酶基因一致性为80%~75%。
2.1.2 单宁酶afTanA工程菌株的构建 对质粒pMDTM19T-afTanA和质粒pPIC-9k分别进行双酶切,使用T4 DNA连接酶连接双酶切产物,热激转化大肠杆菌TransⅠ-T1感受态细胞,构建重组质粒pPIC9k-afTanA。用pPIC9k-afTanA质粒电转化巴斯德毕赤酵母GS115产生139个阳性克隆子。经对阳性克隆子诱导表达,筛选出3株高产菌株,分别为AfTanA-13、AfTanA-21和AfTanA-39。
2.2 重组菌的AfTanA基因诱导表达及其产物的SDS-PAGE分析
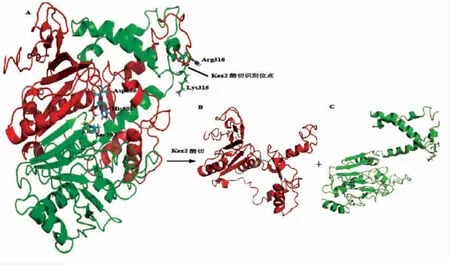
图1 使用I-TASSER构建的AfTanA分子模型Fig.1 Molecular model of the AfTanA constructed using the I-TASSER server
将含重组菌株按1.3.4节方法进行培养和诱导表达后,对细胞发酵液进行酶活检测,结果显示,发酵液中单宁酶酶活为678 U/mL。对重组菌发酵液进行SDS-PAGE蛋白电泳检测,结果见图2。
发酵产物在45~55 ku处出现显著蛋白条带,而这与AfTanA的蛋白理论分子质量(63.64 ku)存在一定的差异,很可能与巴斯德毕赤酵母GS115菌株所分泌Kex2蛋白酶降解有关。由三维结构模型分析可知,该氨基酸序列存在“Lys-Arg”酶切位点,这使得AfTanA蛋白分子被切割成两个片段:AfTanA-C亚基和AfTanA-N亚基,其大小分别是31.7 ku和30.4 ku。该产物经去糖基化酶Endo H处理后,在30ku附近出现两个片段,这与理论分子质量相符。经NetNGlyc 1.0分析,单宁酶Af-TanA中具有8个潜在的N-糖基化位点(37 NGTL,57 NSTS,79 NVTV,155 NGSI,262 NATI,330 NGTV,409 NVTY,534 NTTV),表明单宁酶AfTanA的糖基化修饰使得其分子质量明显增大。
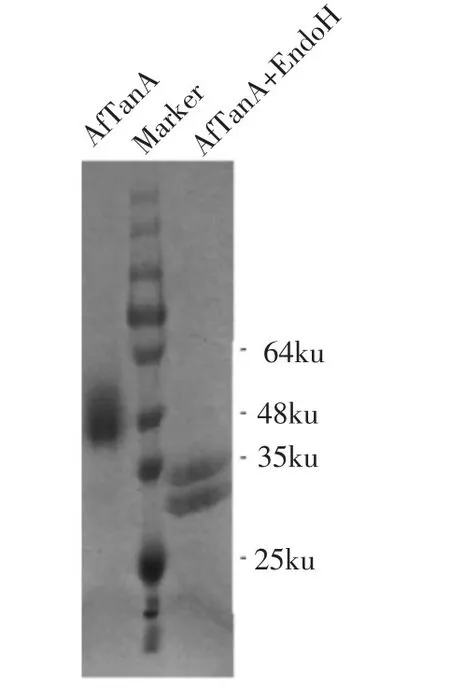
图2 重组单宁酶AfTanA SDS-PAGE电泳分析Fig.2 Sodium dodecy sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)analysis of recombinant AfTanA
2.3 重组单宁酶AfTanA酶学特性分析
由图3a和3b可知,重组酶AfTanA的最适反应pH 5.0,在pH 2.0和pH 9.0~12.0分别处理1 h,酶活力基本丧失;在pH 7.0~8.0处理1 h,AfTanA酶活性损失50%左右;而在pH3.0~6.0分别处理1 h,AfTanA酶活性基本不变。综上,重组酶AfTanA在pH 3.0~6.0条件下稳定。
由图3c和3d可知,重组酶AfTanA的最适反应温度为40℃,随着处理时间的延长,酶活性逐渐降低。在30℃处理1 h,AfTanA相对酶活损失30%;40℃处理1 h后,酶活损失约50%;50℃处理1 h后,AfTanA几乎失活。
2.4 金属离子对酶活力的影响及动力学参数
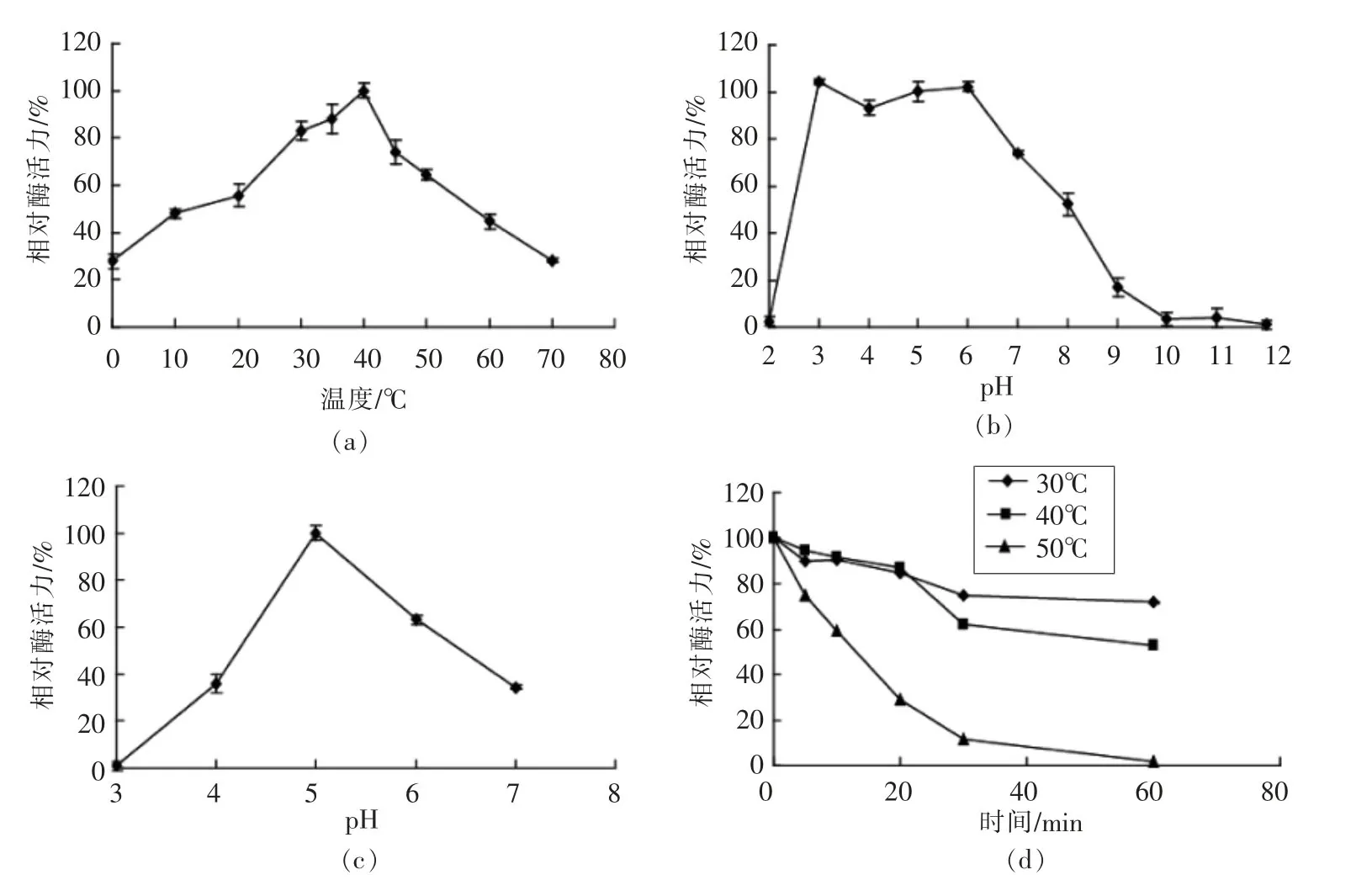
图3 温度和pH值对重组单宁酶AfTanA的影响Fig.3 Effect of temperature and pH on recombinant tannase AfTanA
由表1可知,不同的离子浓度对酶活力的影响存在差异,且离子种类也存在较大差异。在低浓度(1mmol/L)条件下,Fe3+和Cu2+对重组AfTanA活性具有较强的抑制作用,K+、Na+、Mg2+、Ca2+、和Mn2+对AfTanA活性具有轻微促进作用;Zn2+对Af-TanA活性具有较强的促进作用;Li+对AfTanA的活性基本无影响。在高浓度(5mmol/L)条件下,金属离子Cu2+和Fe3+对AfTanA活性完全抑制;Zn2+对AfTanA活性具有较强的抑制作用;K+、Na+、Mg2+、Ca2+、Li+和Mn2+对AfTanA活性具有促进作用。
经测定,动力学曲线回归方程为y=6.6648x+0.6251,R2=0.9952。由回归方程计算得:Km为10.662mmol/L,Vmax为1.600mmol/(L·min)。
2.5 重组单宁酶对柿子汁的抗氧化性的影响
由图4可知,经重组单宁酶AftanA水解的柿子汁的自由基清除能力强于原柿子汁。其中,DPPH清除率改变最为明显,由原来的50%左右提高至67%;ABTS清除率约提升12.7%,其清除率为45%。·OH清除率约增加3.4%,为33%。由此可见,在柿子汁中添加重组单宁酶AftanA,能够将其中的大分子单宁降解为小分子的单宁酸,从而显著增强柿子汁的抗氧化能力。
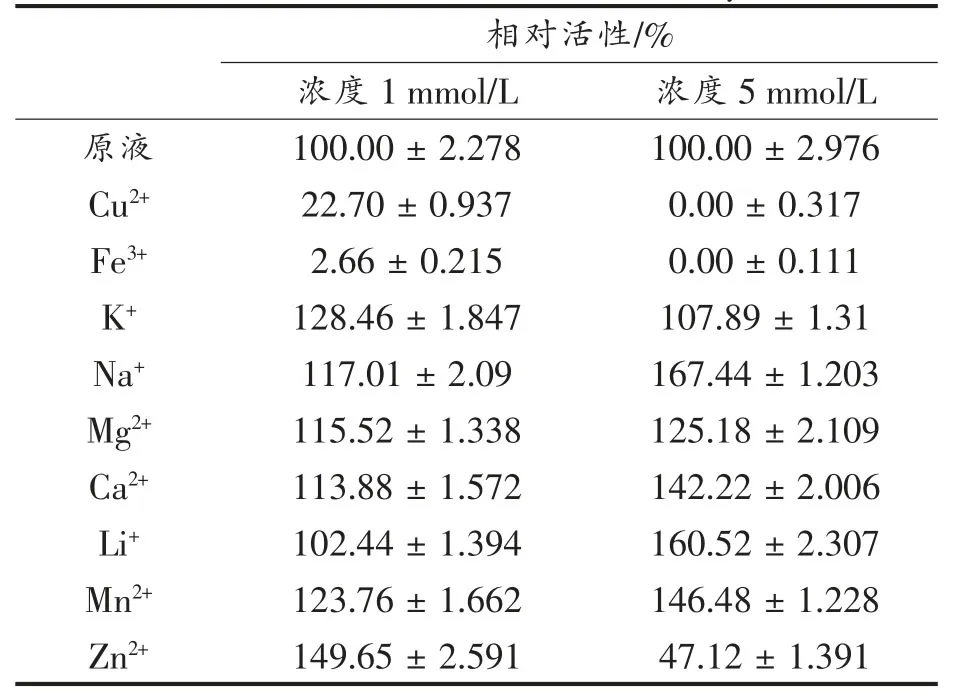
表1 金属离子对AfTanA活力的影响Table1 Effects of Metalions on the activity of AfTanA
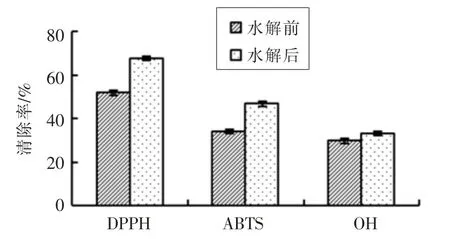
图4 柿汁水解前、后对DPPH、ABTS自由基和·OH的清除效果Fig.4 The effect of Persimmon juice before and after hydrolysis on DPPH,ABTS free radicals and hydroxyl radicals
3 结论
目前,商品化的单宁酶主要是从野生型菌株中发酵分离获得,而来自工程菌株的单宁酶较少[17-19]。本研究对大曲中获得的嗜热真菌A.fumigatus.HBFH5中的单宁酶基因进行克隆及异原表达,经测定重组酶AfTanA活力为678U/mL,是黑曲霉GH1的重组单宁酶活力的1 000倍左右,单宁酶的高效表达,将有助于降低生产成本。重组酶AfTanA最适pH 5.0,在pH 5.0~6.0之间稳定,这与已报到单宁酶性质相类似。AfTanA最适温度为40℃,而本课题组前期研究发现,嗜热烟曲霉中的单宁酶的最适反应温度为60℃,分析其可能的原因主要是酶蛋白分子在不同的宿主中翻译后修饰存在差异,继而使得性质存在差异[20]。当前的基因工程菌宿主如酵母菌、大肠杆菌和芽孢杆菌全部是常温菌,因此开发嗜热菌的宿主菌,对于解决嗜热酶基因的表达及性质的保持具有一定的现实意义。
我国是柿树第一种植大国,其柿子产量占世界总量的91%,接近200万t[21]。然而,柿子中含有大量的单宁和果胶物质,造成柿子加工产品十分单调。采用单宁酶来对柿子中的单宁进行降解,是解决柿子单宁含量过高的最有效方法。Isabela等[22]报道单宁酶可有效降解葡萄果渣中的单宁,显著提高其总酚含量和抗氧化性。罗昱等[5]也利用单宁酶脱除刺梨果汁中的单宁,总单宁脱除率达76.07%。然而,添加单宁酶是否对柿子汁果汁中的抗氧化活性物质产生影响,还不清楚。本研究将重组酶单宁酶AfTanA作用于柿汁,利用福林酚法测定重组酶AfTanA作用于柿子汁前、后的总酚含量,结果显示:处理后总酚含量显著提高,并且酶解后的柿子汁中DPPH、ABTS自由基和·OH清除率较原柿汁均有不同程度的增强,其原因是果汁中的大分子单宁物质被单宁酶降解为单宁酸等小分子物质,而这类物质具有较强的抗氧化活性[23]。
本研究从1株嗜热真菌A.fumigates.HBFH5克隆获得1单宁酶基因afTanA,并实现了afTanA在巴斯德毕赤酵母GS115中的高效表达。重组单宁酶AfTanA最适反应温度为40℃,最适pH 5.0,酶活力为678U/mL。同时研究发现将重组单宁酶AfTanA作用于柿子汁后,该酶不仅可以降解果汁的单宁,而且柿子果汁其抗氧化性显著提高。本研究为单宁酶在果汁饮料中的应用提供一定的理论依据。

