弗吉尼亚栎母树林外生菌根的真菌多样性*
靳 微 杨预展 孙海菁 陈连庆 袁志林
(1. 林木遗传育种国家重点实验室 中国林业科学研究院 北京 100091; 2. 中国林业科学研究院亚热带林业研究所 杭州 311400)
弗吉尼亚栎(Quercusvirginiana,以下简称弗栎)原产美国,通常生长在沿海地带的沙质土壤中,能耐较高的土壤盐分,是大西洋和海湾沿岸荒岛林地的优势树种(陈益泰等, 2007; 2017)。自2001年在长三角引种成功至今,该树种表现出常绿、抗风、耐盐、耐寒等多种优良特性(陈益泰等, 2007),其中在浙江上虞海涂弗栎人工林面积达160 hm2。弗栎在林业工程建设中具有显著的经济和生态效益,目前已开展了该地区引种表现(陈益泰等, 2013)、种子产量(陈益泰等, 2015)、耐盐试验(王树凤等, 2010; 2011)、扦插繁殖(陈雨春等, 2007)、容器育苗和抗风耐盐(陈益泰等, 2007)等多项研究表明,与松科(Pinaceae)、桦木科(Betulaceae)和杨柳科(Salicaceae)等高等植物类似,壳斗科(Fagaceae)中的栎属(Quercus)树种也形成发达的外生菌根系统(Warcup, 1980; Szuba, 2015; Walkeretal., 2010),从而提高树木养分吸收效率和环境适应性。外生菌根(ectomycorrhiza,ECM)是担子菌(少数为子囊菌和低等菌)菌丝体侵染植物营养根形成的一种共生体(Cairneyetal., 1999),其主要特征是菌丝在幼根表面形成菌套(mantle),并侵入到根皮层细胞间隙形成哈蒂氏网(Hartig net)(Smithetal., 1997)。相对于其他栎类树种而言,对弗栎外生菌根真菌调查研究只有零星报道,如Howe(1964)、Kropp等(1999)和 Guevara等(2013)分别发现土生空团菌(Cenococcumgraniforme)、酒色紫蜡蘑(Laccariavinaceobrunnea)和少数几种块菌(Tuberspp.)可以与弗栎形成外生菌根。在菌根化育苗试验中表明彩色豆马勃(Pisolithustinctorius)(Daviesetal., 1990; Marxetal., 1997)也可以作为弗栎的外生菌根真菌。但弗栎引种至我国东南沿海地区后在新的气候条件和立地条件下,其形成菌根能力如何、菌根真菌群落结构及不同采样时期的变化特征等基础资料还十分匮乏。本文以浙江上虞海发园林有限公司培育的弗栎母树林为研究对象,通过菌根形态学描述和真菌扩增子(ITS基因)的群落高通量测序(amplicon-based Illumina community profiling)平台,探讨其外生菌根类型、群落结构组成及动态变化、优势外生菌根真菌的遗传多样性,为深入认识弗栎外生菌根菌、挖掘优良菌株从而提升弗栎栽培质量提供基础。
1 材料与方法
1.1 取样及样品处理
试验点位于在浙江上虞海发园林引种弗栎母树林基地(30°10′N,120°42′E),该地区属于亚热带海洋性季风气候,于1996年围垦。土壤类型: 粉泥质滨海盐土,平均含盐量0.43%,pH8.95。笔者在2017年对该样地菌根类型及子实体种类的初步调查,发现在4—8月之间有较明显的变化。故选定 2017年12月26日、2018年4月17日、5月29日和8月6日等4个时期采集菌根样品,研究外生菌根真菌群落结构的变化特征。从中国气象数据网(data.cma.cn)获取2017年10月—2018年11月样地月平均降水量和月平均气温数据(图1)。选定树龄为14年生的母树林(面积0.33 hm2),随机选择5 块样方(4 m×4 m),每块样方选2 棵树,在每个样方的顶点做好固定标记,样方间距离10 m以上。在距树干0.5~1 m处,去除凋落物层,小心挖取带土的菌根样品放入自封袋里,采样完毕立即将样品带回实验室。挑取发达菌根样品,在清水中清洗、震荡。洗净后将样品分为2部分,其中2块样方的菌根样品用于形态观察和特征描述; 另外3块样方的样品经表面消毒(3%过氧化氢5 min,75%酒精40 s,无菌水至少冲洗3次)后液氮速冻,放置-70 ℃保存,用于高通量测序。

图1 采样地2017年10月—2018年11月的月平均降水量和月平均气温变化Fig.1 Monthly average precipitation and temperature from October 2017 to November 2018 in the sampling site
1.2 形态观察
选取典型菌根在超景深显微镜(VHX-5000; Keyence,加拿大)下根据Agerer(2012)所提出的外生菌根形态分类要点,观察其分支类型、分支末端形状、颜色、菌丝套表面质地和外延菌丝等特征,并对其进行拍照。用镊子和长绣花针,在体式显微镜下(Chinde XTL-81,中国)对一个末端未分支的菌根进行菌套剥离,在光学显微镜(Axio Scope A1,Zeiss,德国)下观察其菌套内外层菌丝组织类型、菌丝排列方式、外延菌丝特征和菌索类型等解剖特征。
1.3 菌根根尖样品扩增子焦磷酸测序
每个采样时期每块样方的菌根样品按照不同颜色进行分组,标记好后用于高通量测序。大部分样品包含3个生物学重复。个别样品由于取样时获取量极少,且菌根不发达,故将3个样方的样品混合成1份样品,而菌根发达的样品类型,则包含6个或12个重复。此外,在第1个采样时期,白色菌根与少量黄色菌根交织在一起,难以分开,因此作为1种样品类型来处理,总计共48份样品,具体信息见表1。采用CTAB方法提取样本的基因组DNA。用带Barcode 的特异引物fITS7(5’-GTGARTCATCGAATCTTTG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’) (Ihrmarketal., 2012)、Phusion 超保真 PCR 试剂盒(New England Biolabs,美国)对真菌核糖体转录间隔区(ITS2)片段进行扩增。使用Qiagen Gel Extraction Kit(Qiagen, 德国)试剂盒对目的条带进行回收纯化,用TruSeq® DNA PCR-Free Sample Preparation Kit(Illumina, 美国)建库试剂盒进行文库构建,构建好的文库经过Qubit@ 2.0 Fluorometer(Thermo Scientific)和Agilent Bioanalyzer 2100检验合格后,使用Illumina HiSeq2500平台进行PE250进行双尾测序(北京诺禾致源生物信息科技有限公司)。将测得序列共48个样品的96份原始数据文件提交至European Nucleotide Archive数据库(http:∥www.ebi.ac.uk/ena,登录号: RJEB28784)。
1.4 高通量测序数据处理与分析
测序原始数据去除引物接头序列、去除各低质量碱基后用FLASH(V1.2.7, http:∥ccb.jhu.edu/software/FLASH/)(Magoetal., 2011; Jiaoetal., 2016)进行拼接,得到raw tags。参照QIIME(版本1.7.0, http:∥qiime.org/index.html, Caporasoetal., 2010)对数据进行严格质控得到high-quality clean tags(Bokulichetal., 2013),之后与物种注释数据库(UNITE,https:∥unite.ut.ee/)进行比对检测去除嵌合体序列(Haasetal., 2011),得到每个样本的有效序列数据。利用Uparse 软件(Uparse v7.0.1001, http:∥drive5.com/uparse/)(Edgar, 2013)以97%为阈值对有效序列划分可操作分类单元(operational taxonomic unit,OTU)。选择OTUs中出现频数最高的序列作为OTUs的代表序列,并基于 QIIME平台(版本1.9.1)的BLAST工具在UNITE数据库中对OTU进行物种注释,并分别在目和属的水平上统计各样本的群落组成。以样本中数据量最少的为标准对OTUs进行均一化处理,后续的分析都基于均一化处理后的结果。不同采样时间和不同颜色的外生菌根真菌群落组成的差异的非度量多维标度(NMDS),采用R语言(版本 2.15.3)的vegan包实现。用QIIME(版本1.9.1)计算加权和非加权Unifrac距离,并用R语言进行α-多样性指数和β-多样性指数组间差异分析。α-多样性指数主要包括以下4个指标: 菌群丰度(Chao1和ACE)和菌群多样性指数(Shannon和Simpson)。由于在OTU注释结果中并未发现块菌等子囊菌类群,因此在本研究中的所有结果均是基于担子菌分析得到。
使用ClustX 1.81软件进行ITS2基因序列比对,用GeneDoc软件对序列进行适当编辑,去除头尾不整齐的序列。最后在Phylip 软件包(版本3.68)中使用Neighbor-Joining算法构建系统发育树。利用DnaSP(版本6.12.01,http:∥www.ub.edu/dnasp)计算几个外生菌根真菌类群的种间核苷酸多样性。
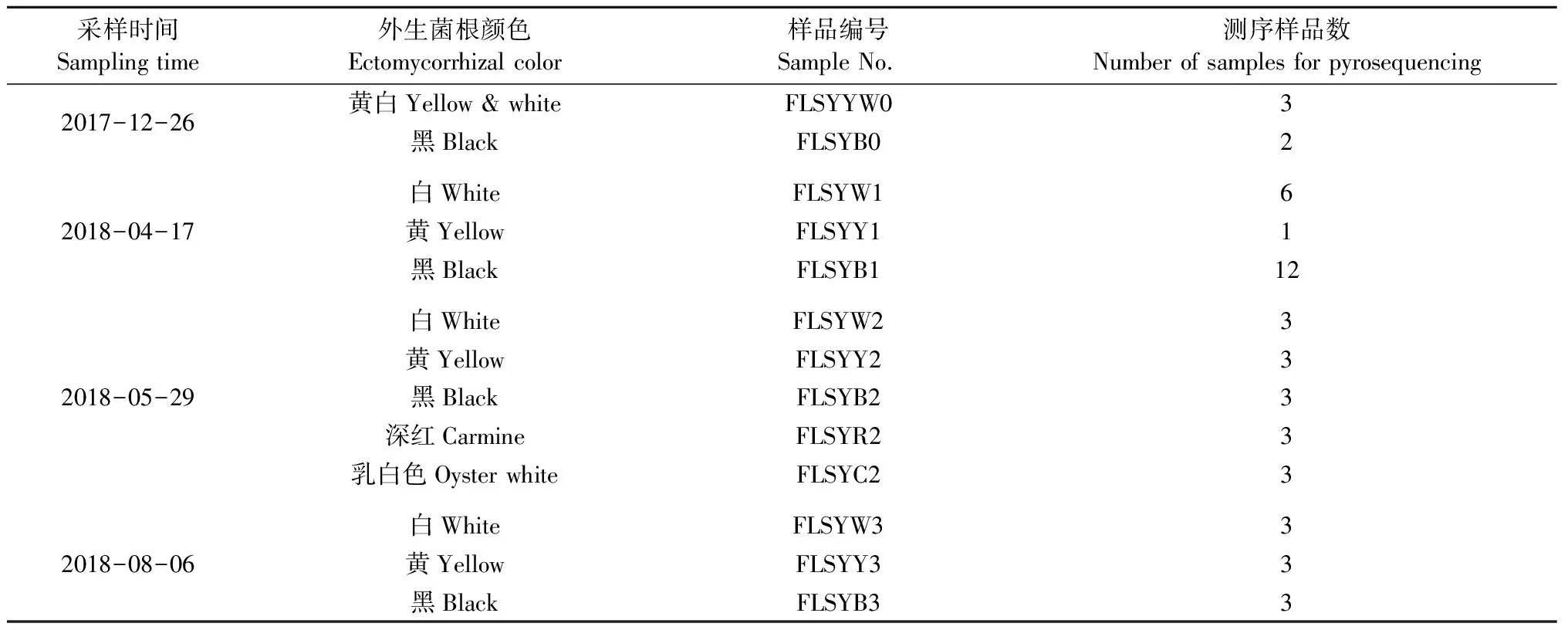
表1 弗栎外生菌根采样时间及高通量测序样品信息Tab.1 Information of ectomycorrhizal root tips samples used for pyrosequencing

图2 弗栎白色菌根形态结构与解剖结构Fig.2 External and anatomic structures of white-colored ectomycorrhiza of Q. virginianaA-B: 外部形态特征Branching pattern of ectomycorrhiza; C: 外层菌套Outer layer of mantle; D: 内层菌套Inner layer of mantle; E: 外延菌丝Emanating mycelium; F: 菌索Rhizomorph.
2 结果与分析
2.1 弗栎不同颜色菌根形态和解剖特征
白色菌根大多不规则羽状分支,0~3级,少数单轴状,疏水。末端变细。表面性状为密羊毛状,具大量棉絮状外延菌丝,菌索透明。菌套内外层均为密丝组织,菌套类型为A型。外延菌丝表面光滑,具锁状联合。菌索未分化,松散缠绕(图2)。
黑色菌根大多呈羽状和塔状,0~3级,亲水。少数呈未分支末端棒状,顶端圆钝。外层菌套为拟薄壁组织,表面光滑,菌丝细胞排列呈石堆状,菌丝细胞三角至多角形,未见圆形细胞堆积,菌套类型为L 型。内侧菌套为拟薄壁组织,菌丝细胞为拟薄壁细胞。外延菌丝极少且具有锁状联合。菌索浅黄色未分化,表面光滑(图3)。
黄色菌根大多不规则羽状分支,偶见塔状分支。0~2级,亲水。浅黄色,成熟菌根为黄色,未分支末端棒状,顶端圆钝。外层菌套由短刺状菌丝构成,菌套接近D型,内层菌套为密丝组织。偶见外延菌丝,未见锁状联合。菌索透明无色,松散排列未分化。多和弗栎叶片凋落物粘连在一起,剥离时会将一部分菌套留在落叶组织中(图4)。
在第3个采样时期,除发现以上3种颜色的菌根外,还观察到中间色(乳白色和深红色)菌根(图5)。从形态结构看,深红色菌根与黑色菌根较接近,乳白色菌根与黄色菌根较接近,但菌套外表平滑,无短刺状菌丝。考虑到该2种颜色菌根可能代表不同的外生菌根真菌种类,因此在高通量测序分析时,也将上述菌根样品分成独立的2组(表1)。3种主要菌根类型的形态学特征描述与鉴定结果见表2。

图3 弗栎黑色菌根形态结构与解剖结构Fig.3 External and anatomic structures of black-colored ectomycorrhiza of Q. virginianaA-C: 菌根不同的分支类型Different branching pattern of ectomycorrhiza; D: 外延菌丝Emanating mycelium; E: 外层菌套Outer layer of mantle; F: 内层菌套Inner layer of mantle.

表2 弗栎不同颜色外生菌根形态结构、解剖结构与鉴定Tab.2 Morphological descriptions of Q. virginiana-associated ectomycorrhizas and the corresponding fungal identities

图4 弗栎黄色菌根形态结构与解剖结构观察Fig.4 External and anatomic structures of black-colored ectomycorrhiza of Q. virginianaA-B: 菌根形态及分支Branching pattern of ectomycorrhiza; C-D: 外层菌套的短刺状结构Short-spiny surface of mantle; E: 外层菌套Outer layer of mantle; F: 内层菌套Inner layer of mantle.

图5 弗栎深红色菌根(A、B)和乳白色菌根(C、D)形态结构Fig.5 Morphological characteristics of the ectomycorrhizas with carmine and oyster white colored appearances in Q. virginiana
2.2 Illuminar HiSeq测序数据分析结果
基于扩增子高通量测序平台,对弗栎外生菌根真菌物种组成进行分析鉴定。48份样品的稀释性曲线(rarefaction curve)均趋于平缓或达到平台期,说明测序数据量足够,可真实反映弗栎菌根真菌群落结构(数据未列出)。从48份样品共获得5 720 430条序列,除去子囊菌和少数低等菌后,以97%序列相似性为阈值,共得到88个担子菌OTUs。
2.3 弗栎外生菌根真菌物种组成及种间遗传多样性
在UNITE真菌ITS数据库进行Blast比对,得到OTU注释结果。结果表明在弗栎菌根中检测到以下外生菌根真菌类群: 棉革菌(Tomentella)、硬皮马勃(Scleroderma)、红菇(Russula)、鹅膏菌(Amanita)、黏滑菇(Hebeloma)、豆马勃(Pisolithus)、乳菇(Lactarius)和蜡壳耳菌(Sebacinales)(图6)。根据各种颜色菌根样品中OTUs的相对丰度并在属的水平绘制柱状统计图,可以看出上述前3个属分别对应了黑色菌根、白色菌根和黄色菌根(图7)。需要指出的是,除了白色菌根中硬皮马勃占有极高的丰度外(均值达到92.25%),其余2种颜色菌根棉草菌和红菇占有的比列相对较低,均值分别为52.69%和74.57%。在采样过程中发现白色菌根易分离且菌套发达、菌丝生长旺盛; 同时这3种颜色的菌根往往交织在一起。因此,在黑色和黄色菌根样品中可检测到一定比例的硬皮马勃。此外,乳白色和深红色菌根中,硬皮马勃、棉草菌和红菇均占有一定比例,但基于加权的聚类分析表明,乳白色菌根的真菌群落结构组成与黄色菌根相似,深红色菌根则与黑色菌根更为接近(图8)。因此,推测这是同一菌根类型的不同发育阶段。由图6还可看出,某些丰度较低的外生菌根真菌类群表现出一定的季节或菌根类型的特异性,如OTU_14[沼生黏滑菇(Hebelomahelodes)]只在第4个采样时期的黑色菌根中存在,OTU_133[彩色豆马勃(Pisolithusarhizus)]主要在第1个采样时期的黑色菌根中检测到,OTU_7[蜡味红菇(Russulacerolens)]只存在于第2个采样时期的黄色菌根中。
为了评估硬皮马勃、棉草菌和红菇 3个重要类群的遗传多样性,提取了相应OTU的序列,基于邻接法(Neighbor-Joining,NJ)构建了系统发育树(图9)。结果发现,共有16个OTU属于硬皮马勒、23个OTU属于棉草菌、14个OTU属于红菇属。多数OTU形成了独立的进化分支并具有较长的分支长度,可能代表了一些新的分类单元。通过DnaSP软件计算得到3个属的OTUs核苷酸多样性(π)值分别为0.061、0.129和0.117,表明棉草菌的种间遗传多样性最高。
2.4 3不同采样时期弗栎外生菌根真菌群落的变化特征
将每个采样时期所有菌根样品的OTUs数据进行整合,分析不同采样期弗栎外生菌根真菌群落的变化特征。首先,在目的水平上比较了4个时期的群落组成变化(图10),群落结构呈现较明显的演替,主要表现为: 硬皮马勃(牛肝菌目,Boletales)在初始阶段丰度较高,随后呈逐渐下降趋势,但在所有时期丰度仍最高; 相反红菇(红菇目,Russulales)在初始阶段比例极低,随后呈较快增长,但丰度仍未超过硬皮马勃; 棉草菌(革菌目,Thelephorales)在第2个时期的丰度跃升,其余时期较稳定。实地采样中也发现,在冬季母树林能观察到硬皮马勃子实体,而在5月份至少鉴定出2种红菇子实体。该变化特征与硬皮马勃和红菇子实体发生时间基本吻合。
进一步比较各个时期外生菌根真菌群落的β-多样性指数(加权和非将加权)表明,第1个时期与第4个时期的群落结构组成差异最显著(图11)。通过计算4种α-多样性指数,表明第2个采样时期菌根样品的Chao1、ACE、Shannon和Simpson数值最高,且分别与第3和第4个时期的样品之间的差异达到极显著水平(Wilcoxon秩和检验,图12)。基于OTUs的Venn图显示,虽然4个时期样品共有25个相同的OTUs,但第2个采样时期样品种检测到7个特有的OTUs(图13)。非度量多维度(non-metric multidimensional scaling,NMDS)分析表明,除第3个时期和第4个时期的部分样点聚在一起,其余时期的样点基本能很好地分开,stress值为0.157(<0.2的阈值),说明群落结构组成仍存在较明显差异(图14)。

图6 弗栎外生菌根真菌物种组成及相对丰度Fig.6 Relative abundance of ectomycorrhizal fungal communities at different taxonomic levels in Q. virginiana圆圈的大小代表该分类单元的相对丰度。没有鉴定到种水平的OTUs没有纳入分析。The relative abundance is expressed as a percentage. The size of pie chart indicates the relative abundance of corresponding taxonomic level in samples. OTUs not assigned to species level are not included for analysis.

图7 硬皮马勃、棉草菌和红菇等外生菌根真菌在4个采样时期的相对丰度Fig.7 Relative abundances of the ectomycorrhizal Scleroderma, Tomentella and Russula in Q. virginiana root samples across four time points柱状图的样品编号与表1对应,即4个采样时期不同菌根类型样品。下同。The sample names are the same as described in Tab.1. The same below.

图8 基于加权的聚类分析比较4个采样时期不同颜色菌根类型的外生菌根真菌群落结构Fig.8 Comparison of difference of the ectomycorrhizal fungal communities from different colored mycorrhizal root samples of Q. virginiana across four time points based on weighted pair-groups method average (WPGMA) cluster analysis
3 讨论
形成栎树外生菌根的真菌包括有担子菌中的革菌科(Thelephoraceae)、红菇科(Russulaceae)、蜡壳耳科(Sebacinaceae)、牛肝菌科(Boletaceae)、丝膜菌科(Cortinariaceae)(Cairney and Chambers, 1999)。此外,子囊菌中的块菌(Tuber)、空团菌(Cenococcum)和低等菌中的内囊菌目(Endogonales)真菌也能与栎树形成菌根(Yamamotoetal., 2016)。早期对外生菌根真菌资源的研究主要通过描述外生菌根及其形成的子实体的多种形态特征进行鉴定。然而,该方法不能真实、全面反映外生菌根真菌的群落结构。近十年来,基于真菌ITS基因的环境PCR方法(如克隆库测序、Roche 454焦磷酸测序和Illuminar HiSeq等平台)助推了对菌根真菌结构组成及多样性的认识。比如在厚叶栎(Q.crassifolia)的根尖组织中就检测到多达44个外生菌根真菌类群(Morrisetal., 2008)。


图10 4个采样时期弗栎外生菌根真菌相对丰度(在目的水平上)Fig.10 Relative abundance of the detected fungal orders across four time points of pooled samples of Q. virginiana柱状图样品编号代表每个采样时期所有菌根类型的样品(下同)。The sample names indicate the pooled samples across four time points (the same below).

图11 基于UniFrac 距离的β-多样性热图Fig.11 β-diversity heatmap based on the UniFrac distance数值(上下两个值分别代表加权和非加权)表示两组样品之间外生菌根真菌群落的相异系数。Here the weighted Unifrac (upper) and unweighted Unifrac distances are used as the measure index. The value indicates discrepancy coefficient between two group samples.

图12 4个采样时期弗栎外生菌根真菌群落的α-多样性指数Fig.12 α-diversity (based on ACE, Chao1, Shannon and Simpson) in ectomycorrhizal fungal communities across four time points of pooled samples of Q. virginiana利用Wilcoxon 秩和检验进行组间物种多样性差异分析。Differences between the paired samples were performed by Wilcoxon test.

图13 Venn图分析不同采样时期弗栎外生菌根真菌OTUs组成及共有、特有OTUsFig.13 Venn diagram showing all OTUs detected in, shared by and exclusive to each sample type in Q. virginiana

图14 基于NMDS分析的不同采样时期弗栎外生菌根真菌群落组成差异Fig.14 Difference of ectomycorrhizal fungal communities associated with Q. virginiana roots across four time points based on NMDS analysis4种颜色代表4个采样时期,每个样点代表1个重复样品。Colors indicate the different sampling dates and data points represent individual samples
本研究利用扩增子高通量测序技术,对弗栎外生菌根真菌的群落结构组成及不同采样期的变化特征进行了较为细致的分析。从结果看,在不同采样时期弗栎能够形成多种菌根类型,主要以硬皮马勃、棉草菌和红菇等外生菌根真菌为主,与已报道的其他栎树较为相似。上述3个类群还表现出丰富的种间遗传多样性。无论是种内还是种间遗传多样性,均一定程度反映了其功能的多样性,对于提高树木的环境适应性可能有重要的生态学意义(Hazardetal., 2018)。
土壤理化因子和气候可能是影响外生菌根真菌群落差异的驱动因素(陈云等, 2016; Castaoetal., 2017)。比如土壤水分含量对外生菌根真菌组成有显著影响,高湿土壤能显著增加块菌的丰度,而革菌科在中等水分条件下维持较高活力(Cavender-Baresetal., 2009)。从降雨和气温变化的数据来看(图1),从4月份开始有明显的增温和降雨过程,而此时棉草菌的丰度最高,这一结果与上述研究结论是一致的。有研究表明,栎类林中大部分外生菌根真菌类群的丰度在夏季最高(Voíškováetal., 2014)。本研究结果显示只有红菇表现出该动态变化规律,硬皮马勃反而在冬季更占优势,而棉草菌则在早春更为普遍。其他一些不常见的种类如Pisolithus和Hebeloma则只出现在某个采样时期(图7)。这些结果表明弗栎不同的外生菌根真菌种类对气候和土壤水分的响应有较大差异,种类和丰度也存在较明显的变化特征。这可能与真菌本身的生物学性状和生态习性有关,如有性无性繁殖权衡策略的不同、在逆境条件下代谢活力的差异等(Richardetal., 2011)。在对北美红栎(Q.rubra)和橡树栎(Q.prinus)混交林、蒙古栎(Q.mongolica)外生菌根真菌季节动态变化的研究中也得出相似的结论(Walkeretal., 2008; Kimetal., 2016)。另外,本研究还发现虽然第2次和第3次采样时间只间隔40多天,但真菌群落结构组成、多样性和主要类群的丰度均经历了一次剧烈的变化(图10和图12),预示着在这个时间段内降雨或者气温也发生了显著改变,树木光合生理、根系活力也处于较活跃状态,直接或间接造成了真菌群落各成员之间的此消彼长。图1数据看出,4月中旬至5月底,温度逐渐升高,5月份的降水量在2018年上半年处于最高值。因此可理解该2个采样时期弗栎外生菌根真菌群落的明显差异。本研究结果对深入认识弗栎外生菌根真菌多样性、挖掘优良菌株,从而提升弗栎的栽培质量具有科学意义和应用价值。
4 结论
弗栎引种到我国华东滩涂盐碱地后,同样能形成发达的外生菌根。棉革菌、硬皮马勃和红菇是3种主要类群且种间遗传多样性丰富,其中硬皮马勃在各个时期均占优势。弗栎不同的外生菌根真菌种类对气候和土壤水分的响应有较大差异,种类和丰度存在较明显的变化特征。
——基于嵌入理论的分析视角

