转录组与代谢组联合解析红花槭叶片中花青素苷变化机制*
陆小雨 陈 竹 唐 菲 傅松玲 任 杰(. 安徽省农业科学院农业工程研究所 合肥 3004; . 安徽农业大学林学与园林学院 合肥 30036)
花青素苷是决定植物叶片、花和果实颜色的呈色物质,属于类黄酮类次生代谢物(Heetal. 2010; Tanakaetal. 2008, Wuetal. 2005)。花青素苷元主要被分为6种: 矢车菊素苷元、飞燕草素苷元、锦葵花素苷元、天竺葵素苷元、芍药花素苷元、矮牵牛花素苷元(Choetal. 2016)。其中,飞燕草素苷元、锦葵花素苷元和矮牵牛花素苷元是很多蓝紫色植物器官的重要呈色物质,而天竺葵素苷元和矢车菊素苷元是红色植物器官中的主要色素。植物叶片开始衰老时叶绿素会发生降解(Matileetal. 2006),同时不易降解的花青素和类胡萝卜素大量积累,叶片变为红色和黄色(Lietal. 2015)。
高通量测序技术越来越多地被用于植物体内代谢物的分子机制研究(Guoetal. 2017),代谢组学将生物体作为一个动态的整体,通过科学的数据分析技术,来研究其内因或外因导致代谢表观变化的过程,并建立代谢模型(Raietal. 2017; Riaopachónetal. 2009),与转录组学、蛋白组学等数据结合分析更能直接、真实反映机体本身的变化水平。近来,基于组学的方法为生物体中静态和动态的变化提供了更加深入和广泛的研究视野(Deshmukhetal., 2014; Moreno-Risuenoetal., 2010; Raietal., 2016),而多组学联用技术可以用来鉴定和分析代谢途径中单个和多个基因的相互作用(Shenetal. 2016)。例如,Cho等(2016)采用代谢组和转录组联用的方法解析紫色马铃薯(Solanumtuberosum)中花青素苷和类黄酮苷的生物合成机制。
红花槭(Acerrubrum),又名北美红枫,槭属(Acer)落叶乔木,叶色亮丽、多变,是北美各大城市中主要的观赏性树种(Sibleyetal. 1995)。前人在红花槭的生理(Abrams, 1998; Kalubietal. 2016)、生态学特征(Abouzaidetal., 2001; Alexanderetal. 2010; Williamsetal. 2003)、抗逆性机制(Nam-Sooetal. 2016; Nkongoloetal. 2018)、功能性天然产物(Geoffroyetal. 2018; Royeretal. 2011)和叶片色素组成(Schmitzeretal. 2009; 冯立娟等, 2008)等方面的研究取得了很大的进展。红花槭具有广阔的市场前景,其遗传改良成为研究热点(任杰等, 2013; 石柏林等, 2006)。然而,对于非模式植物红花槭的花青素苷生物合成途径仍不够清晰,制约了该物种的叶色定向改良和分子育种。
2017年,在安徽省舒城县发现一株红花槭特殊叶色单株,该单株不同枝条上同时存在红、绿和黄3种颜色的叶片(图1),其叶色已连续2年遗传稳定。本研究选取了该单株上的红叶、绿叶和黄叶作为试验材料,采用代谢组和转录组技术联合分析了不同叶色花青素苷的生物合成机理,旨在为红花槭叶色的分子改良和遗传育种奠定理论基础。
1 材料与方法
1.1 试验材料
2018年11月下旬于安徽省舒城县红花槭培育基地采集红花槭特殊叶色单株上不同分枝的红叶、绿叶和黄叶作为试验材料(图1)。液氮速冻后置于-80 ℃的超低温冰箱进行冷冻保存,备用。
1.2 代谢物提取
50 mg样本置于EP管中,加入1 000 μL提取剂萃取(乙腈∶甲醇∶水的体积比为2∶2∶1,含内标)。涡旋30 s后,重复3次均质化(45 Hz,4 min)和超声处理(4 ℃,5 min),置于-20 ℃冰箱。1 h后取出,4 ℃下离心(12 000 r·min-1,15 min),所得上清液置于-80 ℃超低温冰箱保存备用。红叶、绿叶和黄叶各设定6个生物学重复。质控样本由所有样本的上清液等量混匀制备(Caietal. 2015; Dunnetal. 2011; Wantetal. 2010)。

图1 红花槭特殊叶色单株及取样示例Fig.1 Red maple with special leaf color and sampling example
1.3 UHPLC-QE-MS进行代谢组分析及数据处理
LC-MS分析的仪器平台由Agilent 1290超高效液相色谱串联Thermo Fisher Scientific 的Q Exactive Orbitrap高分辨质谱仪组成。所用色谱柱为UPLC HSS T3 色谱柱 (1.7 μm×2.1 mm×100 mm,Waters)。正模式: 流动相A: 0.1%甲酸水溶液; 流动相B: 乙腈。负模式: 流动相A: 5 mmol·L-1醋酸铵水溶液(用氨水调节pH至9.0); 流动相B: 乙腈。
采用Q Exactive Orbitrap高分辨质谱仪进行一级、二级质谱数据的采集。质谱参数条件如下: ESI离子源喷雾电压3 800 V(正离子模式)或-3 100 V(负离子模式); 毛细管温度320 ℃; 鞘气流速45 Arb; 辅助气流速15 Arb; 扫描范围70~1 000m/z; 一级分辨率70 000; 二级分辨率17 500; 分步碰撞能量的强度取值3; 分步碰撞能量为20、40、60 eV; 扫描速率7 Hz。 选择QC 样本采用Fullms ddMS2方法,分别设置扫描段范围: 1)70~200; 2)190~400; 3)390~600; 4)590~1 000。每个扫描段各采集1次,以获取更多的二级数据进行鉴定(Wangetal. 2016)。
ProteoWizard将MS原始数据文件转换为mzML格式文件,使用R包XCMS(version 3.2)进行进一步处理。 结果是由保留时间(RT)、质荷比(m/z)和峰强度组成的数据矩阵。对峰强度进行积分,所得为各代谢物的积分定量值。 OSI-SMMS(version 1.0)用于MSC数据处理后的峰值计算(Smithetal. 2006)。
R软件包用于代谢组数据的分析和热图的制作。对3种颜色的18个叶片样本进行主成分分析(PCA)和正交偏最小二乘法分析(OPLS-DA)。OPLS-DA中筛选模型变量的变量权重值VIP(variable important in projection)≥1,以及T试验中P<0.05的代谢物作为差异积累代谢物。随后,使用非商业数据库KEGG(Kyoto Encyclopedia of Genes and Genomes,www.genome.jp/kegg)和PMN(Plant Metabolic Network,www.plantcyc.org)来分析苯丙氨酸代谢通路、类黄酮代谢通路以及花青素生物合成通路。PCA和OPLS-DA同样被用于比较关键代谢物之间的具体差异。
1.4 高通量测序进行转录组分析及数据处理
使用RNAprep试剂盒(DP441; Tiangen)分离总RNA样品,并用NanoPhotometer分光光度计(IMPLEN,CA,USA)检查RNA纯度。 每种叶色设定3个生物学重复。Qubit®2.0Flurometer(Life Technologies,CA,USA)中的Qubit®RNA Assay Kit用于RNA浓缩,并在1%琼脂糖凝胶上检测RNA降解和污染。使用Bioanalyzer 2100系统的RNA Nano 6000 Assay Kit(Agilent Technologies,CA,USA)评估总RNA质量。如Pacific Biosciences(PN 100-092-800-03)所述,使用Clontech SMARTer PCR cDNA Synthesis Kit和BluePippin Size Selection System方案,根据Isoform测序(Iso-Seq)制备Iso-Seq文库。Clontech SMARTer PCR cDNA合成试剂盒用于第1链cDNA合成: 首先将CDS引物IIA退火至转录物的polyA+尾部,用SMARTScribe TM逆转录酶进行第1链合成。将第1链产物用洗脱缓冲液(EB)稀释至合适的体积后用于大规模PCR。使用SMRTlink 5.0软件处理序列数据。由子读文件BAM生成CCS,参数: min_length 200,max_drop_fraction 0.8,no_polish TRUE,min_zscore-999.0,min_passes 1,min_predicted_accuracy 0.8,max_length 18 000。将输出的CCS.BAM文件使用pbclassify.py进行分类,利用ignorepolyA false、minSeqLength 200读取全长和非全长序列。将生成的全长和非全长fasta文件输入到群集步骤,该步骤执行同种型级别聚类(ICE),采用如下参数进行最后的数据处理: hq_quiver_min_accuracy 0.99,bin_by_primer false,bin_size_kb 1,qv_trim_5p 100,qv_trim_3p 30。使用Illumina RNAseq数据和软件LoRDEC校正共有读数中的错误核苷酸。通过CD-HIT软件除去校正的共有读数中的冗余,以获得用于后续分析的最终转录本。
基于以下数据库注释基因功能: NR(NCBI非冗余蛋白质序列); NT(NCBI非冗余核苷酸序列); Pfam(蛋白质家族); KOG/ COG(直系同源蛋白质群); Swiss-Prot(手动注释和评论的蛋白质序列数据库); KO(KEGG Ortholog数据库); GO(Gene Ontology数据库)。通过RSEM对每个样品估计基因表达水平(Lietal. 2011): 1)将无冗余数据反映回转录物序列; 2)从映射结果中获得每个转录物的读数。使用DESeq R包(1.10.1)进行2个条件/组的差异表达分析。基于负二项分布的模型确定数字基因表达数据中的差异表达。使用Benjamini和Hochberg的方法调整得到的P值以控制错误发现率。DESeq中P<0.05的基因被指定为差异表达。用KOBAS软件测试KEGG途径中差异表达基因的统计富集。HTSeq v0.6.1用于计数映射到每个基因的读数。然后基于基因的长度计算每个基因的FPKM值(expected number of Fragments Per Kilobase of transcript sequence per Millions base pairs sequenced, 每百万fragments中来自某一基因每千碱基长度的fragments数目),并将读数计数映射到该基因(Coleetal. 2010)。
1.5 采用斯皮尔曼相关分析基因与代谢物之间的网络互作
与皮尔森(Pearson)相关不同,斯皮尔曼(Spearman)相关用于分析不具有线性关系的2组数据集(Rebekietal., 2015; Haukeetal.,2011; Sapnaetal., 2012)。用Graphpad Prism8软件对绿叶、红叶、黄叶中花青素代谢通路上差异积累代谢物与差异表达基因的数据集做斯皮尔曼相关性分析 (Moschenetal., 2016; Luetal., 2020; Chenetal., 2019),显著性系数P<0.05且斯皮尔曼相关系数|r|>0.9被认定为2个对象之间具有强相关性。针对具有强相关性的差异积累代谢物和差异表达基因用Cytoscape 3.6.1做网络互作图。
2 结果与分析
2.1 代谢组的多元统计分析
基于正离子模式(POS)和负离子模式(NEG)的UHPLC-QE-MS数据对红叶、绿叶和黄叶中不同的代谢物组成进行多元统计分析。主成分分析(PCA)得分图表示不同样本原始数据的分离程度(Songetal. 2017)。图2A和B表明红叶、绿叶和黄叶3个样本组数据的分离程度清晰。正离子模式下,第1主成分(PC1)和第2主成分(PC2)分别占总变量的60.8%和13%; 负离子模式下,PC1和PC2分别占总变量的63.6%和12.2%。
结合正交最小偏二乘判别分析(OPLS-DA)的VIP值和单变量统计分析T检验P值来筛选不同比较组间的显著差异代谢物。其中,VIP≥1和T检验P<0.05被鉴定为显著差异代谢物。如图2C和D所示,正、负离子模式下,分别检测出2 321个和1 124个无冗余的差异积累代谢物: 正离子模式下,绿叶和红叶之间检测出1 377个差异代谢物,绿叶和黄叶之间检测出1 793个差异代谢物,红叶和黄叶之间检测出1 098个差异代谢物; 负离子模式下,绿叶和红叶之间检测出789个差异代谢物,绿叶和黄叶之间检测出699个差异代谢物,红叶和黄叶之间检测出677个差异代谢物。图2E显示正离子模式下,绿叶和红叶之间有706个上调差异代谢物和671个下调差异代谢物,绿叶和黄叶之间有537个上调差异代谢物和1 256个下调差异代谢物,红叶和黄叶之间有192个上调差异代谢物和906个下调差异代谢物。图2F显示负离子模式下,绿叶和红叶之间有355个上调差异代谢物和434个下调差异代谢物,绿叶和黄叶之间有141个上调差异代谢物和558个下调差异代谢物,红叶和黄叶之间有70个上调差异代谢物和607个下调差异代谢物。
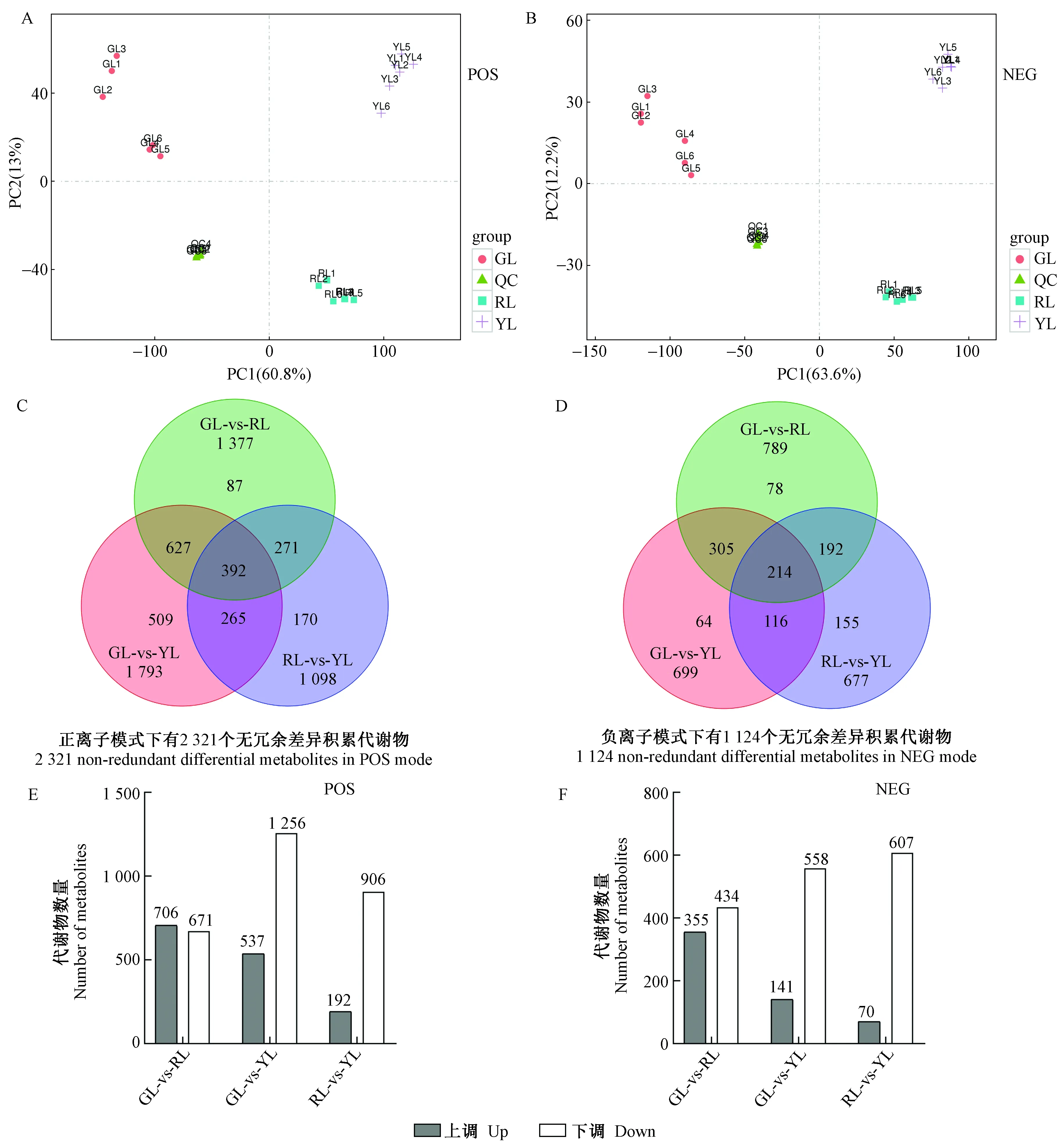
图2 红叶(RL)、绿叶(GL)和黄叶(YL)的PCA得分图(A, B)、差异代谢物韦恩图(C, D)和上/下调差异代谢物统计图(E,F)Fig.2 PCA score plots(A, B), Venn diagram of differential metabolites(C, D), and up-/down-regulated metabolites statistics(E,F) of red leaves (RL), green leaves (GL), and yellow leaves (YL)QC: 质控样本; POS: 正离子模式; NEG: 负离子模式。QC: Quality control; POS: Positive mode; NEG: Negative mode.
2.2 花青素苷差异代谢物分析
将鉴定出的红花槭中花青素苷相关代谢物与KEGG数据库的相关代谢物进行比对分析, 并将其分配至花青素苷合成途径中的相应位置。在花青素苷合成的初始阶段,查尔酮合成酶(CHS)催化对香豆酰辅酶A(p-coumaroyl-CoA)生成查尔酮(chalcone),查尔酮进一步被查尔酮异构酶(CHI)异构为柚皮素(naringenin),接着柚皮素在黄烷酮-3-羟化酶(F3H)的催化下于3号位加入1个羟基生成二氢山奈酚(dihydrokaempferol,DHK),二氢山奈酚被黄烷酮-3′-羟化酶(F3′H)和黄烷酮-3′,5′-羟化酶(F3′5′H)分别催化生成二氢槲皮素(dihydroquercetin,DHQ)和二氢杨梅素(dihydromyricetin,DHM)。此后,花青素苷的合成分为3个分支: 二氢山奈酚、二氢槲皮素和二氢杨梅素分别被二氢黄烷酮-4-还原酶(DFR)催化生成不同的无色花青素苷元(leucoanthocyanidins)——二氢山奈酚催化成原天竺葵素苷元(leucopelargonidin),二氢槲皮素生成原矢车菊素苷元(leucocyanidin),二氢杨梅素生成原飞燕草素苷元(leucodelphindin)。最终,3种原花青素苷元被花青素苷合成酶(ANS)催化分别生成橙红色的天竺葵素苷元(pelargonidin)、矢车菊素苷元(cyanidin)和飞燕草素苷元(delphindin)。这些花青素苷元可以被甲基化、糖基化和酰基化等修饰成不同的、结构稳定的花青素苷衍生物。图3是根据每个代谢物的积分定量值所作的热图分析。如图所示,红叶中花青素苷及其衍生物的积累量明显高于绿叶、黄叶的积累量,这表明其对红花槭的叶片色素形成起着关键作用。花青素苷衍生物代码和名称如表1所示。在花青素苷合成的第1阶段(图4第1阶段),柚皮素和DHK在红叶中大量的积累。虽然黄叶中的柚皮素的积累量在3种颜色的叶片中最高,但是其DHK的积累量很低。在花青素苷合成的第2阶段(图4第2阶段),红叶与绿叶相比,积累了更多的无色黄酮醇(槲皮素、山奈酚和杨梅素),但黄叶中的这3种黄酮醇的含量要低于绿叶。在花青素苷合成的第3阶段(图4第3阶段),红叶和黄叶中的儿茶素、表儿茶素、表没食子儿茶素、飞燕草素苷、矢车菊素苷衍生物、天竺葵素苷衍生物和飞燕草素苷衍生物的积累量都高于绿叶,在3种颜色的叶片中,黄叶中含最多的没食子儿茶素,红叶中没食子儿茶素的含量最少,绿叶中含有最多的无色矢车菊素苷元和飞燕草素苷衍生物。
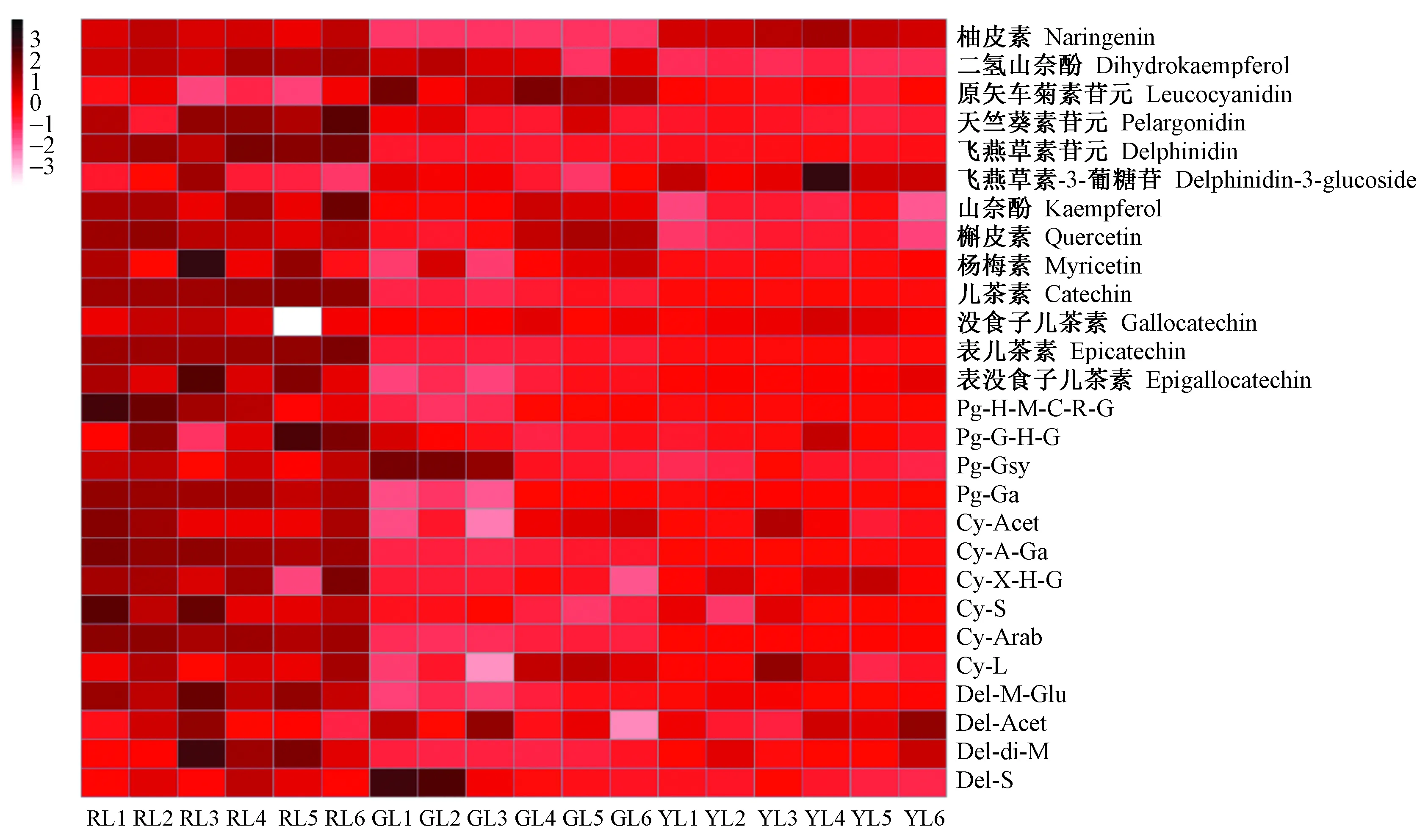
图3 红叶 (RL)、绿叶 (GL) 和黄叶 (YL) 中与花青素苷合成相关代谢物的热图分析Fig.3 Heat maps of anthocyanidin-related metabolites of red leaves (RL), green leaves (GL), and yellow leaves (YL)

表1 花青素苷衍生物名称Tab.1 Name of anthocyanin derivatives
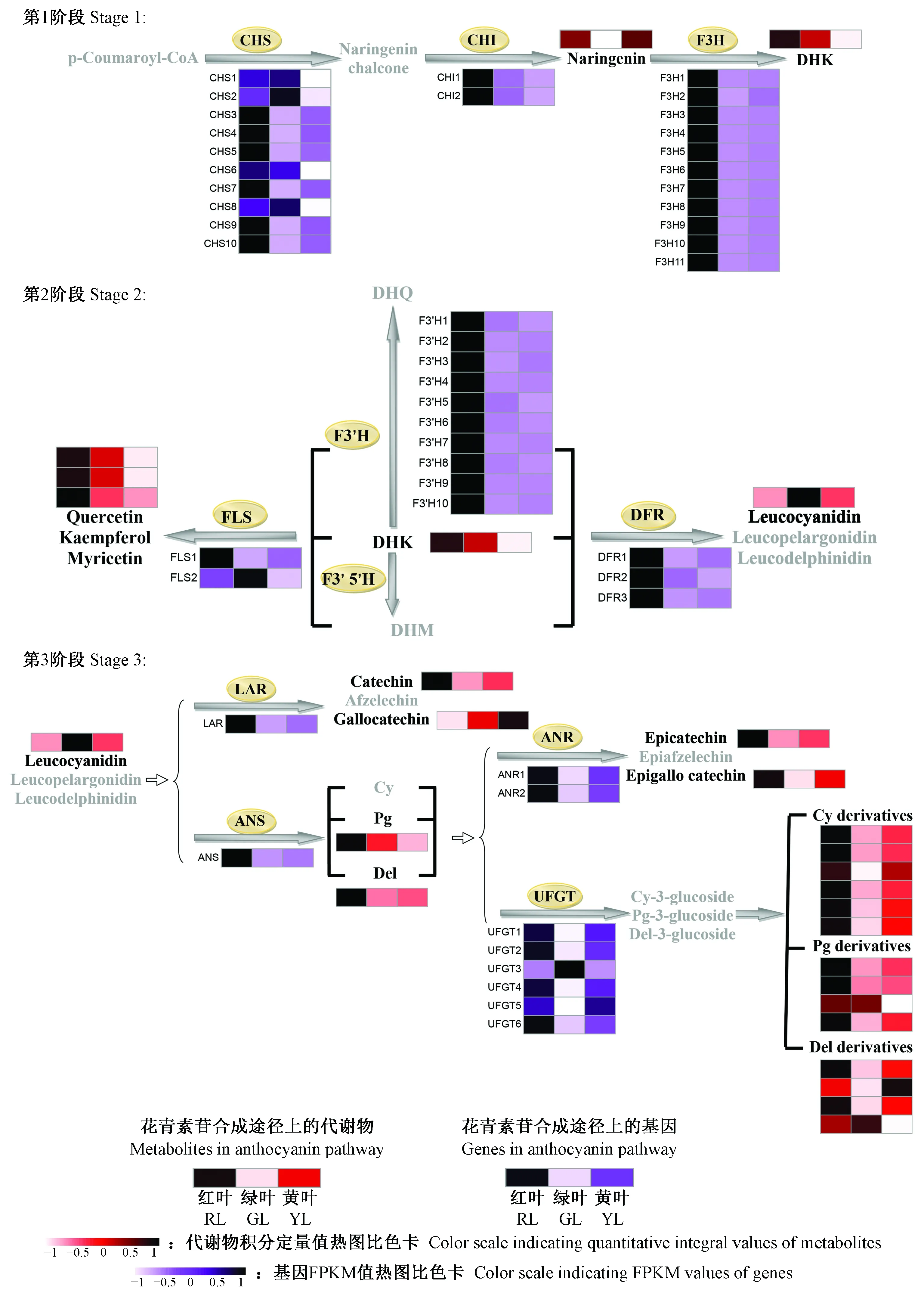
图4 红叶、绿叶和黄叶中花青素苷合成途径上相关基因和代谢物的细节展示Fig.4 Detailed portion of the anthocyanin biosynthesis pathway that reveals the various expressions of related genes and different contents of metabolitesCHS: 查尔酮合成酶; CHI: 查尔酮异构酶; F3H: 黄烷酮3-羟化酶; F3′H: 黄烷酮3′-羟化酶; F3′5′H: 黄烷酮3′5′-羟化酶; DFR: 二氢黄酮醇4-还原酶; ANS: 花青素苷合成酶; UFGT: 类黄酮3-O-葡糖基转移酶; FLS: 黄酮醇合成酶; LAR: 原花青素苷元还原酶; ANR: 花青素苷还原酶。P-Coumaroyl-CoA: 对肉桂酸辅酶A; Naringenin chalcone: 柚皮素查尔酮; Naringenin: 柚皮素; DHK: 二氢山奈酚; DHQ: 二氢槲皮素; DHM: 二氢杨梅素; Quercetin: 槲皮素; Kaempferol: 山奈酚; Myricetin: 杨梅素; Leucocyanidin: 原矢车菊素苷元; Leucopelargonidin: 原天竺葵素苷元; Leucodelphnidin: 原飞燕草素苷元; Catechin: 儿茶素; Afzelechin: 阿福豆素; Gallocatechin: 没食子儿茶素; Cy: 矢车菊素苷; Pg: 天竺葵素苷; Del: 飞燕草素苷; Epicatechin: 表儿茶素; Epiafzelechin: 表阿福豆素; Epigallocatechin:表没食子儿茶素; Cy-3-glucoside:矢车菊素-3-葡糖苷; Pg-3-glucoside: 天竺葵素-3-葡糖苷; Del-3-glucoside: 飞燕草素-3-葡糖苷。CHS: Chalcone synthase; CHI: Chalcone isomerase; F3H: Flavanone 3-hydroxylase; F3′H: Flavanone 3′-hydroxylase; F3′5′H: Flavanone 3′,5′-hydroxylase; DFR: Dihydroflavonol 4-reductase; ANS: Anthocyanidin synthase; UFGT: Flavonoid 3-O-glucosyltransferase; FLS: Flavonol synthase; LAR: Leucoanthocyanidin reductase; ANR: Anthocyanidin reductase; DHK: Dihydrokaempferol; DHQ: Dihydroquercetin; DHM: Dihydromyricetin; Cy: Cyanidin; Pg: Pelargonidin; Del: Delphinidin.
2.3 转录组数据的统计分析
转录组测序中共检测出49 521个无冗余的差异表达基因。红叶-绿叶比较组中有14 009个差异表达基因上调,14 527个差异表达基因下调; 黄叶-绿叶比较组中有20 824个差异表达基因上调,22 193个差异表达基因下调; 红叶-黄叶比较组中有13 620个差异表达基因上调,13 490个差异表达基因下调(图5A, B)。KEGG富集分析显示,在红叶-绿叶、红叶-黄叶比较组中,苯丙氨酸合成通路和类黄酮合成通路都为显著富集通路(校正P≤1),而在黄叶-绿叶比较组中,这2个通路并没有表现出显著富集(表2)。基于花青素苷相关的差异表达基因的FPKM值做热图(图5C)分析,71.4%差异表达基因在红叶中表达量最高,包括CHS,CHI,F3H,F3′H,DFR,ANS,ANR,LAR和UFGT。绿叶中,CHS8,FLS2和UFGT3的表达量高于红叶和黄叶。UFGT5在黄叶中的表达量高于红叶和绿叶。红叶与绿叶相比,花青素苷合成通路上89.5%的差异基因表达量上调; 黄叶与绿叶相比,花青素苷合成通路上66.7%的差异基因表达量上调。在花青素苷合成的第1阶段(图4第1阶段),从基因的角度,尽管红叶中的CHS1,CHS2,CHS6和CHS8基因的表达量比绿叶中的低,但是红叶中大部分的CHS基因、2个CHI基因和11个F3H基因与绿叶相比都表现出较高的表达量。黄叶中的6个CHS基因(CHS3,CHS4,CHS5,CHS7,CHS9和CHS10)和11个F3H基因的表达量比绿叶中的高,相反,所有CHI基因的表达量较绿叶都呈现出较低的表达。在花青素苷合成的第2阶段(图4第2阶段),在基因方面,红叶和黄叶中的FLS1的表达量都比绿叶中高,但是其中的FLS2的表达量比绿叶中的低。在3种颜色的叶片中,红叶中所有的F3′H和DFR基因的表达量最高。DFR1和DFR3在黄叶中表达较高,但是黄叶中DFR2的表达量低于绿叶。在花青素苷合成的第3阶段(图4第3阶段),在基因方面,红叶和黄叶中除了UFGT3基因以外,所有的基因都较绿叶有着更高的表达。
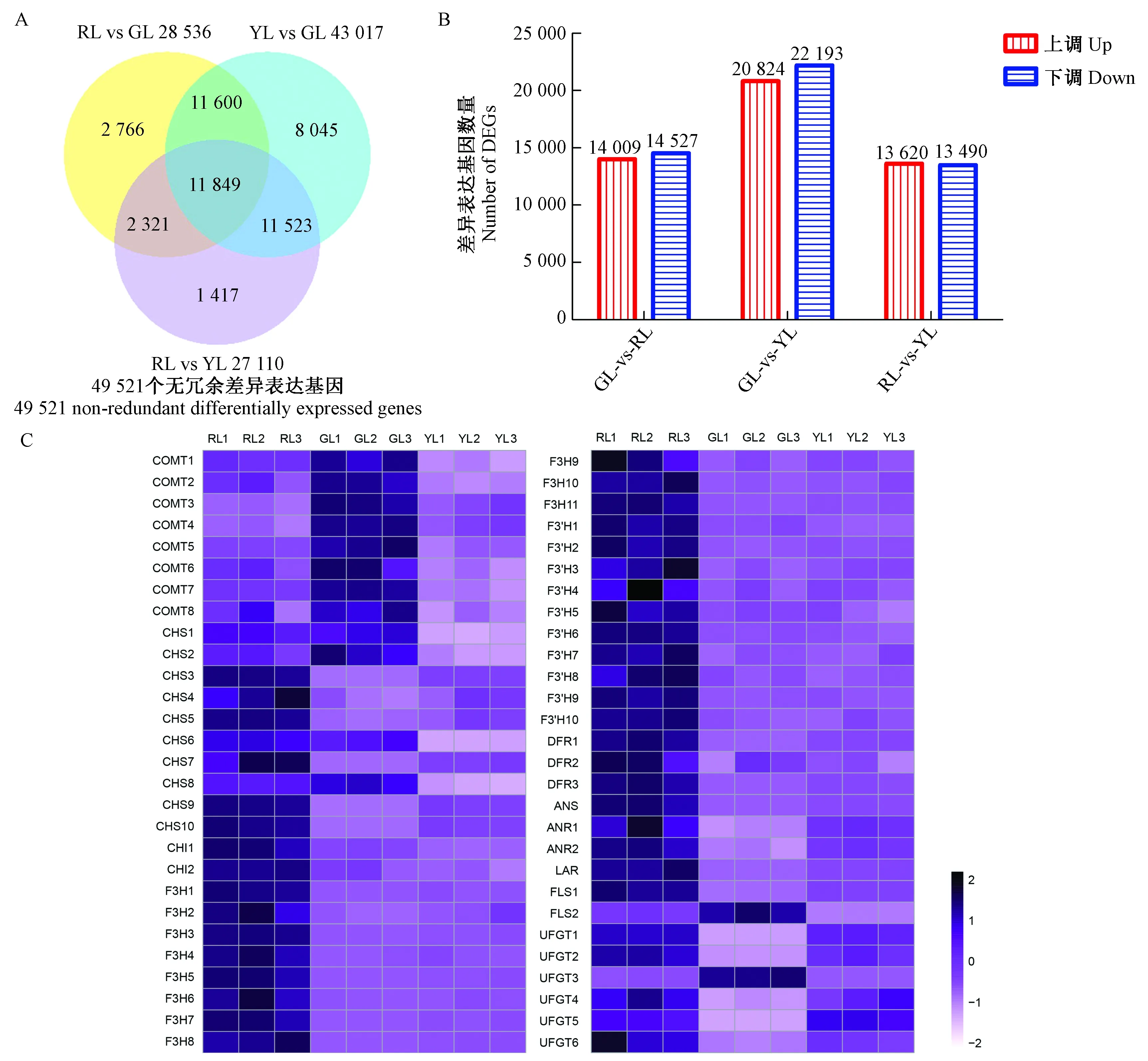
图5 红叶(RL)、绿叶(GL)、黄叶(YL)不同比较组间差异表达基因的韦恩图(A)、差异表达基因上/下调统计图(B)和差异表达基因热图分析(C)Fig.5 Venn diagram (A), differentially expressed gene up/down regulation (B) and differentially expressed gene heat map analysis(C) of red leaf (RL), green leaf (GL) and yellow leaf (YL)

表2 不同比较组间显著富集KEGG通路(修正P≤0.01)Tab.2 Significantly enriched KEGG pathways in different comparison groups (corrected P≤0.01)
续表2Continued
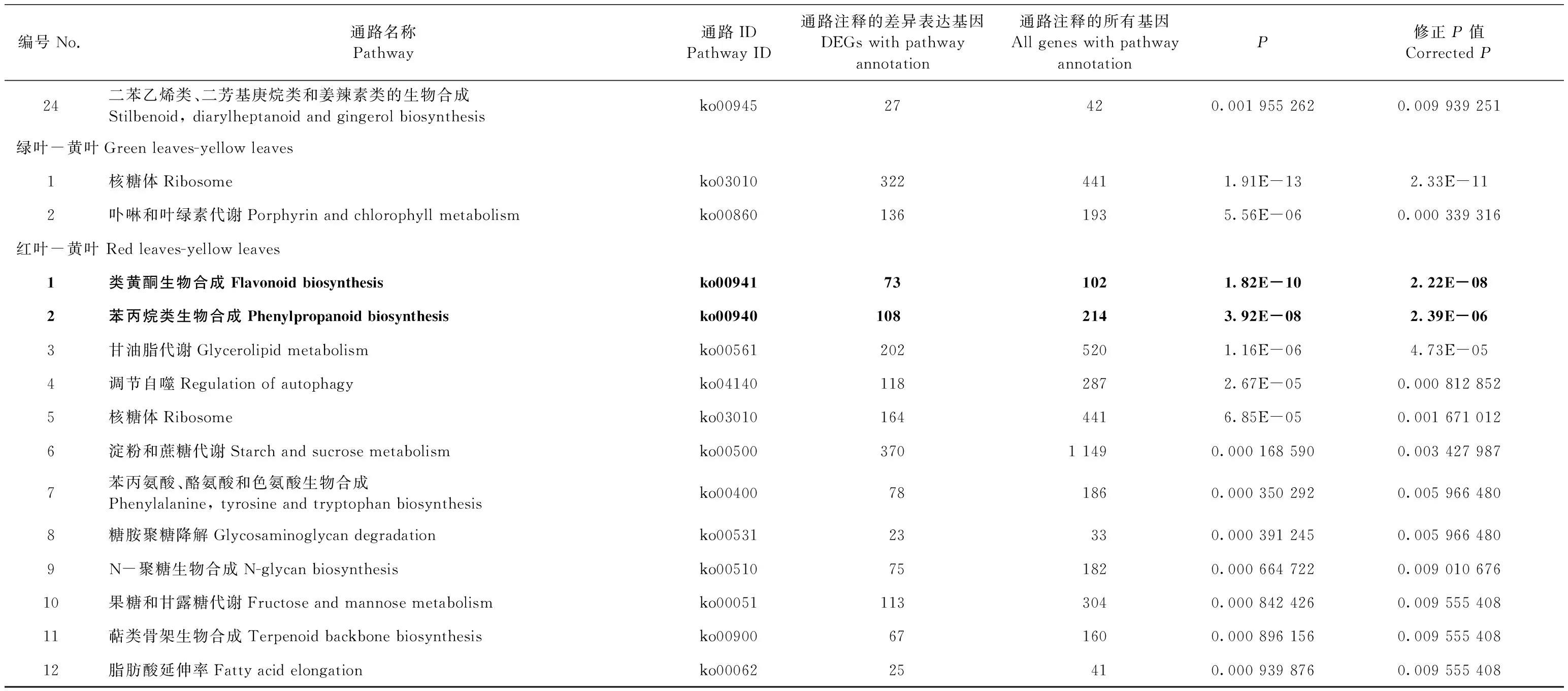
编号No.通路名称Pathway通路IDPathway ID通路注释的差异表达基因DEGs with pathway annotation通路注释的所有基因All genes with pathway annotationP修正P值Corrected P24二苯乙烯类、二芳基庚烷类和姜辣素类的生物合成Stilbenoid, diarylheptanoid and gingerol biosynthesisko0094527420.001 955 2620.009 939 251绿叶-黄叶Green leaves-yellow leaves1核糖体Ribosomeko030103224411.91E-132.33E-112卟啉和叶绿素代谢Porphyrin and chlorophyll metabolismko008601361935.56E-060.000 339 316红叶-黄叶 Red leaves-yellow leaves1类黄酮生物合成Flavonoid biosynthesisko00941731021.82E-102.22E-082苯丙烷类生物合成Phenylpropanoid biosynthesisko009401082143.92E-082.39E-063甘油脂代谢Glycerolipid metabolismko005612025201.16E-064.73E-054调节自噬Regulation of autophagyko041401182872.67E-050.000 812 8525核糖体Ribosomeko030101644416.85E-050.001 671 0126淀粉和蔗糖代谢Starch and sucrose metabolismko005003701 1490.000 168 5900.003 427 9877苯丙氨酸、酪氨酸和色氨酸生物合成Phenylalanine, tyrosine and tryptophan biosynthesisko00400781860.000 350 2920.005 966 4808糖胺聚糖降解Glycosaminoglycan degradationko0053123330.000 391 2450.005 966 4809N-聚糖生物合成N-glycan biosynthesisko00510751820.000 664 7220.009 010 67610果糖和甘露糖代谢Fructose and mannose metabolismko000511133040.000 842 4260.009 555 40811萜类骨架生物合成Terpenoid backbone biosynthesisko00900671600.000 896 1560.009 555 40812脂肪酸延伸率Fatty acid elongationko0006225410.000 939 8760.009 555 408
2.4 花青素苷相关代谢物与转录组关联分析
对红花槭花青素苷合成通路上的相关差异积累代谢物和差异表达基因进行调控网络关联性分析。在花青素苷合成通路中,共有14个差异表达基因与6个差异积累代谢物具有强烈的相关性(图6)。绝大多数基因(CHS2,CHS7,CHS8,F3H1,F3H5,F3H7,F3H8,F3H10,F3′H2,LAR,FLS1,FLS2,UFGT4)均与天竺葵素苷衍生物和飞燕草素苷衍生物之间存在负相关,说明这些基因可能逆向调控天竺葵素苷衍生物和飞燕草素苷衍生物的合成,而UFGT5与矢车菊素-3-阿拉伯糖苷之间存在正相关则说明UFGT5正向调控矢车菊素苷衍生物的合成。
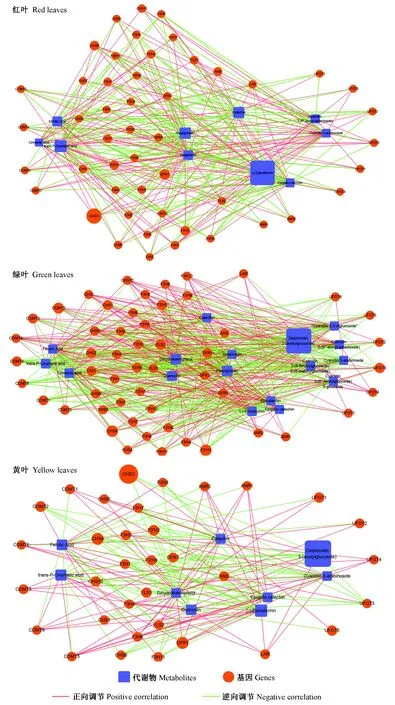
图6 红花槭中与花青素苷合成相关的基因和代谢物的网络互作Fig.6 Strong correlations between anthocyanin biosynthesis-related genes and anthocyanin-related metabolites in red mapleCHS: 查尔酮合成酶编码基因; F3H: 黄烷酮3-羟化酶编码基因; F3′H: 黄烷酮3′-羟化酶编码基因; UFGT: 类黄酮3-O-葡糖基转移酶编码基因; LAR: 原花青素苷元还原酶编码基因; FLS: 黄酮醇合成酶编码基因; Catechin: 儿茶素; Epigallo catechin: 表没食子儿茶素。 代谢物Pg-Gsy, Del-S, Del-M-Glu, Cy-Arab 名称见表1。CHS: Chalcone synthase encoding gene; F3H: Flavanone 3-hydroxylase encoding gene; F3′H: Flavanone 3′-hydroxylase encoding gene; UFGT: Flavonoid 3-O-glucosyltransferase encoding gene; LAR: Leucoanthocyanidin reductase encoding gene; FLS: Flavonol synthase encoding gene. The metabolites Pg-Gsy, Del-S, Del-M-Glu, Cy-Arab are shown in Tab. 1.
3 讨论
为了探讨红花槭叶片变色期间花青素苷代谢物和相关基因的变化规律,下面将以绿叶作为对照组,讨论相关基因和代谢物在3种颜色的叶片中协同作用的差异。
前人的研究表明,查尔酮合成酶(CHS)缩合对香豆酰辅酶A,并使丁烯酮分子内环化形成柚皮素查尔酮(2′,4,4′,6′-四羟基查尔酮)(Koesetal. 2005; 1989)。非洲菊(Gerberahybrida)的CHS基因的表达水平与花青素苷的合成呈正相关(Dengetal. 2014)。查尔酮异构酶迅速催化柚皮素查尔酮,使其立体特异性环化成柚皮素(Naringenin)(Kuittinenetal. 2000; Shimadaetal. 2003)。用RNA干扰技术抑制矮牵牛(Petuniahybrida)中CHI的表达,使其花色变淡,花瓣中的花青素苷含量降低(Chuetal. 2015)。F3H基因作用在柚皮素3号位(Kumaretal. 2015),催化立体特异性羟基化反应,形成后续花青素苷合成的关键物质DHK (Hanetal. 2017)。在本研究的3种颜色的叶片中,花青素苷合成的第1阶段(图4第1阶段),对香豆酰辅酶A和柚皮素查尔酮的含量极低,一个可能的解释是这2种物质因其不稳定的化学结构而在叶片中存在的时间非常短暂,以至于无法被检测出——对香豆酰辅酶A一旦形成就会迅速转化成柚皮素查尔酮,接着被迅速催化形成柚皮素。因此,可以推断当绿叶变红时,花青素苷合成的第1阶段的所有基因的表达量增加,导致柚皮素和DHK的大量积累。类似地,当绿叶变黄时,大多数CHS基因和所有的F3H基因表达量增加,而CHI基因的表达量降低,黄叶中的柚皮素含量最高,但是黄叶中DHK含量在3种颜色叶片中最低,其原因可能是大多数F3H基因在类黄酮通路的其他分支发挥着催化作用,Springob等(2003)报道了F3H基因在除花青素苷合成之外的其他类黄酮支路发挥着催化作用。
F3′H和F3′5′H分别通过催化DHK使其羟基化而形成2R,3R-二氢槲皮素(DHQ)和2R,3R-二氢杨梅素(DHM)(Tanakaetal. 2008),这使得F3′H和F3′5′H成为确定B环黄酮类产物和花青素苷羟基化进程的关键酶(Heetal. 2013)。DFR催化3种二氢黄酮醇(DHK, DHQ和DHM)并生成相应的无色原花青素苷元(原天竺葵素苷元,原矢车菊素苷元,原飞燕草素苷元),FLS的作用在于催化二氢黄酮醇转化为3种不同的黄酮醇(槲皮素、山奈酚和杨梅素),Davies等(2003)报道了FLS分支会逆向调节花青素苷的合成,Qian等(2014)的研究发现葡萄风信子(Muscariarmeniacum)中作用在DHM上的DFR和FLS之间有着很强烈的竞争关系。与第1阶段的对香豆酰辅酶A和柚皮素查尔酮一样,在红花槭花青素苷合成的第2阶段(图4 第2阶段)并未检测到DHM、DHQ、原天竺葵素苷元和原飞燕草素苷元的原因可能在于它们不稳定的化学结构。当绿叶衰老时,FLS1的表达量增加,FLS2的表达量减少,在此趋势的影响下,红叶本应该与绿叶含有等量的槲皮素、山奈酚和杨梅素,但是本研究的结果显示红叶中的这3种物质的积累量远远高于绿叶,这可能在于红叶在第1阶段中产生的DHK多于绿叶造成的。同样地,第1阶段积累了较少量的DHK,这使得黄叶中槲皮素、山奈酚和杨梅素含量也较少。此外,绿叶开始衰老后,红叶和黄叶中的DFR基因表达呈上升趋势。
前人对于第3阶段(图4第3阶段)的相关基因做了大量的研究:ANS催化原花青素苷元合成有色花青素苷的前体物质(Tanakaetal. 2008)。过表达纯化后的紫苏(Perillafrutescens)ANS,使得在HCl酸化环境中有更多的原花青素苷元转化成花青素苷(Kitadaetal. 2001)。UFGT可以在3-O-位置糖基化花青素苷使其变得更加稳定(Fordetal. 1998)。UFGT基因正向调节花青素苷合成的现象已经在多种植物中被报道,包括甜橙(Citrussinensis)(Pieroetal. 2005)、葡萄(Vitisvinifera)(Kobayashietal. 2001)、紫色马铃薯(Huetal. 2011),而在本研究中图4和表2的结果也印证了这一点。LAR催化原花青素苷元合成相应的类黄酮产物(儿茶素、阿福豆素和没食子儿茶素),ANR催化还原花青素苷元并相应地合成表儿茶素、表阿福豆素和表没食子儿茶素。夏涛等(2009)报道了LAR和ANR表达量上调导致了茶叶中原花青素苷(儿茶素和表儿茶素的结合产物)的含量增加。Liu等(2013)在拟南芥(Arabidopsisthaliana)突变体上过表达了可可树(Theobromacacao)的ANR基因,导致其下胚轴中花青素苷的含量降低。由此可以发现LAR和ANS之间、ANR和UFGT之间存在竞争的关系。本研究中未检出阿福豆素和表阿福豆素,原因可能在于LAR催化无色天竺葵素苷元以及ANR催化天竺葵素苷的过程被阻断。如上所述,ANR和UFGT催化3种花青素苷分别生成相应的类黄酮产物和花青素苷衍生物,除此之外,还有一部分未反应完全的花青素苷被积累。图7A,B,C表明,红叶、绿叶和黄叶中花青素苷和类黄酮产物的含量之间都存在此消彼长的趋势。3种颜色的叶片中,对于矢车菊素苷来说,被UFGT催化生成的矢车菊素苷衍生物的含量比被ANR催化而成的表儿茶素含量高,矢车菊素苷反应完全; 对于天竺葵素苷来说,被ANR催化而生成表阿福豆素的分支被阻断,除了被催化生成的部分天竺葵素苷衍生物之外,还有部分未反应完全的天竺葵素苷被积累下来; 对于飞燕草素苷来说,被UFGT催化而成的飞燕草素苷衍生物的含量比被ANR催化而成的表没食子儿茶素含量低。其原因可能与ANR和UFGT在化学结构相似的不同底物中竞争优势的差异有关。基于花青素苷合成的第3阶段的结果可知,一旦绿叶开始衰老,第3阶段中几乎所有基因的表达量都呈现上升趋势。经过一系列复杂的催化反应之后,不同色素的相互作用使绿叶变为黄色或者红色。本研究中未检出矢车菊素苷单体,但是检测出6种矢车菊素苷的衍生物——矢车菊素-3-(4-乙酰葡萄糖苷)、矢车菊素-3-(6″-乙酰半乳糖苷)、矢车菊素-O-(吡喃木糖基-羟基肉桂基-吡喃葡萄糖基)、矢车菊素-3-桑布双糖苷、矢车菊素-3-阿拉伯糖苷、矢车菊素-3-昆布双糖苷,这与李玲(2013)的研究中红花槭中决定性色素是矢车菊素单体和矢车菊素-半乳糖苷不同,造成这种差异可能是由于流动相不同。矢车菊素苷衍生物在酸性较强的流动相中糖苷键断裂,从而生成矢车菊素苷单体(Zhengetal. 2003); 本研究代谢组检测试验中采用的UHPLC-Q-E-MS方法中流动相为0.1%甲酸、5 mmol·L-1乙酸铵,酸性较弱,矢车菊素衍生物不易发生水解,导致检测出不同的矢车菊素衍生物,而矢车菊素单体无法被检测出。如图7D所示,当绿叶变红时,深红色的矢车菊素苷衍生物、橙红色的天竺葵素苷和天竺葵素苷衍生物、蓝紫色的飞燕草素苷和飞燕草素苷衍生物的含量显著增加; 当绿叶变黄时,矢车菊素苷衍生物、飞燕草素苷和飞燕草素苷衍生物含量增加,而天竺葵素苷和天竺葵素苷衍生物含量减少。3种类型的色素在红叶中的含量最高,这使得红叶呈现出较黄叶更深的对比色。值得注意的是,矢车菊素苷衍生物在红叶和黄叶中的积累量均高于其他2种类型色素的积累量,而在检测出的6种矢车菊素苷衍生物中,红叶和黄叶中矢车菊素-3-(6″-乙酰半乳糖苷)和矢车菊素-3-阿拉伯糖苷的含量显著高于其他4种衍生物的含量(图8),由此可以推断出矢车菊素苷衍生物是红花槭叶片衰老后叶色的决定性因素。
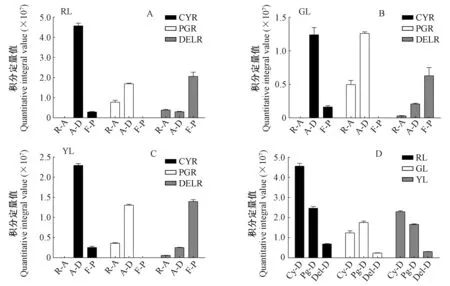
图7 红叶(A)、绿叶(B)、黄叶(C)中花青素苷、花青素苷衍生物和类黄酮产物的含量及3种颜色的叶片中花青素苷类色素的含量(D)Fig.7 Content of anthocyanidins, anthocyanidin derivatives, and flavonoid products in red leaves(A), green leaves(B), yellow leaves(C) and content of three types of anthocyanidin-related pigments in red, green, and yellow leaves(D)RL: 红叶; GL: 绿叶; YL: 黄叶; CYR: 矢车菊素苷元相关反应; PGR: 天竺葵素苷元相关反应; DELR: 天竺葵素苷元相关反应; R-A: 剩余花青素苷元; A-D: 花青素苷衍生物; F-P: 类黄酮产物; Cy-D: 矢车菊素苷衍生物; Pg-D: 天竺葵素苷衍生物; Del-D: 飞燕草素苷衍生物。RL: Red leaves; GL: Green leaves; YL: Yellow leaves; CYR: Cyanidin reactions; PGR: Pelargonidin reactions; DELR: Delphinidin reactions; R-A: Residual anthocyanidin; A-D: Anthocyanidin derivatives; F-P: Flavonoid product; Cy-D: Cyanidin derivatives; Pg-D: Pelargonidin derivatives; Del-D: Delphinidin derivatives.
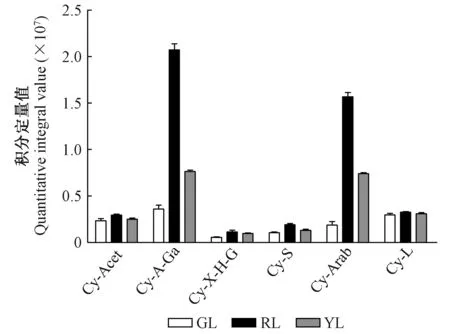
图8 绿叶(GL)、红叶(RL)、黄叶(YL)中不同矢车菊素苷衍生物的含量Fig.8 Content of different cyanidin derivatives in green leaves(GL), red leaves(RL) and yellow leaves(YL)代码见表1。The code is shown in Tab. 1.
4 结论
本文通过代谢组和转录组关联分析,研究了红花槭红叶、黄叶、绿叶中花青素苷合成相关的基因表达和代谢物积累的变化情况,用红花槭特殊叶色单株,从代谢组和转录组的视角阐明绿叶在衰老后变黄或者变红的分子机制。当该单株的绿叶变红时,花青素苷合成通路中89.5%的基因表达量增加,变黄时则有66.7%的差异基因表达量增加,矢车菊素-3-(6″-乙酰半乳糖苷)和矢车菊素-3-阿拉伯糖苷的含量大幅上升,是叶片变色的主要驱动因子。然而,红花槭中花青素苷的合成包含着非常复杂的生物过程和相互作用机制,未来的研究将关注其花青素苷合成途径上关键代谢物和关键基因的功能性研究。随着基因工程被广泛应用于观赏植物的遗传育种,该研究可为红花槭的叶色定向改良提供科学的理论依据。

