中国主栽樱花的分子系统发育分析
付 涛 王志龙* 林乐静 林 立 李 文 袁冬明
(1. 宁波城市职业技术学院/浙江园林绿化技术协同创新中心,宁波 315100;2. 宁波市鄞州区林业技术管理服务站,宁波 315100)
樱花为樱属(Cerasus)植物栽培品种的统称,经过几百年的培育,已有几百个品种,目前国内主栽的樱花大多数是日本品种,很多景区、公园、学校、街道甚至是家庭都有日本樱花的种植,最常见的有染井吉野樱(俗称早樱)和关山樱(俗称晚樱),然而,有许多品种亲本来源不明、种系定位不一、命名不规范等诸多问题,不利于樱花产业的健康发展[1~3]。我国拥有丰富的野生资源,远超日本和朝鲜等国家[4],然而我国重视食用樱桃的栽培,对具有观赏性的樱属植物关注甚少,育成品种更少,但近几年国内“樱花热”持续升温,对自主樱花品种的培育也在如火如荼地进行中,依托我国丰富的野生资源(我国约50 种樱属植物),不久的将来,将会拥有一大批具有我国自主知识产权的樱花新品种,逐渐将日本品种替换成我国自主栽培樱花品种[5]。
日本人Kawasaki 将日本樱花分为7 个群,得到了国际社会的一致认可,但对于杂交或来源不明的品种分类和鉴定有一定的局限性[6~7]。国内南京林业大学王贤荣团队提出了樱花品种分类的五级标准,但该标准易受生长环境、栽培管理、砧木选择等因素的影响,其应用也受到一定的影响[8]。因此,单纯依靠形态分类很难将所有品种正确分类,需要借助分子手段加以辅助鉴定。目前,DNA 条形码广泛应用于动植物的分类鉴定研究[9~17],并取得了很好的结果,其中核DNA 序列ITS 和叶绿体DNA 序列rbcL、matK 以及psbA-trnH应用比较多,但rbcL 和matK 为叶绿体功能基因,序列变异较小,因此主要应用于属及以上水平的分类鉴定研究,而ITS 和psbA-trnH 主要由非功能基因构成,序列变异相对较大,因此可应用于种及种以水平的分类鉴定研究[18-19]。本研究利用ITS和psbA-trnH 对国内引进的樱花品种进行测序分析,探究彼此间的分子差异,构建系统发育树,旨在为日本樱花的分类和种系定位以及纠正形态学分类的不足甚至错误提供分子依据。
1 材料与方法
1.1 材料
2016~2017年从宁波、武汉和上海等地采集了88个樱花品种样品,采集不同品种樱花的健康、无病害的幼叶,硅胶处理,4℃保存,详细样品信息见表1。

表1 样品信息Table 1 Samples information and source of the 88 cherry blossoms

续表1Continued table 1

续表1Continued table 1
1.2 方法
利用试剂盒(上海莱枫生物科技有限公司)进行88个样品的总DNA提取,提取的DNA稀释后放入冰箱-20℃保存、备用。
选用核基因ITS和叶绿体基因trnH-psbA 进行DNA条形码分析,2个DNA片段引物序列详见表2。PCR 反应体系为50µL,其中含预混合液25µL,模板DNA 1µL,引物对4µL,最后补加ddH2O 20µL。PCR扩增程序:95℃预变性5 min;95℃变性30 s,55或58℃退火30 s(ITS 为58℃;trnH-psbA 为55℃),72℃延伸1 min,45个循环;最后72℃延伸7 min。扩增完成后直接取5µL PCR产物进行点样,进行琼脂糖凝胶电泳(1.5%),验证扩增结果,之后将有目标条带的PCR扩增产物送到测序公司进行测序。
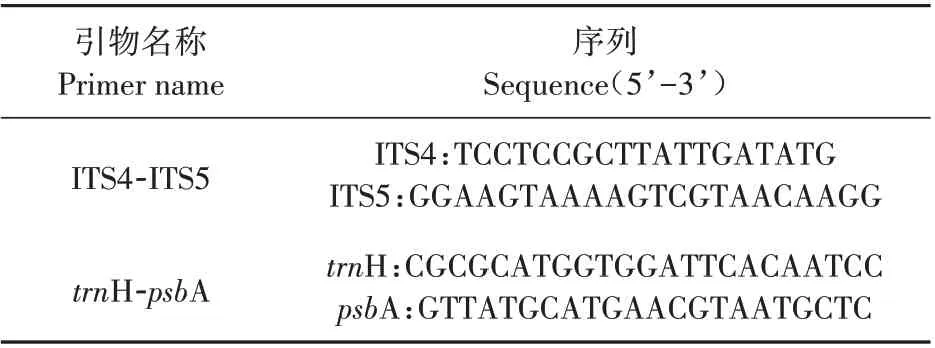
表2 DNA条形码引物名称及其序列Table 2 Primer names and sequences of DNA barcoding
1.3 数据分析
在NCBI 中搜索有关樱属植物的ITS 和trnHpsbA 的全长,以此作为标准序列,再将测序得到的序列运用DNAman 软件与标准序列进行比对,以确认测序的准确性,然后对合格的序列进行修剪,获得完整的片段序列。利用MEGA 6.0 软件计算出88 份材料的ITS 和trnH-psbA 各基因序列的组成、G+C 含量(%)等,此外还计算了各序列中的碱基的变异位点率和信息位点率以及转换/颠换比率等,并通过2 000 次重复的bootstrap 值来确定每个分支的支持率,构建邻接树(NJ),选择K2-P 模型遗传距离。
2 结果与分析
2.1 88 个樱花品种ITS 和trnH-psbA 序列特点分析
由表3可知,ITS序列长度在605~606 bp,变异很小,其中仅有寒绯樱、才力樱、大渔樱、横滨绯樱和阳光樱的ITS 序列长度为605 bp,其余品种ITS序列长度皆为606 bp。trnH-psbA序列长度在288~306 bp,其中内里樱trnH-psbA 序列长度为289 bp,江户彼岸樱、染井吉野樱、小松乙女樱、神代曙樱、澳博拉大叶早樱、咲耶姬樱、御帝吉野樱、阳春樱、白花真樱、赤实大岛樱、寒绯樱和鹎樱trnH-psbA序列长度为296 bp,阳光樱trnH-psbA 序列长度为306 bp,其余品种trnH-psbA序列长度均为288 bp。
由表3 还可知,ITS 的G+C 平均百分含量较高(59.6.%),而trnH-psbA 的G+C 平均百分含量却较低(21.8%);ITS 和trnH-psbA 的保守位点百分含量相差不大(分别为94.6%和94.5%),而变异位点百分含量相差较大,其中ITS 为5.3%(简约信息位点为3.3%,单突变位点为2.0%),而trnH-psbA 仅为2.0%(简约信息位点为0.7%,单突变位点为1.3%),ITS 的简约信息位点百分含量显著高于trnH-psbA;ITS插入/缺失序列最少,仅为1个碱基,而trnH-psbA 高达19 个碱基;此外,ITS 转换/颠换比率为0.7,而trnH-psbA却为0。
2.2 88个樱花品种变异位点分析
88 个樱花品种通过ITS 序列比对得到32 个变异位点,其中简约信息位点有20个,单突变位点有12 个。通过trnH-psbA 序列比对得到6 个变异位点,其中简约信息位点有2 个,单突变位点有4个。由表4 可知,ITS 变异位点中有18 个是颠换,有14个是转换,颠换要高于转换,其中颠换中A 突变成C、C 突变为A 和G 突变成T 出现频率相对较高,转换中G 突变成T 出现频率较高。trnH-psbA 的6 个变异位点都是颠换,无转换。由此说明88 个樱花品种的ITS 的变异程度明显高于trnH-psbA,ITS 的分辨率要明显高于trnH-psbA,ITS可作为樱花品种系统发育研究、品种鉴定等的核心条形码,而trnH-psbA可作为辅助序列予以应用。
2.3 88 个樱花品种ITS 和trnH-psbA 插入/缺失序列分析
本研究共得到ITS 的排列位点607 个,在排列位点437 处,寒绯樱含有1 个单碱基(G)的插入。trnH-psbA 有307 个排列位点,在41~58 排列位点处,阳光含有18 个碱基(CTTGTAAGTTTATCATTA)的插入;在51~58 排列位点处,澳博拉大叶早樱、白花真樱、赤实大岛樱、寒绯樱、江户彼岸樱、染井吉野樱、神代曙樱、小松乙女樱、咲耶姬樱、鹎樱、阳春樱和御帝吉野樱含有8 个碱基(TATCATTA)的插入,此外,在202 排列位点处,内里樱含有1个单碱基(A)的插入。

表3 序列碱基组成及变异率Table 3 Sequence base composition and mutation rate

表4 变异位点分析Table 4 Analysis of variable
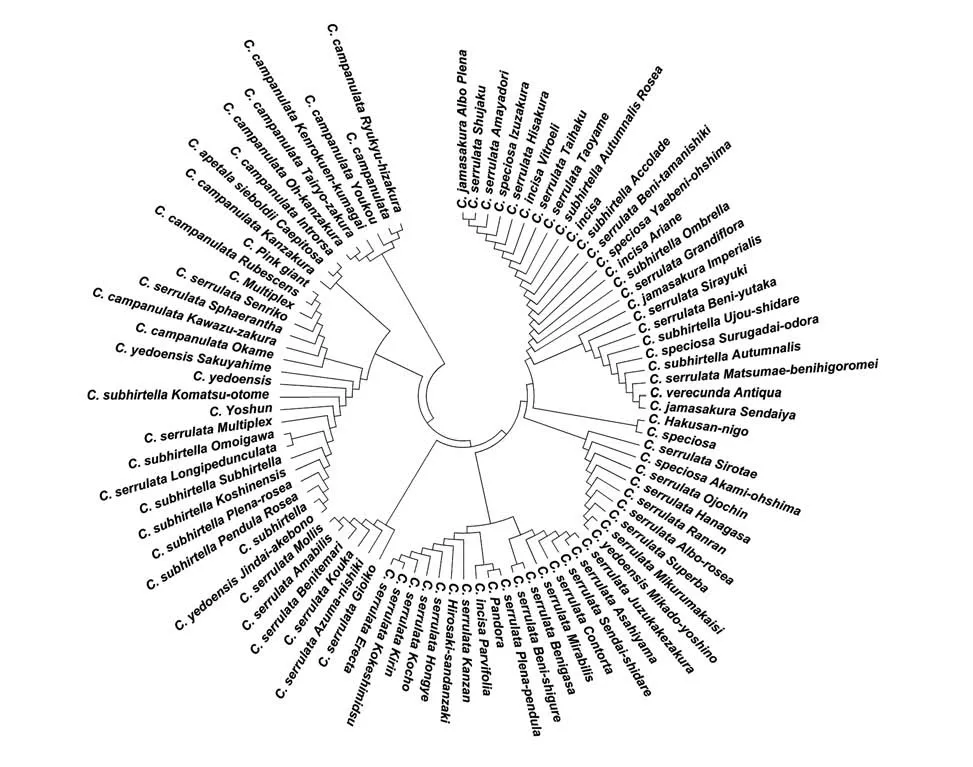
图1 基于ITS+trnH-psbA组合序列构建88个樱花品种的NJ树Fig. 1 The NJ tree of the 88 cherry blossoms with the concatenated ITS+trnH-psbA sequencesT
2.4 88个樱花品种的系统发育分析
利用分析软件MEGA 6.0 构建了88 个樱花品种的系统发育树(见图1),由图1 可知,88 个樱花品种可分为4 大类(Ⅰ、Ⅱ、Ⅲ和Ⅳ),其中第Ⅰ类有Ⅰa、Ⅰb 和Ⅰc 三小类,Ⅰa 包含市原虎尾樱、朱雀樱、雨宿樱、伊豆樱、一叶樱、维多利富士樱、太白樱、手弱女樱、十月红樱、三岛富士樱、嘉奖樱、红玉锦樱、八重红大岛樱、阿丽亚娜富士樱、澳博拉大叶早樱、郁金樱、内里樱、白雪樱、红丰樱、雨晴枝垂樱、骏河台香樱、十月樱、松前红绯衣樱、奈良八重樱和仙台屋樱,Ⅰb 包含白山2 号樱和大岛樱,Ⅰc 包含白妙樱、赤实大岛樱、大提灯樱、花笠樱、兰兰樱、普贤象樱、松月樱、御车返樱和御帝吉野樱;第Ⅱ类有Ⅱa 和Ⅱb 两小类,Ⅱa 含有梅护寺数珠挂樱、旭山、朝日山樱、山樱枝垂樱、福禄寿樱、大村樱、红笠樱和红时雨樱,Ⅱb 含有菊垂樱、潘多拉樱、冬樱、关山樱、弘前三段咲樱、红叶樱、蝴蝶樱、麒麟樱、苔清水樱和天川樱;第Ⅲ类有御衣黄樱、东锦樱、红华樱、红手毬樱、日暮樱和杨贵妃樱;第Ⅳ类有Ⅳa、Ⅳb、Ⅳc 和Ⅳd 4 小类,Ⅳa 含有江户彼岸樱、神代曙樱、红枝垂樱、八重红枝垂樱、越之彼岸樱、小彼岸樱、鹎樱、思川樱、白花真樱、阳春樱、小松乙女樱、染井吉野樱和咲耶姬樱,Ⅳb 含有才力樱、河津樱、兼六园菊樱、千里香樱、青肌樱、修缮寺寒樱和粉巨人樱,Ⅳc含有寒樱、高妙樱和初美人樱,Ⅳd含有大寒樱、大渔樱、横滨绯樱、阳光樱、寒绯樱和琉球寒绯樱。
3 讨论
对于确定的植物品种,一般均采用扦插[20~21]、嫁接[22~23]或组培[24~25]等无性繁殖进行扩大再生产,才能保持特定品种的稳定性状,其遗传物质完全不会改变(排除基因突变),因此,可以通过比较不同樱花品种的基因差异用于品种鉴定。本研究中仅有寒绯樱群里的寒绯樱、才力樱、大渔樱、横滨绯樱和阳光樱等5个品种的ITS序列长度为605 bp,其余83 个品种的ITS 序列长度均为606 bp,此外,trnH-psbA 序列为基因间隔区域,进化选择压力较小,其长度变异较大,往往有大量插入/缺失片段,根据结果可知,阳光樱的trnH-psbA 序列长度为306 bp,内里樱trnH-psbA 序列长度为289 bp,江户彼岸群的江户彼岸樱、染井吉野樱、小松乙女樱、神代曙樱、澳博拉大叶早樱、咲耶姬樱、御帝吉野樱、阳春樱和山樱群的白花真樱、赤实大岛樱、鹎樱以及寒绯樱群的寒绯樱的trnH-psbA 序列长度为289 bp。因此,可依据DNA 片段长度多态性对部分品种进行分子鉴定。
核基因ITS 包含ITS1、5.8S 和ITS2,其中ITS1和ITS2 为非编码区,而基因非编码区所承受的选择压力较小,因此,ITS 突变位点(简约信息位点和单突变位点)多位于ITS1 和ITS2[26]。叶绿体DNA呈单亲遗传(母系遗传),不存在像核基因那样的基因重组,编码基因往往非常保守,但像trnH-psbA等基因间隔序列变异较大,但变异率往往要远低于核基因[27]。本研究ITS 变异位点百分率(5.3%)远高于trnH-psbA(2.0%),因此ITS 在樱属植物种或种下水平的鉴定率显著高于trnH-psbA,ITS可作为核心条形码序列用于系统发育研究,trnH-psbA可作为辅助序列予以应用。此外,插入/缺失现象在叶绿体基因非编码区较常出现,如阳光樱有18个碱基(CTTGTAAGTTTATCATTA)的插入,江户彼岸群的大多数品种都有8 个碱基(TATCATTA)的插入,根据这些特定序列长度也可用于品种的分子鉴定。
本研究88 个品种均引自于日本,而日本的樱花品种其原始亲本均来自9 个野生种[山樱(Cerasus serrulata)、大山樱(Cerasus sargentii)、霞樱(Cerasus verecunda)、江户彼岸(Cerasus subhirtella)、豆樱(Cerasus incisa)、大岛樱(Cerasus speciosa)、高岭樱(Cerasus nipponica)、深山樱(Cerasus maximowiczii)和丁字樱(Cerasus apetala)]以及2 个栽培种[寒绯樱(Cerasus campanulata)和樱桃(Cerasus pseudocerasus)],尤其是日本晚樱大多是反复杂交所得,其遗传背景比较复杂,很多日本晚樱品种亲本不详[7]。日本人Kawasaki 在本田正次和林弥荣[28]分类标准基础之上,按种系将日本樱花品种分为7 个群,即山樱群、江户彼岸群、寒绯樱群、豆樱群、丁字樱群、樱桃群、深山樱群。本研究有54个品种属于山樱群,有18个品种属于江户彼岸群,有12 个品种属于寒绯樱群,有4 个属于豆樱群,依据ITS+trnH-psbA构建的系统发育树的结果,Ⅰ、Ⅱ和Ⅲ主要是山樱群的樱花品种,Ⅳ主要是江户彼岸群和寒绯樱群的樱花品种,而豆樱群的品种不构成单系,与山樱群混合在一起。因此,利用ITS+trnH-psbA可以较好地将不同品种的樱花品种合理归类,作为形态分类的辅助手段。
大岛樱为日本原生种,因其花最大,花量最多,且花朵带有香味,被广泛喜爱,培育出的园艺品种也最多(包括变异品种和杂交品种)[1],我国所说的日本晚樱其实指的就是具有大岛樱血统的樱花杂交品种,因此,日本晚樱中的杂交品种拉丁文本应为Cerasus speciosa,但国内习惯将日本晚樱花拉丁文描述为Cerasus serrulata,因此本文对日本晚樱中的杂交品种采用了后一种描述。山樱群的樱花品种比较复杂,其绝大多数品种原始亲本是大岛樱、山樱、大山樱和霞樱,然后通过彼此间反复杂交形成了今天诸多的山樱群樱花品种,从系统发育树可知,它们彼此间的系统发育关系比较混乱,无规律可循。在第Ⅰ类的Ⅰa 中包含3 个豆樱(变异)品种,说明ITS+trnH-psbA 组合序列对豆樱、山樱(红山樱)和大岛樱的分辨率较低,而冬樱为杂交品种,其系统发育关系与豆樱变异品种相差较大。江户彼岸群大部分品种能够单独构成一系,但其中有部分杂交品种混入到山樱群,如十月红樱、嘉奖樱、澳博拉大叶早樱、雨晴枝垂樱、十月樱、御帝吉野樱和潘多拉樱,因此,这些杂交品种遗传物质更多受到山樱、大山樱、大岛樱、霞樱和豆樱的影响,这7个江户彼岸群杂交品种分类地位有待进一步确认,此外,江户彼岸群还混有白花真樱和鹎樱,这2 个品种可能具有江户彼岸樱的血统。寒绯樱群的12 个品种全部单独构成一系,但其中混有青肌樱、千里香、兼六园菊樱和高砂樱,其中青肌樱为我国原生种(山樱),与寒绯樱关系较近,其余兼六园菊樱和高砂樱均是花色淡红的重瓣樱花,推测均具有寒绯樱血统,而千里香花色洁白又与青肌樱较近,且香气浓郁,推测其是大岛樱或其品种与寒绯樱品种的杂交品种。本研究中系统不确定的白山2号与大岛樱关系最近,可将其归类为大岛樱影响的日本晚樱,其拉丁名可更改为Cerasus serrulata‘Hakusan-nigo’,弘前三段咲樱拉丁名可更改为Cerasus serrulata‘Hirosaki-sandanzaki’,阳春樱拉丁名可更改为Cerasus subhirtella‘Yoshun’,粉巨人樱拉丁名可更改为Cerasus campanulata‘Pin giant’,而潘多拉樱与山樱群混在一起,因此建议将其拉丁名更改为Cerasus serrulata‘Pandora’。白雪樱一般认为是江户彼岸樱反复杂交所得,这与本团队前期利用ISSR 分子标记法所得结果一致,但本研究结果与前期研究结果有所出入,表明利用ITS 和trnH-psbA 两个条形码序列不能将白雪正确分类,做出了错误的结论,也可能是白雪樱遗传背景比较复杂,也表明DNA 条形码用于物种系统发育有其不足和缺陷。
ITS 和trnH-psbA 可用于种以及以上水平的系统发育研究,可以取得较好结果,但对于种下水平结果往往不理想[29]。本研究结果表明,山樱群中的各系樱花品种彼此混乱的聚合在一起,尤其是各类的日本晚樱,除了山樱群大部分品种遗传背景比较复杂以外,还可能是因为山樱群的各系品种其原始亲本系统发育关系本就很近造成的,这也是杂交育种的基础,因此,我们推测日本的山樱、大山樱、大岛樱、霞樱、豆樱等原种为近期分化出的物种,系统发育关系较近,并未完全出现生殖隔离。但很多江户彼岸群和寒绯樱群的樱花品种很多也是与山樱、大山樱、大岛樱、霞樱、豆樱等杂交所得,但能够与山樱群品种彼此分离,由此可知,江户彼岸樱和寒绯樱与山樱、大山樱、大岛樱、霞樱、豆樱系统发育关系相对较远,但日本樱属植物原种彼此间都能够杂交形成可育后代,严格来说都可并为一个种,但形态分类专家依据其形态差异分为了不同种,樱属植物是个比较年轻的属,属间物种大多可以彼此杂交,根据种的定义,严格而言都是亚种。
4 结论
本研究利用ITS和trnH-psbA对88个樱花品种进行了系统发育关系研究,结果表明,山樱群樱花品种系统发育比较混乱,这与其遗传背景比较复杂以及原始亲本系统发育关系较近有关,江户彼岸群和寒绯樱群的大多数樱花品种能够聚类在一起,与山樱群品种能分得开,但涉及到很多杂交品种,ITS 和trnH-psbA 难以区分,表明DNA 条形码技术难以应用到杂交品种的系统发育关系,因此,对于樱花的杂交品种可采用SSR、ISSR 等分子标记技术,探讨彼此间亲缘关系。本研究结果可作为樱花品种分类、嫁接繁殖、系统发育等研究的参考依据。

