杂交构树UDP-葡萄糖脱氢酶基因编码蛋白的亚细胞定位及其启动子5'端缺失片段的功能分析
吉仁花 张文波 林晓飞 包颖亮 特日格勒 包会嘎 白淑兰*
(1. 内蒙古农业大学林学院,呼和浩特 010019;2. 内蒙古大学生命科学学院,呼和浩特 010021;3. 乌海市湿地管理局,乌海 016000)
基因表达调控受多种内外因子的影响,生物能够根据自身需要及复杂多变的外界环境的改变作出反应、调控特定的基因表达,以适应其生长环境,同时也是生物体内的细胞分化、形态发生及个体发育的分子基础[1]。基因表达在基因水平、转录水平、翻译水平、蛋白质加工水平等多个层次上进行调控,其中转录调控是表达调控的重要环节,受多种顺式作用元件及转录因子的协调作用。顺式作用元件是转录因子的结合位点,通过与转录因子结合调控基因转录的精确起始和转录效率[2]。植物基因启动子是重要的顺式作用元件,通常位于结构基因5'端上游,可能通过与一些调节蛋白直接或者间接作用来控制着RNA 聚合酶的活性,激发转录因子与下游基因的启动子核心序列相结合,进而特异性地转录出一定量的mRNA,以参与调控下游相应基因表达[3],是调控基因表达的“开关”[4]。启动子的应用不仅可以在植物的特定部位或者某个发育阶段生产目的蛋白或其他代谢产物,以实现对外源基因的表达调控,还可为新基因的功能研究以及阐明植物生长发育的调控机理等方面提供全新的思路[5]。目前,人们在转基因育种研究中,利用启动子实现对目标基因在某一时间或者目标组织中的高效表达,从而尝试着达到培育高效、抗逆、安全的转基因植物的目的[6~10]。因此,对于抗逆相关基因的启动子克隆和确定其顺式作用元件的核心序列、顺式作用元件之间的相互作用以及这些顺式作用元件相互作用的转录因子的研究是启动子研究的重点[3]。
近期,中国科学院植物研究所利用野生构树(Broussonetia papyifera)为父本、小构树(Broussonetia kazinoki)为母本,通过现代生物技术结合传统杂交育种方法培育出具有突出抗逆性的速生和丰产树种——杂交构树(Broussonetia kazinoki×Broussonetia papyifera)[11]。杂交构树是多年生木本植物,有13 对染色体(2n=26),其基因组紧凑,遗传背景简单且表型性状丰富[12]。具有生长快、分布广、适应性强、易繁殖、抗污染能力强及耐烟尘污染等特点。是一种多功能综合性树种,广泛应用于造纸、饲料、医药等行业[13]并在扶贫产业、环境保护、生态修复上发挥着重要作用[14]。
在高等植物中,多糖代谢在调控其纤维素、半纤维素、果胶和胼胝质等细胞壁物质的形成、营养器官的生长及生殖器官的发育过程发挥重要作用。尿苷二磷酸葡萄糖脱氢酶(UDP-glucose dehydrogenas,UGDH)普遍存在于生物体内,是半纤维素和果胶生物合成途径中的关键酶,它催化UDPGlc 生成多糖合成过程中的关键前体物质——UDP-GlcA,是一种以NAD+或NADP+为受体、作用于供体CH-OH 基团上的氧化还原酶,参与多种糖代谢过程,进而调控植物生长发育[15]。UGDH 基因在不同物种中显示比较保守,其核苷酸序列在植物中具有较高的同源性,但在原核生物中其核苷酸序列的同源性则较低。植物的UGDH 中均含有NAD 辅酶结合位点和催化位点两个功能结构域,例如:杂交杨(P.tremula×P.remuloides)[16]、大豆(Glycine max)[17]、苎麻(Boehmeria nivea)[18]、兴安落叶松(Larix gmelinii)[19]、桉树(Eucalyptus grandis)[20]UGDH 中与NAD 的结合有关的NAD 辅酶结合位点均位于8-14氨基酸、267-278氨基酸处。通常,UGDH 基因以不同的拷贝形式存在于植物中。在桉树[20]、兴安落叶松[19]和玉米(Zea mays)[21]的基因组中,均以双拷贝形式存在;在人类基因组中以单拷贝的形式存在[22];在拟南芥基因组中存在5个拷贝,包含4 个功能型基因和一个假基因[23]。UGDH 在植物体内的多糖代谢和半纤维生物合成途径中发挥着重要的作用。Klinghammer 和Tenhaken[23]研究结果显示,AtUGDH 基因在转基因植物中的过量表达增加了细胞壁的多糖含量,并呈现出特定的表型。兴安落叶松LgUGDH 基因在拟南芥中的过量表达,增强了转基因植物的营养生长,促进了半纤维素的生物合成并提高了转基因植物的抗寒性[19]。使用突变方法对玉米的ZmUGDH 基因进行功能分析显示,在ZmUGDH 突变株中,细胞壁形成所需的基质多糖含量显著降低[21]。这些结果表明UGDH 在调节植物的生长和发育中起关键作用。因此,分析杂交构树UGDH 基因启动子各个顺式调控元件在转基因植物中的表达活性,进而明确各顺式作用元件的功能及相互之间的关系是十分重要的。研究利用筛选的调控元件调节UGDH 基因在多糖合成过程中特异表达,从而调控转基因植物的生长发育。另外,一个基因的功能及其所参与的代谢途径,很大程度上和该基因编码的蛋白在细胞器中的所处位置有关。为了探索BpUGDH 基因调控植物生长发育的分子机制,对BpUGDH 基因编码的蛋白质进行亚细胞定位,进一步深入分析该基因的功能及其所参与的代谢途径奠定了分子生物学基础。
1 材料与方法
1.1 植物材料
杂交构树(B.kazinoki×B.papyifera)插条由内蒙古包头市绿禾农牧林业有限公司提供,将插条剪成长度为35 cm,扦插在土壤和蛭石体积比1∶1 混和基质的花盆中,4周后从植物幼嫩叶片中提取基因组DNA。
将本氏烟草(Nicotiana benthamiana)种子用75%的酒精消毒4min 后短暂离心,倒出酒精,再加入无水酒精,用移液枪吹打,撒到无菌的滤纸上,待无水酒精完全挥发后,将种子均匀的播种到1/2MS 固体培养基中,置于4℃培养箱春化3 d 后,移至22±2℃,16 h光照/8 h黑暗光周期和45 mol·m-2·s-1的光照强度下培养;待烟草发芽长出2 片真叶时,移到已灭菌的土壤蛭石体积比1∶1 的营养土中,覆膜保湿5 d,撤膜后培养室条件下培养。
1.2 研究方法
1.2.1 BpUGDH 基因启动子5'端缺失片段的功能分析
BpUGDH 基因启动子5'端缺失片段的克隆:将前期研究中利用Genome Walking kit(Takara),染色体步移(Genome Walking)技术克隆获得的BpUGDH 基因启动子1304bp 序列。根据Plant-CARE[24](http://bioinformatics.psb.ugent. be/webtools/ plant care/html/)在线软件对所获得的BpUGDH 基因上游启动子序列进行顺式作用元件的预测结果(详见附图1),使Pro.BpUGDH 从转录起始位点上游1 304 bp的5'端逐一形成5个缺失片段,分别记为PB2-ETH(缺失-1 304 至-973)、PB3-Me-JA(缺失-1 304 至-465)、PB4-低温(缺失-1304 至-355)、PB5-IAA(缺失-1 304 至-281)和PB6-GA(缺失-1 304至-244)。
根据BpUGDH 基因启动子5'端逐一形成的5个缺失片段序列设计5 条包含pORE R1 载体多克隆位点两侧序列的重组引物和反向引物BpUGDH-Xbal-R(如表1 所示),以质粒pMD19-T-Pro.BpUGDH 为模板,并利用Trans Start®FastPfu DNA Polymerase kit(TransGen Biotech)分 别 扩 增Pro.BpUGDH 5'端逐一形成的5 个缺失片段序列。PCR 反 应 体 系 含 有10 µL 5×TransStart®FastPfu Buffer,4 µL 2.5 mmol·L-1dNTP,2.5 U Trans-Start®FastPfu DNA Polymerase,1µL 的10µmol·L-1的重组引物PB2-ETH(-973)-F2、PB3-MeJA(-465)-F3、PB4-低温(-355)-F4、PB5-IAA(-281)-F5、PB6-GA(-244)-F6 和BpUGDH-Xbal-R 以及2 µL 质粒pMD19-T-Pro. BpUGDH。PCR 扩增条件为:95℃3 min;95℃20 s,68℃20 s,72℃1 min,35 个循环;72℃10 min 作为最终延伸。1%的琼脂糖电泳检测、回收目的条带。

表1 BpUGDH启动子缺失片段的引物Table 1 Primers for the deletion of the BpUGDH promoter
BpUGDH 基因启动子5'端缺失片段和pORE R1 载体的连接:利用pEASY®-Uni Seamless Cloning and Assembly Kit 同源重组XbaI 酶切之后的线性化pORE R1 载体和BpUGDH 基因启动子5'端缺失片段。反应体系含有5 µL 2×Assembly Mix,0.04 pmol(浓度为193 ng·µL-1,1.32 µL)线性化载体和0.08 pmol(GA:22.9 ng·µL-1,0.6 µL;ETH:100 ng·µL-1,0.52 µL;MeJA:52.6 ng·µL-1,0.98µL;IAA:29 ng·µL-1,0.54 µL;4℃:35.3 ng·µL-1,0.55 µL)BpUGDH 基因启动子5'端缺失片段,在50℃孵育15 min。反应结束后,迅速拿出链接产物,冰上放置数秒后全部转化50 µL 大肠杆菌Trans1-T1 感受态细胞,涂布kan 抗性平板,37℃过夜培养。
pORE R1-Pro.PB2/PB3/PB4/PB5/PB6::GUS重组质粒的鉴定:分别挑取单菌落利用pORE R1载体的通用引物pORE-F:5'-ACTGAAGGCGGGAAACGACAAT-3', pORE-R: 5'-TTTCACGGGTTGGGGTTTCTAC-3'进行菌落PCR检测的同时利用XhoI、SacI酶切鉴定,选取PCR 及双酶切鉴定均为阳性的菌落送至生工生物工程(上海)股份有限公司进行测序。
从测序显示正确的阳性重组菌中提取质粒,通过冻融法将pORE R1-Pro.PB2/PB3/PB4/PB5/PB6::GUS转化到GV3101农杆菌感受态细胞。
Pro.BpUGDH::GUS 和各个缺失片段的烟草的瞬时转化:将转入农杆菌GV3101的质粒菌种置于10 mL含有50 mg·L-1Kan和100 mg·L-1Rif的LB液体培养基中,在28℃200 r·min-1培养16 h 左右,使菌液OD600达到1.0~1.5 时3 600 r·min-1离心10 min,弃上清液。用10 mmol·L-1MES,10 mmol·L-1MgCl2,200 µmol·L-1As(pH 约为5.6)侵染液,重新悬浮菌液,并调节其OD600≈0.6。选择7 周龄、长势良好、舒展的、从最新叶算起选取第4 片叶,使用1 mL 注射器,避开叶脉从叶背面缓慢注入烟草下表皮,在22±2℃,16 h 光照/8 h 黑暗光周期和45 mol·m-2·s-1的光照强度下继续生长4 d。
烟草叶片的GUS 染色及其β-GUS 含量的检测:避开烟草叶片的注射针孔区域,用打孔器取直径约0.5 cm 的叶圆片,置于GUS染色液中,在37℃下避光处理过夜;用无水乙醇脱色2~3 次以除去绿色,并在Nikon SMZ1000 显微镜下观察Pro.BpUGDH::GUS 和各个缺失片段的表达并拍照。同时采用植物β-葡萄糖苷酸酶(GUS)酶联免疫分析(ELISA)试剂盒(苏州科铭生物技术有限公司)测定烟草叶片中β-GUS 的含量,具体操作方法见说明书。
1.2.2 杂交构树UGDH基因亚细胞定位分析
亚细胞定位预测:利用在线软件TargetP 1.1[25](http://www.cbs.dtu.dk/services/TargetP/)和Cell-PLoc 2.0[26](http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行BpUGDH亚细胞定位预测。
BpUGDH 基因ORF 的扩增:将前期研究中克隆已获得的BpUGDH 基因的ORF末端分别设计两条特异性引物,并在其5'末端添加KpnI 酶切位点(BpUGDH-1300-F:5'-CGGGGTACCATGGTGAAGATCTGTTGCATT-3')和3'末端添加XbaI 酶切位点(BpUGDH-1300-R:5'-TAGTCTAGATGCCACAGCAGGCATGTCC-3',去除终止密码子),扩增目的基因的ORF 区域。PCR 反应体系为:分别0.5 µL的10 µmol·L-1的BpUGDH-1300-F/R、1 µL pMD-19T-BpUGDH 质粒、12.5µ L PrimeSTAR®Max DNA Polymerase(Takara),反应体系为:98℃3 min;98℃10 s,55℃5 s,72℃5 s,35 个循环;72℃5 min 作为最终延伸。
pCAMBIA1300-35S-BpUGDH-GFP 载体的构建:利用DNA Ligation Kit<Mighty Mix>(Takara),7.0µL的BpUGDH 双酶切胶回收产物、3.5µL的载体双酶切胶回收产物和10.5µL的Ligation Mix,轻轻混匀后16℃连接8 h。待反应结束后,取10 µL连接产物转化大肠杆菌Trans1-T1 感受态细胞,涂布于kan抗性板上37℃培养过夜。
pCAMBIA1300-35S-BpUGDH-GFP 重组载体的鉴定:分别挑取单菌落利用pCAMBIA1300-35SGFP载体引物1300-GFP-F:5'-ATGGTGAAGATCTGTTGCATT-3' 和 1300-GFP-R:5'-TGCCACAGCAGGCATGTCC-3'进行菌落PCR检测的同时利用KpnI 和XbaI 酶切鉴定,选取PCR 及双酶切鉴定均为阳性的菌落送至生工生物工程(上海)股份有限公司进行测序。
烟草叶片的瞬时转化:提取测序鉴定正确的pCAMBIA1300-35S-BpUGDH-GFP 重组表达载体质粒,通过冻融法转化农杆菌GV3101 感受态细胞,利用注射法进行烟草的瞬时转化,在22±2℃,16 h 光照/8 h 黑暗光周期和45 mol·m-2·s-1的光照强度下继续生长4 d 后使用德国蔡司(ZEISS)LSM 71003040702 激光共聚焦显微镜进行荧光检测、拍照。
2 结果与分析
2.1 克隆BpUGDH基因启动子5'端缺失片段
利用正向引物PB2-ETH(-973)-F2、PB3-MeJA(-465)-F3、PB4-低温(-355)-F4、PB5-IAA(-281)-F5、PB6-GA(-244)-F6 和反向引物BpUGDH-XbaIR,以重组质粒pMD19-T-Pro.BpUGDH 为模板进行PCR 扩增,获得5 条大小不同的Pro.BpUGDH 的5'端缺失片段,经测序验证其大小分别为1 035、527、417、343和306 bp(见图1)。
2.2 pORE R1-Pro. PB2/PB3/PB4/PB5/PB6::GUS表达载体的鉴定
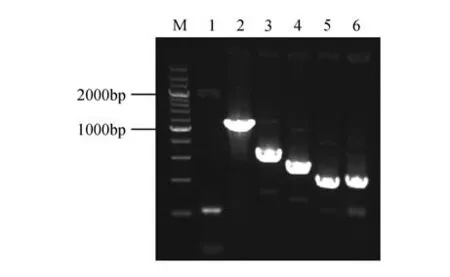
图1 Pro.BpUGDH的5'端缺失片段的克隆M. 200 bp DNA Ladder;1. 克隆获得的Pro. BpUGDH 片段;2~6.Pro.BpUGDH缺失片段Fig.1 Cloning of the deletion fragment of Pro.BpUGDHM. 200 bp DNA Ladder;1. Fragment of Pro. BpUGDH;2-6. Deletion fragment of Pro.BpUGDH
利用2×Assembly Mix 同源重组XbaI酶切之后的线性化pORE R1载体和各个BpUGDH 基因启动子5'端缺失片段,构建重组载体pORE R1-PB2/PB3/PB4/PB5/PB6::GUS。对五个重组质粒进行菌落PCR 验证(如图2A),同时用XhoI、SacI 酶双酶切重组质粒,分别得到1 035、527、417、343 和306 bp 的片段和pORE R1 载体片段(如图2B),结果表明,Pro.BpUGDH 5'端缺失片段的表达载体已成功构建。
2.3 Pro.BpUGDH 5'端缺失片段表达活性分析
为了研究Pro.BpUGDH 的各个缺失片段的表达活性,将含有5 个5'端缺失片段重组质粒的农杆菌注射烟草叶片瞬时表达。对烟草叶片GUS染色结果显示:与Pro.BpUGDH(PB1)的染色结果相比,缺失-1 304~-281(PB5-IAA)和缺失-1 304~-244(PB6-GA)之间的区域,烟草叶圆片的染色略微变浅;缺失-1 304~-973(PB2-ETH)、缺失-1 304~-465(PB3-MeJA)和缺失-1 304~-355(PB4-低温)之间的区域,烟草叶圆片的染色逐渐变浅,其中缺失-1 304~-355(PB4-低温)区域的染色最浅(如图3A)。烟草叶片GUS 染色的同时对其进行GUS 活性检测,结果显示:与Pro.BpUGDH(PB1)的GUS活性检测结果相比,缺失片段PB5-IAA 和PB6-GA 的GUS活性无显著差异;而缺失片段PB3-MeJA、PB2-ETH 和PB4-低温的GUS 活性显著下降,其中PB4-低温的GUS 活性最低(如图3B),与GUS 染色结果基本一致。
Pro.BpUGDH 5'端缺失片段在烟草叶片GUS活性趋势为:先显著下降(PB2-ETH、PB3-MeJA、PB4-低温),最后PB5-IAA、PB6-GA 缺失区域均显著上升。这些现象表明,在BpUGDH 基因启动子-1 304~-244 区域不存在负调控元件,此区域间的ETH、MeJA、低温、GA、IAA 等顺式作用元件对调控Pro.BpUGDH 的活性可能发挥着至关重要的作用。

图2 pORE R1-PB2/PB3/PB4/PB5/PB6::GUS重组载体鉴定A. pORE R1-PB2/PB3/PB4/PB5/PB6::GUS 重组载体菌落PCR 鉴定(M. 200 bp DNA Ladder;2~6:Pro. BpUGDH 缺失片段PB2-PB6;B.pORE R1-PB2/PB3/PB4/PB5/PB6::GUS重组载体双酶切鉴定(M.200 bp DNA Ladder,1、3、5、7、9.pORE R1-PB2/PB3/PB4/PB5/PB6::GUS重组质粒,2、4、6、8、10.pORE R1-PB2/PB3/PB4/PB5/PB6::GUS重组质粒的双酶切产物)Fig.2 pORE R1-PB2/PB3/PB4/PB5/PB6::GUS recombinant vector identificationA. Colony PCR identification of pORE R1-PB2/PB3/PB4/PB5/PB6::GUS recombinant vector(M. 200 bp DNA Ladder;2-6. Pro. BpUGDH deletion fragment PB2-PB6;B.Digestion identification of pORE R1-PB2/PB3/PB4/PB5/PB6::GUS recombinant vector(M.200 bp DNA Ladder;1,3,5,7,9.pORE R1-PB2/PB3/PB4/PB5/PB6::GUS recombination Plasmid;2,4,6,8,10.Digestion product of pORE R1-PB2/PB3/PB4/PB5/PB6::GUS recombinant plasmid)
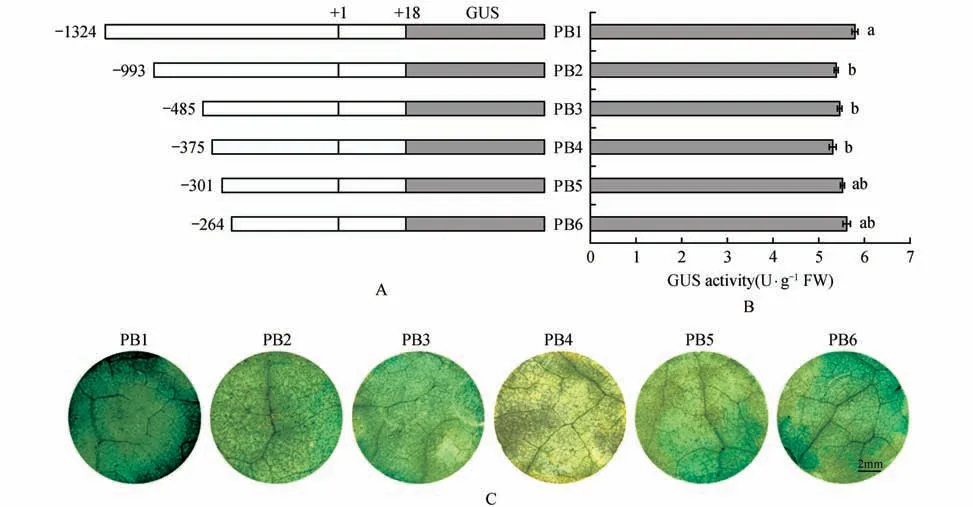
图3 Pro.BpUGDH 5'端缺失片段在烟草叶片中的GUS活性分析A.Pro.BpUGDH 5'端缺失片段;B.Pro.BpUGDH 5'端缺失片段在烟草叶片中的GUS活性测定;C.Pro.BpUGDH 5'端缺失片段在烟草叶圆片的GUS染色,其中PB1是Pro.BpUGDH 片段 误差线表示具有六种指标的三个独立生物重复的标准偏差(SD);不同的字母分别表示每组样本间的显著性差异(P<0.05)Fig.3 Analysis of GUS activity of the 5'-end deletion fragment of Pro.BpUGDH in tobacco leavesA. Pro. BpUGDH 5'-end deletion fragment;B. Pro. BpUGDH 5'-end deletion fragment GUS activity determination in tobacco leaves;C. GUS staining of the 5'-end deletion fragment of the Pro. BpUGDH in tobacco leaf discs,PB1 is a fragment of Pro. BpUGDH Error bars represent the standard deviation(SD)of three independent biological replicates.Different letters indicate significant differences at P<0.05
2.4 亚细胞定位分析
2.4.1 亚细胞定位预测
Target P 预测结果显示,BpUGDH 蛋白的线粒体靶向肽(mTP)的分值为0.077,其他部位前导肽(other)分值为0.390,叶绿体转运肽(cTP)分值为0.031,分泌通道信号肽(SP)分值为最高,因此推测BpUGDH 蛋白是分泌蛋白,定位于(S)分泌途径中。Cell-PLoc 2.0 对BpUGDH 蛋白亚细胞定位进行预测,显示其定位于叶绿体中。
一个基因的功能及其所参与的代谢途径,很大程度上和该基因编码的蛋白在细胞器中的所处位置有关。本研究为了证实其在细胞中的具体表达位置,利用DNA 重组技术构建BpUGDH 与GFP基因融合,构建35S::BpUGDH-GFP 表达载体,进一步进行烟草叶片的瞬时转化,观察了35S::BpUGDH-GFP在烟草叶片表皮细胞中的表达。
2.4.2 表达载体pCAMBIA1300-35S-BpUGDHGFP的鉴定
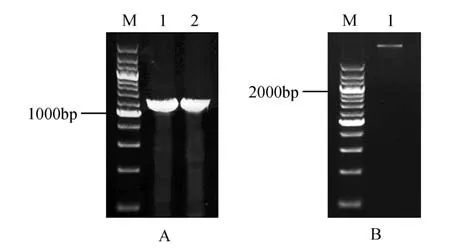
图4 pCAMBIA1300-35S-BpUGDH-GFP载体的构建A. 重组载体pCAMBIA1300-35S-BpUGDH-GFP 菌落PCR 鉴定;B. 重组载体pCAMBIA1300-35S-BpUGDH-GFP 双酶切鉴定(M.200 bp DNA Ladder)Fig.4 Construction of pCAMBIA1300-35S-BpUGDHGFP vectorA. Colony PCR identification of recombinant vector pCAMBIA1300-35S-BpUGDH-GFP;B. Digestion identification of recombinant vector pCAMBIA1300-35S-BpUGDH-GFP(M.200 bp DNA Ladder)
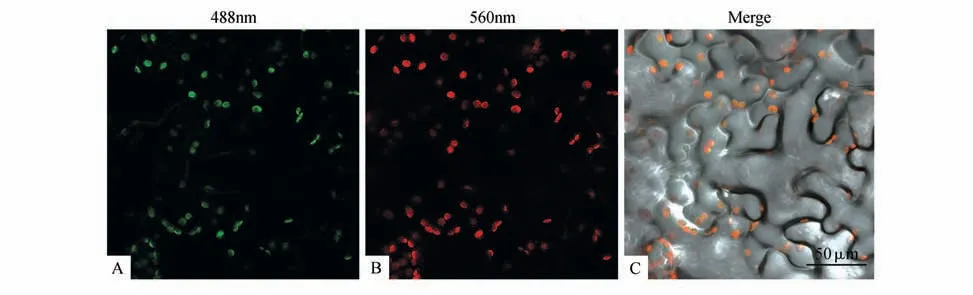
图5 BpUGDH-GFP融合蛋白的亚细胞定位A.GFP绿色荧光;B. 叶绿素自发荧光;C. 叠加后的结果Fig.5 Subcellular localization of BpUGDH-GFPA.GFP green fluorescence;B.ChloroPhyll autofluorescence;C.Overlapping
利用添加了酶切位点(kpnI 和XbaI)的特异性引物,PCR 扩增获得1 440 bp 的BpUGDH 的ORF序列。将PCR 扩增产物回收,连接pEASY®-Tl 载体、转化Transl-Tl,并对菌落PCR 进行鉴定正确的重组质粒pEASY®-Tl-BpUGDH 和载体pCAMBIA1300-35S-GFP 用限制性内切酶QuickCut kpnI和XbaI 进行双酶切、连接,使BpUGDH 处于35S 启动子及GFP 蛋白之间,构建pCAMBIA1300-35SBpUGDH-GFP 载体。对重组质粒进行菌落PCR 验证(见图4A),同时双酶切重组质粒,获得1 400 bp的目的片段和pCAMBIA1300-35S-GFP 载体片段(见图4B)。对于检测都显示正确的重组质粒送测序,证实了,BpUGDH 基因己正确的插入到pCAMBIA1300-35S-GFP载体,而且无移码突变。
2.4.3 BpUGDH蛋白定位于叶绿体
通过对农杆菌浸染4d 的烟草叶片下表皮进行荧光检测,发现GFP绿色荧光在叶绿体中分布,且与叶绿素自发荧光重叠(见图5),说明BpUGDH-GFP融合蛋白表达在叶绿体中,与预测结果相一致。
3 讨论
3.1 BpUGDH基因启动子的功能缺失分析
UGDH 是半纤维素和果胶生物合成途径中的关键酶,催化UDP-Glc 生成多糖合成过程中的关键前体物质,参与多种糖代谢过程。UGDH 的几种同种型(isoforms)通常存在于植物中,并且每种同种型在植物发育期间表现出不同的表达模式,如拟南芥[23]、甘薯(Ipomoea batatas)[27]、兴安落叶松[19,28]等。在我们之前的研究中,在杂交构树的转录组数据库中发现了5 个UGDH 转录物。有关UGDH 基因的研究目前主要集中在克隆、表达及少数的功能分析方面,关于UGDH 基因启动子的克隆及其功能、顺式作用元件的活性分析报道尚少。启动子的5'端缺失分析是研究分析启动子表达特性及其调控元件功能的最常用方法之一[29]。本研究中以BpUGDH 基因启动子作用元件在线预测结果为依据,根据常见的顺式作用元件及低温响应元件位置,构建了5 个缺失载体并同时在烟草叶片中瞬时表达。对烟草叶圆片GUS组织化学染色,发现5 个含有不同作用元件的缺失载体均可激活GUS 基因的表达且表达强度有所差异,与5 个缺失片段相比BpUGDH 全长启动子片段表达最强,并且5 个缺失片段中PB5-IAA 和PB6-GA 的GUS 染色与全长启动子的相当,而PB2-ETH、PB3-MeJA 和PB4-低温均较弱(见图3C)。对各个缺失片段进一步GUS 含量测定,将会更好的比较分析各个顺式作用元件的GUS 活性[30],因此本研究下一阶段对瞬时表达的烟草叶片进行GUS 含量测定,发现BpUGDH 全长启动子片段GUS含量最高,其他5 个缺失片段的GUS 活性均较低,其中PB2-ETH、PB3-MeJA、PB4-低温缺失片段的GUS 活性显著降低(见图3B),与GUS 染色结果基本一致。此结果进一步证明BpUGDH 基因启动子的-973、-465、-355、-281 和-244 bp 的区域均可能对调控其活性发挥着重要的作用,并且BpUGDH 基因启动子所缺失的各个顺式作用元件不能使其失去活性。基因表达调控是多层次的、复杂的过程。基因启动子上的顺式作用元件与对应于该元件的转录因子的相互作用,精确的调控着下游基因的转录,并且启动子不同顺式作用元件有着不同的启动转录的能力,因此,致使下游基因蛋白的表达产生差异。例如:Xue[31]的研究显示,HvCBF1转录因子通过结合LTRE1(CCGAAA)、LTRE15(CCGAC)顺式作用元件来调控大麦的冷应答基因。Feng[32]等从苹果(Malus×domestica)中分离鉴定的低温响应的MdCIbHLH1 基因能够特异的结合到拟南芥(Arabidopsis)CBFs 启动子的MYC 识别位点,并且激活其表达。本研究中的这些顺式作用元件是否促进或者抑制BpUGDH 基因的转录效果以及作用顺式作用元件之间相互的关系、各个响应元件如何调控BpUGDH 基因启动子的活性等还需要进一步的深入研究。

附图1 BpUGDH基因启动子序列和顺式作用元件A 代表转录起始位点,ATG 表示起始密码子。重要的顺式作用元件用不同颜色的方框表示,其中ERE 是乙烯响应元件;GARE-motif 是赤霉素响应元件;TGA-element是参与生长素的顺式反应元件;CGTCA-motif是水杨酸响应元件;LTR是参与低温反应的顺式作用元件。Attached fig.1 The sequences of BpUGDH promoter and cis-elementsA represents the transcriptional start site,ATG represents the starting codon. Important cis-acting elements are represented by boxes of different colors,where ERE is an ethylene-responsive element;GARE-motif is a gibberellin-responsive element;TGA-element is an auxin-responsive element;CGTCA-motif is a cis-acting element involved in salicylic acid responsiveness;LTR is a cis-acting element involved in low-temperature responsiveness.
3.2 杂交构树BpUGDH位于叶绿体
利用GFP 融合报告基因融合目的基因进行蛋白质的亚细胞定位是为了定位此蛋白质在细胞中表达的具体位置,从而推测其功能及所参与的代谢途径[33]。绿色荧光蛋白GFP 灵敏度高、对活细胞无毒害作用而且能在目的蛋白质的N 端(C 端)融合,保持其天然蛋白的特性,从而被众多研究者广泛应用[28,34~36]。目前,UGDH 的亚细胞定位相关的研究并不多见。利用在线软件Target P 预测兴安落叶松UGDH 基因,猜测其定位在细胞质中[37]。本研究中,我们同样利用Target P 预测显示,BpUGDH 定位于分泌途径中,但RC值为4,预测可信度偏低。正因为如此,我们再寻找一个最近备受欢迎的在线软件Cell-PLoc 2.0 再次对BpUGDH蛋白亚细胞定位进行预测,发现其定位于叶绿体中。本研究为了证实BpUGDH 在细胞中的具体表达位置,构建35S 驱动的BpUGDH 与GFP 融合基因表达载体,进一步进行烟草叶片的瞬时转化,观察到了35S::BpUGDH-GFP 在烟草叶片表皮细胞的叶绿体中表达。叶绿体是植物进行光合作用的重要场所,是光合作用所需酶类主要的存在部位[33],说明杂交构树UGDH 可能在细胞繁衍过程中提供所必需的能量物质[38]。BpUGDH 基因编码蛋白的亚细胞定位研究为今后深入分析该基因功能、筛选其合作蛋白以及了解BpUGDH 基因奠定了理论依据。
4 结论
(1)将不同长度的BpUGDH 启动子5'端缺失片段与GUS基因连接,进行表达活性分析,结果显示BpUGDH 启动子的5'端缺失-1 304~-973、-1 304~-465、-1 304~-355、-1 304~-281 和-1 304~-244 bp 均不能使Pro.BpUGDH 失去活性,并且-973、-465、-355、-281、-244 bp 的 区 域 可 能 对BpUGDH 基因启动子的活性发挥着至关重要的作用。
(2)利用DNA 重组技术将BpUGDH 与GFP 融合,构建pCAMBIA 1300-35S::BpUGDH-GFP 表达载体,并观察了35S::BpUGDH-GFP 在烟草叶片表皮细胞中的表达。结果显示35S::BpUGDHGFP 的绿色荧光在叶绿体中分布,并且与叶绿素的自发荧光重叠,说明BpUGDH 蛋白表达在叶绿体中。
致谢感谢内蒙古大学生命科学学院林晓飞老师实验室提供交流学习的实践平台。
——一道江苏高考题的奥秘解读和拓展

