澳洲坚果MiMYB2基因克隆及结构与功能分析
王文林 陈海生* 郑树芳 樊松乐 王立丰 谭秋锦覃振师 黄锡云 贺 鹏 汤秀华 许 鹏
(1. 广西南亚热带农业科学研究所,龙州 532400;2. 海南大学热带作物学院,海南省热带生物资源可持续利用重点实验室,海口570228;3. 农业农村部橡胶树生物学与遗传资源利用重点实验室;省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室;农业农村部儋州热带作物科学观测实验站;中国热带农业科学院橡胶研究所,海口 571101)
澳洲坚果(Macadamia integrifolia)是一种原产于澳大利亚的常绿乔木果树,其果仁含有丰富的不饱和脂肪酸、蛋白质、氨基酸、可溶性糖、膳食纤维和矿物质等营养成分,具有药用和保健等功能[1]。澳洲坚果果仁可加工成饮品、食品和果油等[2-3]。澳洲坚果副产品,比如果壳可用于制备活性炭[4]和吸附剂[5],油粕可用于生产动物饲料[1]和多肽[6]等,经加工后可提高其经济附加值。我国澳洲坚果品种主要是经过试种驯化的国外优良品种。国外优良品种在我国试种期间,经常面临产量及品质降低的问题[7]。这是由于我国澳洲坚果主要种植地域分布在广西、云南、贵州和四川,随着环境的变化,各种病虫害如花疫病、枝枯病、炭疽病、蚜虫和蛾类等[8],干旱[9]、磷[10]、低温[11]等不可预测的非生物胁迫和生物胁迫对澳洲坚果的生长发育、品质和产量均有影响,制约了其产业的发展。
MYB转录因子是一个植物转录因子家族。其中MYB 家族成员R2R3-MYBs 参与了多种生物过程,包括生长发育、激素信号转导、代谢、生物胁迫和非生物胁迫等。例如,AtMYB77 和ARF7 相互作用参与拟南芥生长素的信号转导[12]。AtMYB32参与拟南芥花粉正常的发育[13]。杨树MYB165 和MYB194属于R2R3-MYB家族,启动子激活实验表明MYB194 和MYB165 抑制原花青素生物合成相关基因启动子激活,过表达MYB165 和MYB194 转基因杨树导致叶片花青素积累减少,根系原花青素含量降低[14]。R2R3-MYB 家族转录因子成员AtMYB102 对 昆 虫 草 食 动 物 菜 青 虫 有 抗 性[15]。PbrMYB21 在耐旱性方面发挥着积极的作用[16]。迄今,澳洲坚果转录调控方面的研究和MYB 家族转录因子成员的结构与功能信息研究尚属空白。研究R2R3-MYB 家族成员的结构与功能为阐明澳洲坚果抗逆机制和提高澳洲坚果品质和产量,促进产业发展具有重要意义。本研究从“桂热一号”品种的叶片中克隆MiMYB2 基因,利用生物信息学对其结构和功能进行分析。澳洲坚果R2R3-MYB 家族转录因子成员的结构和功能的深入研究,将为阐明澳洲坚果生长发育和产量形成机制提供理论参考。
1 材料与方法
1.1 试验材料
试验材料“桂热一号”和“695”品种由广西南亚热带农业科学研究所澳洲坚果种质圃(E106.79.84,N22.14.34)提 供。“桂 热 一 号”和“695”澳洲坚果品种嫁接苗种植于广西南亚热带农业科学研究所中,2019 年3 月选取2008 年嫁接种植,树龄为11 年两品种澳洲坚果成年树健康植株的枝条、花、叶为材料进行转录组分析。
1.2 试验方法
1.2.1 提取总RNA和cDNA的合成
按照总RNA 提取试剂盒提供的说明书,提取澳洲坚果“桂热一号”品种叶片的总RNA,RNA 和反转录得到cDNA 的浓度与纯度由Thermo Fisher NanoDrop 2000 超微量核酸蛋白分析仪检测(Gene Company Limited,上海)。按照TaKaRa 反转录试剂盒的说明书合成cDNA,1%琼脂糖凝胶电泳检测RNA完整性。
1.2.2 克隆MiMYB2基因全长
根据澳洲坚果转录组测序序列,利用primer primer 6.0 软 件 设 计 引 物MiMYB2F,5′-CGGTCCTTCTCAGTTTCTGC-3′,MiMYB2 R,5′-GCATCCTAACATCCCTGGAA-3′,引物序列由公司合成。以澳洲坚果“桂热一号”品种正常叶片的cDNA 为模板,利用PCR 扩增MiMYB2 的全长序列,PCR 反应体系20.0 µL:69 µg·L-1cDNA 模板1.0 µL,2×EX-Taq PCR Master Mix 10.0 µL,上、下游引物各0.5 µL,ddH2O 补足至20.0 µL。扩增程序:95℃预变性3 min;95℃30 s,55℃50 s,72℃,80 s,32 个循环;72℃10 min。将PCR 产物加到0.8%琼脂糖凝胶中进行电泳检测,切割目的条带后回收纯化,目的片段连接pMD-18T 载体,16℃水浴 4 h 后,转化大肠杆菌DH5α 感受态细胞中,恢复培养后均匀涂布在含羧苄抗性的培养基上,经PCR检测后挑取阳性克隆测序。
1.2.3 MiMYB2生物信息学分析
利用在线分析工具ProtParam(https://web.expasy.org/protparam/)、TMPred(https://embnet.vitalit.ch/software/TMPRED_form.html)、SMART:Main page (http://smart. embl-heidelberg. de/smart/set_mode.cgi?NORMAL=1)、PHYRE、PlantmPLoc2、PSIPRED V4.0(http://bioinf.cs.ucl.ac.uk/psipred/)、SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)和 MEME(http://meme-suite. org/tools/meme)等对MiMYB2 进行生物信息学预测分析。利用Clustal Omega 在线工具软件进行多序列比对。MEGAX 软件构建系统进化树(neighbor-joining,bootstrap 值设为1 000)。用于系统进化分析的拟南芥和其他物种的蛋白序列均下载自NCBI。
2 结果与分析
2.1 MiMYB2基因克隆
按照试剂盒操作方法提取澳洲坚果“桂热一号”品种叶片的总RNA,从图1 可见RNA 28S,18S和5S 条带清晰完整且没有发生降解(见图1A)。以cDNA 为模板,采用PCR 扩增目的基因,结果如图1B 所示,扩增出了与预期大小相符的特异性条带。以澳洲坚果“桂热一号”品种正常叶片的cDNA 为模板,利用PCR 技术克隆得到MiMYB2 cDNA 基因全长,测序验证后,将cDNA 序列命名为MiMYB2。将MiMYB2 基因序列上传至NCBI 数据库,GenBank 登陆号为MN254976,MiMYB2 基因的cDNA 全长序列1 210 bp,包含1 002 bp 的开放阅读框(ORF)如图2 下划线标记序列,编码333 个氨基酸。

图1 澳洲坚果桂热一号RNA检测及基因克隆结果A.RNA电泳图;B.MiMYB2基因PCR扩增结果(M.Marker DL2000;1. 目的基因扩增产物)Fig.1 Total RNA of M.ntegrifolia(GUIRE1)and the PCR amplification products of MiMYB2 geneA. Total RNA of M. integrifolia(GUIRE1);B. The PCR amplification products of MiMYB2 gene. M:Marker DL200;1. The objective gene amplification products
2.2 MiMYB2蛋白质的理化性质预测
利用ProtParam 工具在线分析MiMYB2 蛋白质的理化性质:分子式C1556H2477N447O511S19,总原子数5 010,分子量为36.231 61 kDa,等电点5.70,带负电荷残基总数(Asp+Glu)为42,带正电残基总数(Arg+Lys)为37,不稳定系数为67.68(该蛋白属于不稳定蛋白),脂肪族氨基酸指数是67.09,总平均亲水性为-0.507,推测MiMYB2蛋白是一个不稳定的亲水蛋白。
2.3 MiMYB2蛋白质的磷酸化位点、跨膜结构及亚细胞定位预测

图2 MiMYB2基因测序结果Fig.2 Sequence result of MiMYB2 gene
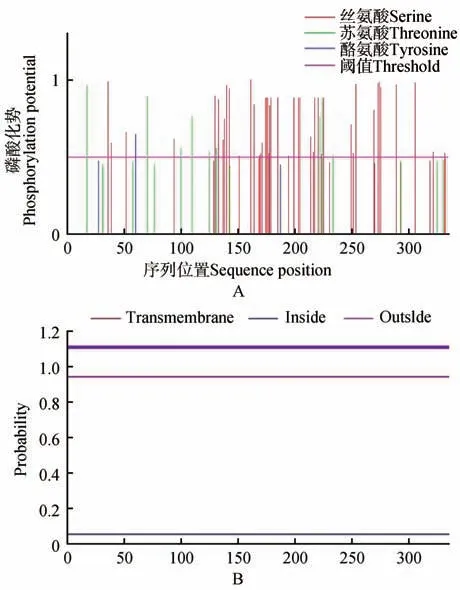
图3 MiMYB2蛋白的磷酸化位点和跨膜结构预测结果A.MiMYB2蛋白的磷酸化位点预测结果;B.MiMYB2跨膜结构预测Fig.3 Prediction of phosphorylation sites and transmembrane structures of MiMYB2 proteinA.Prediction of phosphorylation site of MiMYB2 protein;B.Prediction of transmembrane domain of MiMYB2
利用NetPhos 3.1 在线分析工具预测MiMYB2蛋白磷酸化位点,结果表明,MiMYB2 氨基酸序列有可能发生磷酸化的氨基酸位点共有53 个,丝氨酸磷酸化位点44个,苏氨酸磷酸化位点7个,酪氨酸磷酸位点2 个(见图3A)。根据MiMYB2 蛋白磷酸化位点预测结果,推测MiMYB2 蛋白以丝氨酸为主的磷酸化修饰,调控澳洲坚果的生物功能。利用TMPred 在线工具分析预测MiMYB2 跨膜结构,结果表明MiMYB2 蛋白无跨膜结构,推测Mi-MYB2 是非跨膜蛋白。利用SignalP-5.0 Server 分析预测MiMYB2 蛋白存在信号肽的概率为0.09%(见图3B),推测MiMYB2 是非分泌型蛋白。利用PlantmPLoc2 预测分析MiMYB2 蛋白亚细胞定位,预测结果显示其定位于细胞核中,其进一步证明MiMYB2 编码一个转录因子蛋白。
2.4 MiMYB2 蛋白质保守结构域、二级结构、三级结构分析
利用SMART:Main page 分析预测MiMYB2 蛋白的保守结构域,发现其存在2 个SANT 结构域和5 个低复杂度其位置排序分别在13-63、66-114、128-143、168-179、214-226、235-246 和253-284 氨基酸处,MiMYB2 氨基酸序列具有两个SANT 保守结构域(见图4B),推测其属于R2R3-MYB 家族。利用SOPMA 分析MiMYB2 蛋白的二级结构,结果显示α 螺旋占37.54%,延长链占10.81%,β 折叠占6.31%,无规卷曲占45.35%(见图4A)。利用PHYRE 分析MiMYB2 的三级结构如图4C 所示。据此推测MiMYB2 是一个转录因子并且属于R2R3-MYB家族成员。
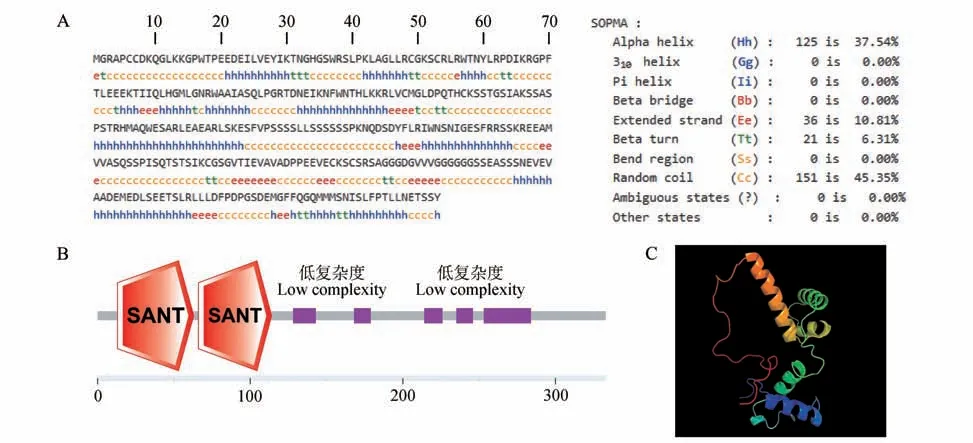
图4 MiMYB2结构分析A.MiMYB2二级结构预测;B.MiMYB2保守结构域预测;C.MiMYB2三级结构预测Fig.4 Structural analysis of MiMYB2A.PredictionforthesecondarystructureofMiMYB2;B.PredictionoftheconserveddomainsofMiMYB2;C.PredictionforthetertiarystructureofMiMYB2
2.5 MiMYB2系统进化分析
如图5 所示,澳洲坚果MiMYB2(M.integrifolia,MN254975)与荷花NnMYB3-like(Nelumbo nucifera,XP_010255443.1)、荷花Nnmyb-related protein 308-like(Nelumbo nucifera,XP_010273102.1)、醉 蝶 花 ThMYB6(Tarenaya hassleriana,XP_010523735.1)、麻 风 树JcMYB6(Jatropha curcas,XP_012083427.1)和哥伦比亚锦葵HuMYB41(Herrania umbratica,XP_021280626.1)进行同源性分析,相似性分别为64.79%,65.99%,59.88%,58.08%和56.18%,其与荷花NnMYB3-like 同源性最高。Clustal 进行多序列比对分析并根据图4B分析的结果标注MiMYB2 保守结构域SANT(见图5A)。利用MEME 分析澳洲坚果MiMYB2 与其在NCBI数据库中比对亲缘性较高的MYB蛋白序列,预测了排名前三的motif 且标注了其在相应序列的位置,如图5B 所示澳洲坚果MiMYB2 a(77-126)、b(1-50)、c(339-367),同源性越高的序列,其motif 的大小及位置越接近。Motif 与植物的生物学功能息息相关。将MiMYB2 编码的蛋白序列与BLAST 比对结果中相似性较高的已知其他植物的MYB 序列进行系统进化分析,表明MiMYB2 与荷花 NnMYB3-like (Nelumbo nucifera, XP_010255443.1)、荷花Nnmyb-related protein 308-like(Nelumbo nucifera,XP_010273102.1)亲缘关系较近(见图6A)。系统进化分析澳洲坚果MiMYB2与126个拟南芥R2R3-MYB家族成员的蛋白序列,如图6B 结果显示MiMYB2 与AtMYB17、AtMYB106、AtMYB91、AtMYB16 亲缘关系较近,AtMYB17、At-MYB106、AtMYB16 属于拟南芥S9 亚族[17],推测MiMYB2具有与S9亚族成员相似的功能。
2.6 MiMYB2基因组织表达模式分析
为研究MiMYB2 基因在“桂热一号”和“695”品种不同组织中的表达模式,本研究从“桂热一号”和“695”品种澳洲坚果转录组数据中提取了MiMYB2基因在枝条、花、和叶片的表达数据,分析其在不同品种和不同组织的表达模式。如图7 所示,“桂热一号”品种,MiMYB2 主要在枝条和叶片中表达,花中的表达量较低,叶片中MiMYB2 基因表达量是花的8 倍左右;“695”品种中,MiMYB2 主要在花中表达,枝条和叶片中表达量较低,在花中的表达量是叶片的10 倍左右。“桂热一号”和“695”品种同一组织MiMYB2 基因的表达在花和叶片中相差较大,特别是其在花中的表达量“695”是“桂热一号”的13倍左右。
3 讨论
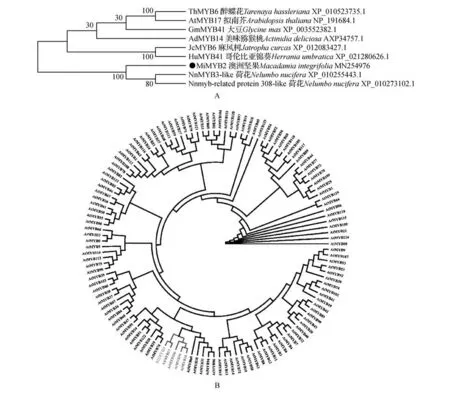
图6 澳洲坚果MiMYB2系统进化分析A. 植物中部分MYB转录因子的系统进化树;B. 澳洲坚果MiMYB2蛋白与拟南芥中126 R2R3-MYB家族成员蛋白序列的系统树聚类分析Fig.6 Phylogenetic analysis of M.integrifolia MiMYB2A. Phylogenetic tree of MiMYB2 and other plant MYB transcription factors;B. Phylogenetic tree of MiMYB2 from M. integrifolia and 126 R2R3-MYB protein members from Arabidopsis with indicated GenBank accession numbers
澳洲坚果果仁具有丰富的脂肪酸,赵大宣等采用气相色谱、质谱联用技术检测到13 种脂肪酸成分,其中不饱和脂肪酸(油酸、异油酸、棕榈酸)总量占了69.12%,饱和脂肪酸总量占30.87%,不饱和脂肪酸对冠心病、糖尿病等疾病具有效用[18]。杨为海等分析了不同种质澳洲坚果果仁矿质元素含量,研究发现果仁中含有多种常量和微量元素,如K、Mg、Mn、Fe 平均含量分别为3.87、1.85、95.91和90.58 mg·kg-1[19]。澳洲坚果果油含有生育酚、角鲨烯等多种抗氧化物质[1]。澳洲坚果青皮提取的多酚,以Trolox 为阳性对照评价其抗氧化性,研究发现其可用于制备天然抗氧化剂[20]。宁平等研究表明澳洲坚果果壳可用于制备活性炭。涂行浩等利用微波辐照澳洲坚果果壳制备的活性碳产品,其吸附性能超过国家一级标椎[4,21]。杨雯等以澳洲坚果果壳等为原料,利用超声-7 碱组合技术制备的吸附剂可用于处理印染废水[5]。澳洲坚果及其副产品具有较高的营养价值和经济价值。我国澳洲坚果品种主要是经过试种驯化的国外优良品种,优良品种离开本土后其产量和品质均有下降,不可预测的生物和非生物胁影响着澳洲坚果的品质和产量。迄今,澳洲坚果的研究主要集中在栽培管理和杂交育种、诱变育种等,然而澳洲坚果如何调控高产优质的机制及抗逆机制尚不清楚且研究较少。分子标记育种技术结合杂交育种是选育澳洲坚果优良新品种的重要方法。宫丽丹等[22]研究澳洲坚果耗水规律及灌溉制度,结果表明不同时期合理灌溉可提高产量和品质。谭秋锦等[23]研究发现土壤养分因子(氮、钾、pH、有机碳)对澳洲坚果果实的品质有影响,适当提高土壤氮、钾含量合理控制施肥种类可以提高其品质。唐莹莹等[24]建立的澳洲坚果RAPD 标记反应体系可用于分析澳洲坚果遗传多样性及鉴定种质资源。孔广红等[25]利用Co-γ 射线辐照不同种质澳洲坚果种子,筛选出了4 株性状优良的突变单株。Nock 等对广泛种植的澳洲坚果品种741 的基因组和转录组进行了测序,将澳洲坚果测序结果与其他5 种真双子叶植物的基因家族比较,发现了13 689 个含有澳洲坚果基因的簇和1 005 个澳洲坚果特异簇。通过对参与氰苷生物合成的澳洲坚果基因的分析,发现了几个高表达的候选基因,为病原识别、植物防御和单萜合成中基因家族的功能研究打下了基础[26]。Abubaker等[27]对埃及栽培的澳洲坚果进行了DNA 指纹图谱分析,在DNA 指纹图谱研究中记录了16个不同的RAPD片段。
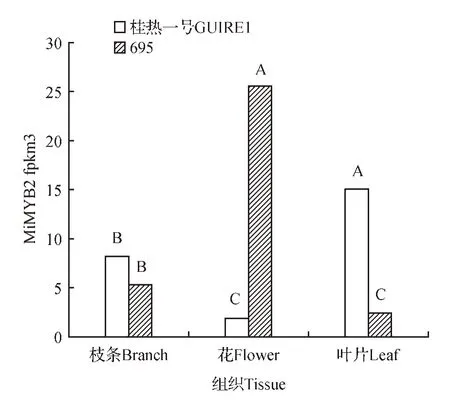
图7 MiMYB2基因在不同品种和组织中的表达分析各柱形图上用不同大写字母标识表示数据间差异极显著(P<0.01)Fig.7 MiMYB2 expression in different cultivars and tissuesDifferent uppercase letters above each column means significant at P<0.01 level
R2R3-MYB 家族转录因子成员与植物的生长发育、生物胁迫和非生物胁迫密切相关。研究澳洲坚果R2R3-MYB 家族成员的结构与功能,将为阐明澳洲坚果产量调控机制具有重要的意义。本研究通过PCR技术从澳洲坚果“桂热一号”的叶片克隆了MiMYB2 基因,测序分析cDNA 序列全长为1 210 bp,推导的氨基酸序列为1 002 bp ORF,编码333 个氨基酸。生物信息学分析发现,MiMYB2具有两个SANT保守结构域,推测属于属于澳洲坚果R2R3-MYB 家族;MiMYB2 定位于细胞核是一个无跨膜结构、无信号肽的不稳定亲水蛋白。
MiMYB2 蛋白序列提交到NCBI 数据库进行BLAST 比对分析,结果表明其与荷花NnMYB3-like(Nelumbo nucifera,XP_010255443.1)同源性最高(见图5A)。Deng 等对荷花(Nelumbo nucifera)中116个R2R3 MYB基因的基因结构、表达模式等进行分析,R2R3-MYB基因可分为4组并利用荧光定量PCR 分析了13 个与类黄酮生物合成相关的MYB 基因在荷花不同组织中的表达模式[28]。Sun等[29]利用酵母双杂交试验证明,NnMYB5 与Nnb-HLH1、NlbHLH1 和NnTTG1 相互作用,NnTTG1 也与NnbHLH1 和NlbHLH1 相互作用。在拟南芥中过表达NnMYB5 导致拟南芥未成熟种子和花梗中的花青素积累,TT19表达上调,证明NnMYB5是花青素合成的转录激活因子。Peng 等[30]对麻疯树MYB 家族的全基因组鉴定,鉴定了128 个MYB 基因包括123 R2R3-MYBs,4 R1R2R3-MYBs 和1 4RMYB,选取JcMYB2 基因进行功能研究,发现过表达JcMYB2 植物比野生型更耐盐、耐冷胁迫。Mi-MYB2 氨基酸序列与126 个拟南芥R2R3-MYB 家族成员的系统进化分析表明,MiMYB2 与At-MYB17、AtMYB106、AtMYB91、AtMYB16亲缘关系较近(见图6B),AtMYB17、AtMYB106、AtMYB16属于拟南芥S9 亚族,将MiMYB2 聚类为S9 亚族。R2R3-MYB 家族转录因子成员,AtMYB17 与早期花序发育和种子萌发相关[31]。成熟拟南芥表皮毛的转录谱分析表明,NOECK 编码MIXTA-Like 转录调控因子MYB106 与细胞生长有关[32]。白桦中一种新的R2R3-MYB 转录因子BpMYB106 通过上调光合作用和氧化磷酸化途径相关基因表达,提高光合作用和生长速率[33]。拟南芥R2R3-MYB 家族成员MYB16 和MYB106 在生殖器官、营养器官和表皮毛中调控角质层形成[34]。拟南芥S9 亚族成员主要与植物的生长发育相关。通过系统进化分 析 将MiMYB2 与AtMYB17、AtMYB106、At-MYB16 聚类为S9 亚族。分析“桂热一号”和“695”品种澳洲坚果转录组数据中MiMYB2 基因在不同组织的表达模式。从图7可知,“桂热一号”中,Mi-MYB2 在花中的表达量最低,然而“695”中花中的表达量最高。花属于植物的生殖器官,其形成与生长属于生殖生长,成花的迟早接的影响了果树的产量。Cao 等[35]通过荧光定量PCR 检测了20 个可能参与木质素生物合成的PbMYB 基因的表达模式,推测PbMYB25 和PbMYB52 是梨果实发育过程中参与木质素合成调控的候选基因。苹果MYB转录因子MdMYB3 参与花青素生物合成和花发育的转录调控,MdMYB39L 与花粉管生长相关[36-37]。在烟草中过表达桃子转录因子MYB10.1 导致了NtMYB305 的抑制,而NtMYB30 是花发育所必需的[38]。综上,推测MiMYB2 参与调控澳洲坚果生长发育及产量形成机制,有待深入研究。

