辅酶Q10/两亲性木聚糖纳米悬浮剂的制备以及生物利用度
张晓雪 赵修华 刘艳杰 王玲玲 张 茜
(东北林业大学化学化工与资源利用学院,东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
据统计表明,在美国药典中有30%以上的药物为难溶性药物;在NCE(New chemical entities)研究中,有一半以上由于溶解度小而不能达到效果[1]。另一方面,药物的吸收与释放也存在较大问题。其中口服给药是目前比较常用、易被患者接受的一种给药体系[2]。因此如何增加这类药物的溶解度以及提高其口服生物利用度成为当前面临的巨大挑战。在过去的几十年里,关于辅酶Q10(CoQ10)开发其相关剂型来有效地提高药物的溶解度、稳定性和通透性,从而提高药物的口服生物利用度成为人们的研究热点。固体分散体、环糊精包合物、微囊脂质体或纳米悬浮剂作为口服给药系统被越来越多地进行研究[3],其中纳米混悬剂可有效改善难溶药物的稳定性以及提高难溶性药物的生物利用度。纳米混悬剂制备工艺简单,可以通过介质研磨、高压均质和超临界流体等技术用于制备,亦可以通过多种途径进行递送。纳米混悬剂能够增强药物的分散性和稳定性,可以通过减小粒径,增加其表面积进而增加其溶解度[4]。CoQ10 是一种脂溶性醌类化合物,对心血管疾病和肝脏疾病有良好的辅助作用,近期研究发现,CoQ10 是人体细胞中重要的生化辅酶之一,具有抗氧化和清除自由基、维持细胞膜的通透性、抗肿瘤以及提高人体免疫功能等作用。但由于CoQ10相对分子量大,水溶性差,生物利用度低,限制了其良好的体内生物活性。且CoQ10 稳定性差,口服生物利用度低而导致其功效的发挥受到局限[5~7]。本文通过高压均质法制备CoQ10纳米悬浮剂,制备并优化CoQ10 纳米悬浮剂能明显增加难溶性药物的溶出速率,并显著提高CoQ10 的口服生物利用度,具有非常广泛的应用前景。
1 材料与方法
1.1 材料
木聚糖(xylan,来自于玉米芯,阿拉丁试剂有限公司),二水槲皮素(Quercetin dihydrate,≥97%,阿拉丁试剂有限公司),二甲亚砜(DMSO,≥98%),辅酶Q10(CoQ10,≥99%),丁二酸酐(Succinic anhydride,化学纯,国药集团化学试剂有限公司),1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸(EDC·HCl,≥98%,麦克林试剂有限公司),DMAP(4-甲氨基吡啶,≥99%,阿拉丁试剂有限公司),N-羟基丁二酰亚胺(NHS,≥98%),芘(≥98%),肝素钠(麦克林试剂有限公司),玻璃毛细管(北京友诚生物科技有限公司),甲醇为色谱级纯(天津市天力化学试剂有限公司),实验所用水均为去离子水。
1.2 仪器
激光粒度仪(LLS,美国布鲁克海文);HPLC色谱仪(日本岛津公司);FSH2A 可调剪切式高速匀浆机(常州市国旺仪器制造有限公司);F-7000 FL220-240V 荧光分光光度计;Scientz18N 型冷冻干燥机(宁波新芝生物科技股份有限公司);傅立叶变换红外光谱仪(日本岛津公司);核磁共振波谱仪(瑞士Bruker公司)。
1.3 QT-Xylan共聚物的合成与表征
1.3.1 QT-Xylan共聚物的合成方法
通过水溶性的木聚糖与槲皮素的碳二亚胺反应,制备了槲皮素-木聚糖偶联物。简而言之,就是在5 mL DMSO 中加入丁二酸酐(琥珀酸酐∶QT=1.3∶1.0,摩尔比)。反应混合物在40℃下搅拌过夜。然后将EDC·HCl 和NHS(EDC∶NHS=1∶1,按摩尔比)在1 mL DMSO 中加入到室温下的搅拌溶液中。30 min 后,将100 mg 木聚糖加入到反应溶液中。混合物在室温下搅拌24 h。然后通过反溶剂沉淀法在混合物中加入乙醇,5 000 r·min-1离心10 min 将所得沉淀经冻干得到槲皮素—木聚糖偶联物[8]。
1.3.2 红外光谱的结构鉴定与检测(FT-IR)
采用傅里叶变换红外光谱仪(FT-IR,Fourier transform infrared spectrometer),以空白溴化钾做为背景,采用压片法将Xylan、QT-Xylan 共聚物冻干粉以及Xylan 与QT 的物理混合三个样品分别扫描FT-IR图谱,即称取2 mg样品分别与200 mg KBr混合压片,研磨混匀,移置压模。分辨率为2.0 cm-1,扫描范围为4 000~400 cm-1。
1.3.3 核磁共振的结构鉴定与检测(1H NMR)
利用核磁共振光谱仪测定聚合物氢谱,以重水为检测核磁的溶剂,对所合成聚合物载体和xylan分别进行测试。
1.4 单因素优化纳米悬浮剂的制备工艺
高剪切均质机工作的主要原理是利用髙压泵将物料输送到均质阀中,物料瞬间失去压力并以极高的流速被喷出,之后碰撞到碰撞环上,最终得到纳米混悬剂[9]。以平均粒径为指标[10],分别对均质循环次数、均质循环压力、共聚物浓度、共聚物与CoQ10的质量比4个因素进行优化考察。
1.4.1 循环次数
精密称取共聚物QT-Xylan 冻干粉50 mg 将其加入在50 mL 蒸馏水中充分溶解,随后加入50 mg CoQ10,此时冻干粉与原药的质量比为1∶1。首先使用可调高速匀浆机匀浆2 min 使CoQ10 原药与QT-Xylan 偶联物充分于水中分散,形成粗混悬剂,再将制备好的粗混悬剂加入到均质机中,在均质压力500 bar 下,分别循环1、3、5、7、9、11 和13 次,得到CoQ10 纳米悬浮剂。并在相同的条件下进行3次重复实验,用激光粒度仪测定所得的CoQ10纳米悬浮剂的粒径,取3 次平均值,最终得到平均粒径。
1.4.2 循环压力
精密称取共聚物QT-Xylan 冻干粉50 mg 将其加入在50 mL 蒸馏水中充分溶解,随后加入50 mg的CoQ10,此时冻干粉与原药的质量比为1∶1。首先使用可调高速匀浆机匀浆2 min 使CoQ10 原药与QT-Xylan 偶联物充分于水中分散,形成粗混悬剂,再将制备好的粗混悬剂加入到均质机中,在均质循环次数为7 次时,设置均质压力分别为200、300、400、500、600、700和800 bar,得到CoQ10纳米悬浮剂。并在相同的条件下进行3次重复实验,用激光粒度仪测定所得的CoQ10 纳米悬浮剂的粒径,取3次平均值,最终得到平均粒径。
1.4.3 共聚物浓度
精密称取共聚物在蒸馏水中充分溶解,将其浓 度 分 别 配 制 成0.2,0.5,1.0,1.5,2.0,2.5 及3.0 mg·mL-1,此时冻干粉与原药的质量比均为1∶1。首先使用可调高速匀浆机匀浆2 min 使CoQ10 原药与QT-Xylan 偶联物充分于水中分散,形成粗混悬剂,再将制备好的粗混悬剂加入到均质机中,在均质循环次数为7次时,均质压力为500 bar时,得到CoQ10 纳米悬浮剂。并在相同的条件下进行3次重复实验,用激光粒度仪测定所得的CoQ10 纳米悬浮剂的粒径,取3 次平均值,最终得到平均粒径。
1.4.4 共聚物与CoQ10的质量比
精密称取共聚物QT-Xylan 冻干粉50 mg 于50 mL蒸馏水中充分溶解,之后分别加入与共聚物质量比为1∶4、1∶3、1∶2、1∶1、2∶1、3∶1 和4∶1 的CoQ10原药。首先使用可调高速匀浆机匀浆2 min使CoQ10 原药与QT-Xylan 偶联物充分于水中分散,形成粗混悬剂,再将制备好的粗混悬剂加入到均质机中,在均质循环次数为7 次时,均质压力为500 bar 时,得到CoQ10 纳米悬浮剂。并在相同的条件下进行3次重复实验,用激光粒度仪测定所得的CoQ10 纳米悬浮剂的粒径,取3 次平均值,最终得到平均粒径。
1.5 体外释放
1.5.1 人工胃液的制备
取5 mL 浓盐酸(37%)加水稀释,定容至1 L。调节pH至1.2,使用前用0.22µm的滤膜过滤。
1.5.2 人工肠液的制备
称取磷酸二氢钾6.805 g,加入500 mL 的超纯水中,超声使其溶解完全。称量0.5 g 氢氧化钠到100 mL 的超纯水中,使其完全溶解,即5 mg·mL-1的氢氧化钠溶液。调节pH 至6.8,加水定容至1 L,使用前用0.22µm的滤膜过滤。
1.5.3 体外溶出检测
由于辅酶Q10 的胃肠液中的饱和溶解度仅为0.157 和0.188 µg·mL-1,在实验中无法精准称量,因此均过量投入介质,将制备出的纳米悬浮剂冻干粉(10 mg)、CoQ10原药(5 mg)和物理混合药(原药5 mg、共聚物载体5 mg),分别放入900 mL 人工胃和人工肠液中,置于恒温搅拌器内,转速100 r·min-1,在37℃恒温下释放。分别在5 min、10 min、15 min、20 min、25 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h 和48 h 的时间点取样5 mL,取样后同时补回5 mL 的人工胃液和人工肠液介质。样品经离心后取上清液,用0.22 µm 的滤膜过滤后,用高效液相色谱仪检测CoQ10的含量。
1.6 生物利用度检测
1.6.1 CoQ10的高效液相色谱检测
CoQ10 液 相 色 谱 柱 反 相C18 柱(250 mm×4.6 mm,5µmol·L-1),柱温为25℃。流动相为甲醇和乙醇,体积比为10∶90,流速为1.0 mL·min-1,检测波长为275 nm,进样量为20 µL。称取10 mg CoQ10溶于50 mL纯甲醇配成0.2 mg·mL-1的母液,稀释母液浓度,配成标准曲线。检测不同浓度下峰面积,根据检测血样的峰面积计算出血样中所含CoQ10的浓度。
1.6.2 大鼠取血
SD 大鼠10 只(哈尔滨医科大学附属第一医院动物中心,清洁Ⅱ级),体重200±50 g,喂食标准颗粒饲料,自由饮水。饲养环境温度为20~25℃,湿度保持在45%~70%。挑选9 只大鼠,随机分成3组,每组3 只,采取灌胃方式给药,CoQ10 浓度为50 mg·kg-1。在灌胃前12 h 开始禁食,保证饮水充足,第二天同时灌胃给药CoQ10 原粉、纳米悬浮剂冻干粉、物理混合药3 种药物,在0.083、0.5、1.0、2.0、4.0、6.0、8.0、10.0、12.0 和24.0 h 时从大鼠的眼眶静脉处取血,滴入装有20µL 1%肝素钠的离心管中,均匀混合,5 000 r·min-1的条件下离心10 min,取出上清血浆,放入冰箱4℃保存,当天处理。
1.6.3 血样处理与测定
精确吸取血清100µL 于1.5 mL 离心管中,加入2 倍体积正丙醇200µL,涡旋2 min,再加入2 倍体积正己烷200 µL,再次涡旋2 min,离心(10 000 r·min-1)5 min,取上清用氮气吹干。残渣用100µL流动相(甲醇∶乙醇)复溶,涡旋3 min,10 000 r·min-1条件下离心5 min,取上清用0.22 µmol·L-1的滤膜过滤后,吸取20µL 经高效液相色谱仪检测,测定CoQ10 浓度。并以大鼠空白血浆中混合不同浓度的CoQ10 标准溶液(理论浓度为100,50,25,20,10,5,1,0.5,0.1 ng·mL-1)得到的数据为基础,研究该方法的选择性、线性、灵敏度、准确度和精密度[11]。
2 结果与分析
2.1 QT-Xylan共聚物的表征
2.1.1 红外光谱的结构鉴定与检测(FT-IR)
首先合成QT-单琥珀酸盐引入羧酸(-COOH)的功能,然后通过碳二亚胺反应与xylan 偶联,傅立叶变换红外光谱如图1 所示,在木聚糖的光谱(见图1a),在3 420 cm-1是归因于-OH 拉伸振动的特征,在890 cm-1的峰值归因于β-糖苷单位之间的联系[12~13]。除了Xylan 和QT(见图1b)的主要峰外,QT-Xylan 偶联聚合物(载体)的FT-IR 光谱(见图1c)在1 735 cm-1处出现了一个新的特征峰,与CO 基团的频率相对应,CO 基团赋予了xylan 和qt-单琥珀酸酯键的形成。
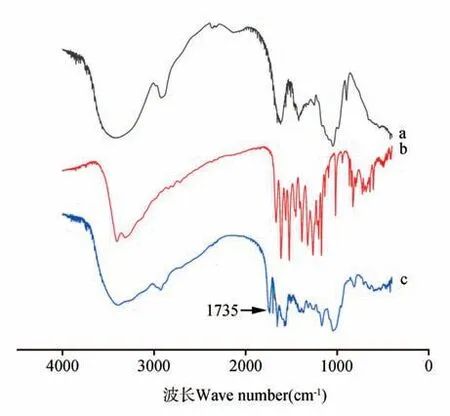
图1 红外光谱图a.Xylan;b. 槲皮素(QT);c.QT-XylanFig.1 Infrared spectraa.Xylan;b.QT;c.QT-Xylan
2.1.2 核磁共振的结构鉴定与检测(1H NMR)
利用核磁共振氢谱进一步验证了聚合物载体的合成。图2 描绘了氢谱qt-xyl 共轭,木聚糖(见图2a)的特征峰出现在5.2~3.0 mg·L-1是由于质子之间(1-4)-β-糖苷键[14],此外,特征峰值在2.4 mg·L-1是由于琥珀酸盐中琥珀酰基的CH2质子。与Xylan(见图2a)的1HNMR 谱相比,QT 的特征峰出现在6.5~8.0 mg·L-1(见图2b),这些特征峰属于QT的苯环[15]。这一特征峰出现在qt-xyl 共轭光谱中,证明了成功合成了qt-xyl共轭聚合物载体。
2.2 纳米悬浮剂的制备和优化工艺
采用高压均质法制备载药纳米悬浮剂[16],通过单因素实验对4个因素分别进行优化,优化工艺使粒径减小并增大其表面积而增加药物溶解度和其生物利用度[17],其结果如下。
2.2.1 均质循环次数
在均质压力为500 bar,共聚物载体浓度为1 mg·mL-1,载体冻干粉与原药的质量比为1∶1,改变均质循环次数,进行实验优化。结果如图3 所示,在均值次数在7次之前粒径大小从228.3 nm不断减小,当均值次数达到7 次时粒径大小基本不变,因此为减少能源损耗,当次数为7 次时是最佳循环次数。
2.2.2 均质循环压力
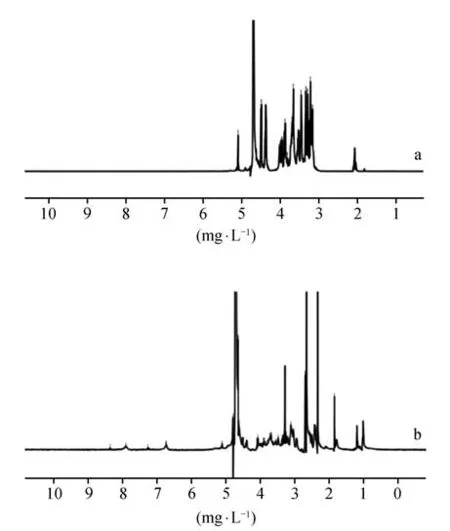
图2 核磁共振氢谱图(1H-NMR)a.Xylan;b.QT-xylanFig 2 Nuclear magnetic resonance hydrogen spectraa.Xylan;b.QT-Xylan
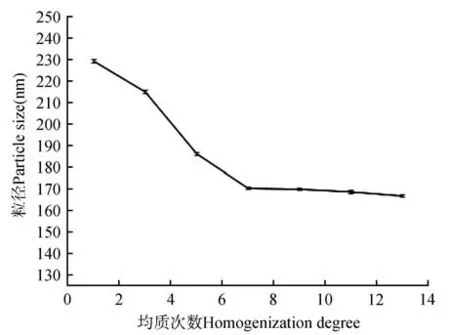
图3 均质次数对粒径大小的影响Fig 3 The influence of homogenization degree on particle size
在均质次数为7 次,共聚物载体浓度为1 mg·mL-1,载体冻干粉与原药的质量比为1∶1,改变均质循环压力,进行实验优化。结果如图4 所示,在均质压力在600 bar 之前,粒径随着压力的不断增大而减小,当压力达到600 bar 时历经达到最小,从292.6 nm 减小到162.6 nm,之后大小基本不变,因此为节约能耗,当均值压力为600 bar 时为最佳均质压力。
2.2.3 共聚物浓度
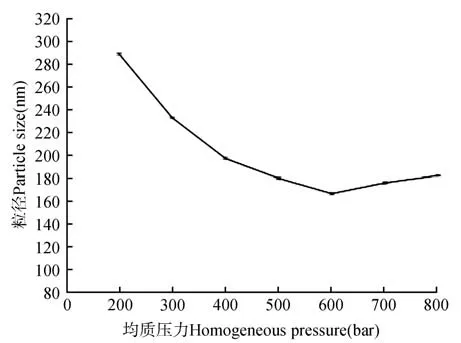
图4 均质压力对粒径大小的影响Fig 4 The influence of homogeneous pressure on particle size
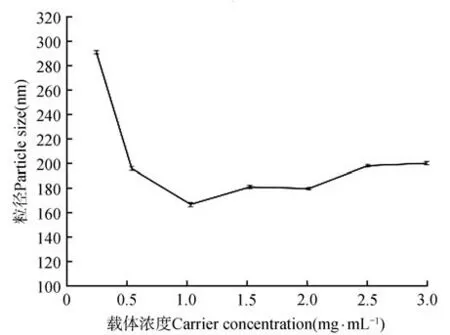
图5共聚物载体浓度对粒径大小的影响Fig 5 The influence of copolymer carrier concentration on particle size
在均质次数为7次,载体冻干粉与原药的质量比为1∶1,均质循环压力为500 bar,改变载体浓度,进行实验优化。结果如图5 所示,在共聚物浓度从0.2~1.0 mg·mL-1时,粒径从297.9 nm 减小到164.1 nm,之后基本维持不变,因此共聚物浓度为1 mg·mL-1为制备的最佳浓度。
2.2.4 共聚物与CoQ10的质量比
在均质次数为7次,共聚物载体浓度为1 mg·mL-1,均质循环压力为500 bar,改变载体冻干粉与原药的质量比,进行实验优化。结果如图6 所示,药物与载体的质量比为1∶4 时,粒径为203.6 nm,并随着质量比的不断增大而逐渐减小,当质量比为1∶1时,其粒径大小为176.8 nm,之后随着质量比的增加而发生较小的改变,因此为节约原料,当质量比为1∶1时为最佳比例。
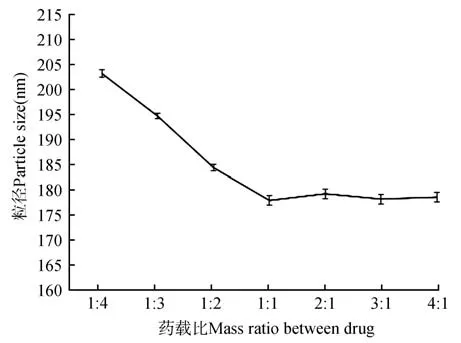
图6 药物与载体的质量比对粒径大小的影响Fig 6 The influence of mass ratio between drug and carrier on particle size
2.3 最佳工艺验证
经单因素实验优化得到的最佳条件如下:均质循环次数为7 次、均质循环压力为600 bar、共聚物浓度为1 mg·mL-1、共聚物与CoQ10 的质量比为1∶1。为了准确验证其制备的平均粒径,因此在所得优化条件下反复实验5次,激光粒度仪测得的平均粒径为166.7 nm,电位为-14.54 mv,与单因素优化实验下的最小粒径基本一致,达到预期目标。
2.4 体外溶出结果分析
图7为CoQ10原药、纳米悬浮剂载辅酶Q10和物理混合物在人工胃液中的溶出曲线,根据液相所测得原药的标准曲线为y=15 879 876.29x-868.820 3,R2=0.999 5,结果可知载药纳米悬浮剂在胃液中的释放效果较CoQ10 原粉、物理混合物都有明显提高,但由于辅酶Q10 的饱和溶解度很低,因此过量称取后的溶出最终累计释放量较低。在溶出实验开始后,CoQ10 原药和物理混合物在人工胃液中的最终释放累积量仅有2.30% 和2.39%,而纳米悬浮剂在人工胃液中的最终释放累积量为4.35%,分别是原药和物理混合物的1.89和1.82 倍。图8 为CoQ10 原药、纳米悬浮剂载辅酶Q10 和物理混合物在人工肠液中的溶出曲线。载药纳米悬浮剂在人工肠液中的释放效果较CoQ10原粉、物理混合物都有明显提高。在溶出实验开始后,CoQ10 原药和物理混合物在人工肠液中的最终释放累积量仅有2.49%和2.70%,而纳米悬浮剂在人工胃液中的最终释放累积量为3.72%,分别是原药和物理混合物的1.49和1.38倍[18]。
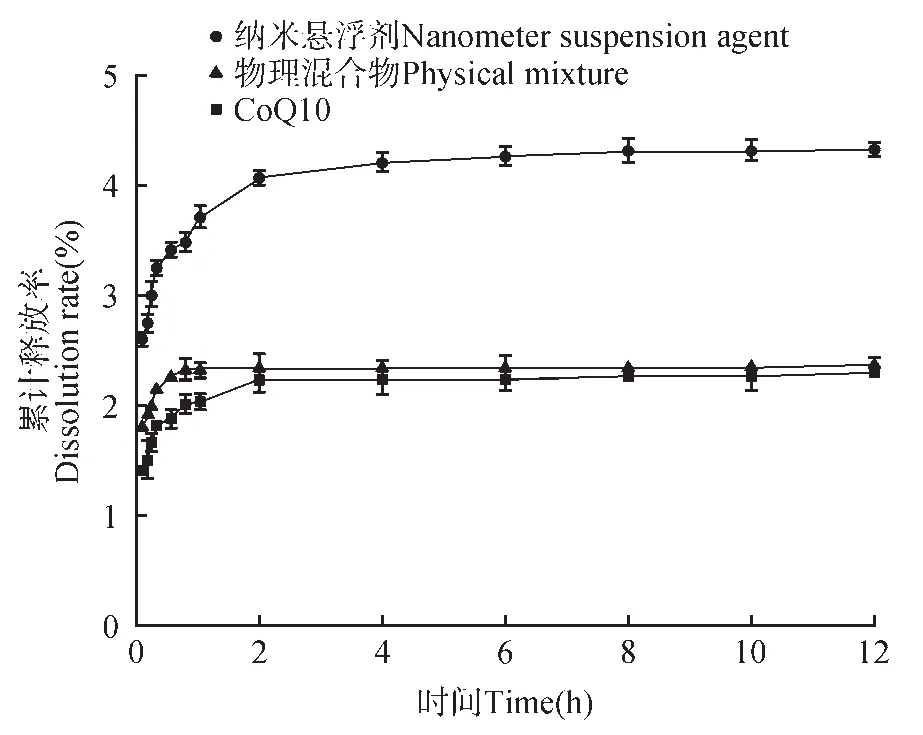
图7 胃液中的累计释放速率Fig.7 Dissolution rate of SGF
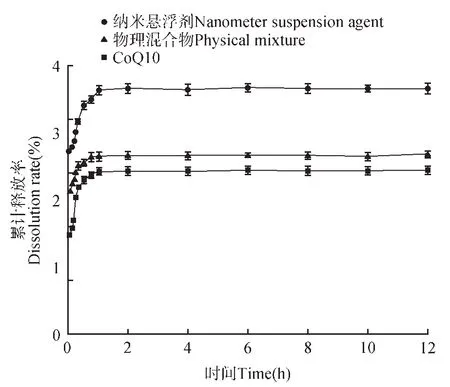
图8 肠液中的累计释放速率Fig.8 Dissolution rate of SIF
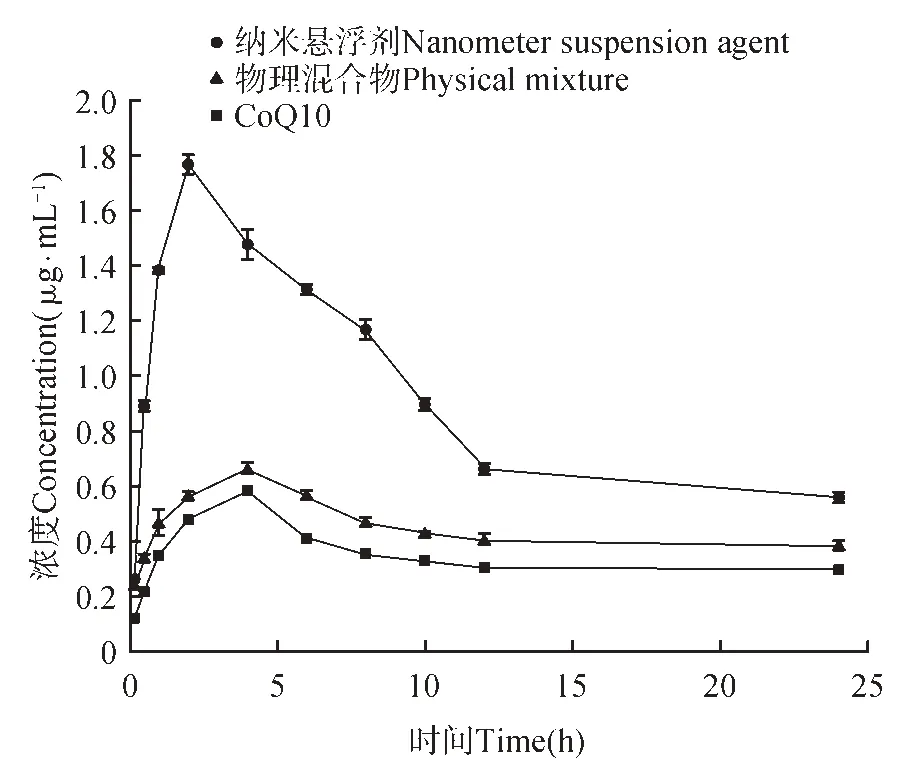
图9 血药浓度Fig.9 Blood concentration
2.5 生物利用度的研究
根据口服CoQ10 后在大鼠血液中的药物浓度评估其在体内的生物利用度[19],结果如图9 所示,CoQ10原药在4 h时血药浓度达到最高为0.6 mg·L-1,物理混合物在4 h 时血药浓度达到最高为0.68 mg·L-1,而纳米悬浮剂在120 min 时血药浓度达到最高为1.77 mg·L-1,出峰时间略有提前且其血药浓度远高于CoQ10 原药的血药浓度。CoQ10 的AUC 值(浓度—时间曲线下面积)为8.26 mg·L-1·h,物理混合物AUC 值为10.72 mg·L-1·h,纳米悬浮剂AUC 值为21.81 mg·L-1·h,是原药的2.64 倍。这可能是由于经高压均质后粒径变小,表面积增大,口服用药时纳米悬浮剂中的药物与胃肠壁的接触面积增大,可以有效地提高药物的生物利用度,更容易被机体快速吸收[20~22],因此利用纳米悬浮剂负载辅酶Q10 是一种理想的口服递送形式。其方法学验证结果如下:曲线拟合y=6 896 617.790 8x+8 399.375 0,线性范围0.1~100 ng·mL-1,回归系数为0.999 6,具有良好的稳定性与精确度,因此可被广泛用于检测样品血浆。
3 讨论
本小结通过合成的QT-Xylan载体具有良好的表面活性剂性质,而应用于制备纳米混悬剂。首先,采用高压均质法包载辅酶Q10,并进行单因素实验对制备工艺进行优化,通过均质循环次数、均质循环压力、共聚物浓度、共聚物与CoQ10 的质量比4种因素对其粒径大小的影响,得到最佳优化工艺,当均质循环次数为7 次、均质循环压力为600 bar、共聚物浓度为1 mg·mL-1、共聚物与CoQ10 的质量比为1∶1 时得到最小粒径,为了其准确性,进行5 次平行实验,所测得的平均粒径为166.7 nm,电位为-14.54 mv,与单因素优化实验下的最小粒径基本一致,形成了一种新型载药纳米悬浮剂,并对其进行一系列体外实验评价。实验结果表明,通过制备以及优化包载辅酶Q10 的新型纳米悬浮剂能够增加CoQ10 的水溶性,并且有效提高其口服生物利用度为原药的2.64 倍,具有广泛的应用前景。

